名校
解题方法
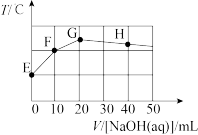
1 . 某二元酸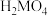 在水中分两步电离:
在水中分两步电离: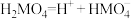 ,
, 。常温下,向
。常温下,向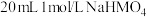 溶液中滴入
溶液中滴入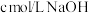 溶液,溶液温度与滴入
溶液,溶液温度与滴入 溶液体积关系如下图。下列说法中正确的是
溶液体积关系如下图。下列说法中正确的是
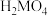 在水中分两步电离:
在水中分两步电离: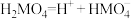 ,
, 。常温下,向
。常温下,向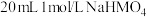 溶液中滴入
溶液中滴入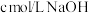 溶液,溶液温度与滴入
溶液,溶液温度与滴入 溶液体积关系如下图。下列说法中正确的是
溶液体积关系如下图。下列说法中正确的是
A.该 溶液的 溶液的 为13 为13 |
B.图像中E点对应的溶液中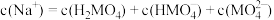 |
C.若F点对应的溶液 ,则 ,则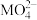 的水解平衡常数约为 的水解平衡常数约为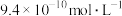 |
| D.整个过程中G点水的电离程度最大 |
您最近一年使用:0次
2021-03-13更新
|
731次组卷
|
4卷引用:四川省成都市武侯区某校2023-2024学年高三下学期入学考试理综试卷-高中化学
四川省成都市武侯区某校2023-2024学年高三下学期入学考试理综试卷-高中化学辽宁省沈阳市2021届高三教学质量监测(一)化学试题(已下线)考点23 弱电解质的电离-备战2022年高考化学一轮复习考点帮(全国通用)辽宁省沈阳市一二零中学2021-2022学年高三上学期教学质量检测一化学试题
名校
2 . 常温下,现有0.1mol•L-1 NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示:
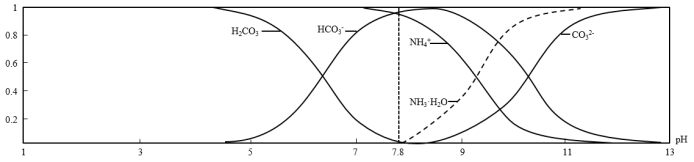
下列说法不正确的是

下列说法不正确的是
| A.分析可知,常温下Kb(NH3•H2O)>Ka1(H2CO3) |
B.0.1 mol•L-1 NH4HCO3溶液中存在:c(NH3•H2O)=c(H2CO3)+c(CO ) ) |
C.当溶液的pH=9时,溶液中存在:c(HCO )>c(NH )>c(NH )>c(NH3•H2O)>c(CO )>c(NH3•H2O)>c(CO ) ) |
D.向pH=7.8的上述溶液中逐滴滴加氢氧化钠溶液时,NH 和HCO 和HCO 浓度逐渐减小 浓度逐渐减小 |
您最近一年使用:0次
2021-03-11更新
|
256次组卷
|
4卷引用:四川省成都邛崃市高埂中学2020-2021学年高二下学期开学考试化学试题
3 . 常温下,下列说法正确的是
A.0.1mol/LNH4Cl溶液加水稀释,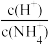 减小 减小 |
| B.已知Ka(HA)=1×10-7,则0.1mol/LHA溶液中的c(H+)约为1×10-3mol/L |
C.pH=4的NaHSO3溶液,c(H2SO3)>c(SO ) ) |
D.等浓度的下列溶液中c(NH )大小顺序为:(NH4)2SO4>NH4HSO4>NH4Cl )大小顺序为:(NH4)2SO4>NH4HSO4>NH4Cl |
您最近一年使用:0次
解题方法
4 .  具有较强还原性,其溶于水生成的氢硫酸是一种弱酸(
具有较强还原性,其溶于水生成的氢硫酸是一种弱酸(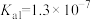 、
、 )。用
)。用 溶液吸收
溶液吸收 得
得 溶液。下列说法正确的是
溶液。下列说法正确的是
 具有较强还原性,其溶于水生成的氢硫酸是一种弱酸(
具有较强还原性,其溶于水生成的氢硫酸是一种弱酸(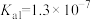 、
、 )。用
)。用 溶液吸收
溶液吸收 得
得 溶液。下列说法正确的是
溶液。下列说法正确的是A.升高 溶液的温度,一定能提高 溶液的温度,一定能提高 的吸收率 的吸收率 |
B.25℃时,若 溶液中 溶液中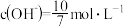 ,则 ,则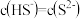 |
C.向 溶液中加入足量浓硝酸,反应生成气体,其主要成分为 溶液中加入足量浓硝酸,反应生成气体,其主要成分为 |
D. [ [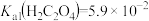 ]能与 ]能与 发生反应: 发生反应: |
您最近一年使用:0次
名校
解题方法
5 . 在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是
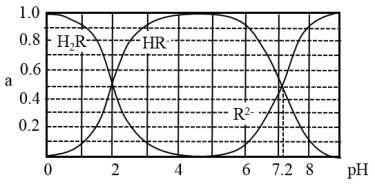

| A.H2R是二元弱酸,其Ka1=1×10-2 |
| B.当溶液恰好呈中性时,c(Na+)=c(R2-)+c(HR-) |
| C.NaHR在溶液中水解倾向大于电离倾向 |
| D.含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 |
您最近一年使用:0次
名校
解题方法
6 . 归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2:1
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka,醋酸根水解常数为Kb,水的离子积为Kw,则三者关系为:Ka·Kb=Kw
⑥反应A(g)=2B(g)△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
上述归纳正确的是个数有
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2:1
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka,醋酸根水解常数为Kb,水的离子积为Kw,则三者关系为:Ka·Kb=Kw
⑥反应A(g)=2B(g)△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
上述归纳正确的是个数有
| A.3个 | B.4个 | C.5个 | D.6个 |
您最近一年使用:0次
名校
解题方法
7 . 已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.常温下,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

| A.A2-水解平衡常数:Kh(A2-)=10-7.19 | B.a点所得溶液中:V0=10mL |
| C.c点所得溶液中:c(A2-)=c(HA-) | D.b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-) |
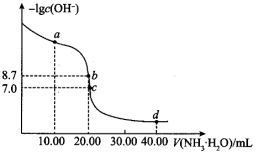
您最近一年使用:0次
8 . 25℃时,向10.00 mL 0.1000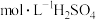 溶液中滴加相同物质的量浓度的氨水,测得混合溶液中
溶液中滴加相同物质的量浓度的氨水,测得混合溶液中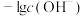 随滴加氨水体积的变化如图所示,下列说法错误的是
随滴加氨水体积的变化如图所示,下列说法错误的是
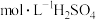 溶液中滴加相同物质的量浓度的氨水,测得混合溶液中
溶液中滴加相同物质的量浓度的氨水,测得混合溶液中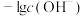 随滴加氨水体积的变化如图所示,下列说法错误的是
随滴加氨水体积的变化如图所示,下列说法错误的是
A.水的电离程度: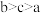 |
B.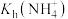 的数量级为 的数量级为 |
C.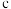 点满足 点满足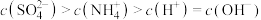 |
D.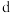 点满足 点满足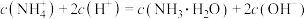 |
您最近一年使用:0次
2021-03-03更新
|
347次组卷
|
3卷引用:河南省名校联盟2021届高三下学期开学考试理综化学试题
名校
解题方法
9 . 室温下,通过下列实验探究NaHC2O4(Kh为NaHC2O4水解平衡常数、Ka1为H2C2O4电离平衡常数)溶液的性质。
下列有关说法正确的是
| 实验 | 实验操作和现象 |
| 1 | 用试纸测定0.1mol•L-1NaHC2O4溶液的pH,测得约为5.5 |
| 2 | 向含0.1molNaHC2O4稀溶液中加入0.05molBa(OH)2,产生沉淀 |
| 3 | 向0.1mol•L-1NaHC2O4溶液中通入过量HCl,无现象 |
| 4 | 向0.1mol•L-1NaHC2O4溶液中通入一定量NH3,测得溶液pH=7 |
| A.实验1的溶液中:c(OH-)=Kh•Ka1•10-5.5 |
B.实验2反应静置后的上层清液中:c(Na+)>c(C2O )>c(HC2O )>c(HC2O )>c(OH-) )>c(OH-) |
| C.实验3得到的溶液中:c(Na+)>c(Cl-)>c(H2C2O4)>c(H+) |
D.实验4所得的溶液中:c(NH )+c(H2C2O4)=c(C2O )+c(H2C2O4)=c(C2O ) ) |
您最近一年使用:0次
2021-02-26更新
|
304次组卷
|
3卷引用:江苏省连云港市2021届高三下学期开学调研考试化学试题
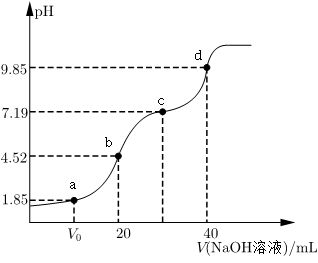
10 . 已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法不正确的是
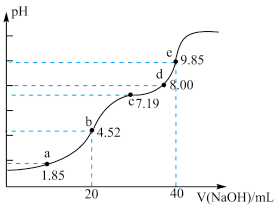

A.a点所得溶液中:2c(H2SO3)+c(SO )<0.1mol•L-1 )<0.1mol•L-1 |
B.b点所得溶液中:c(H2SO3)+c(H+)=c(SO )+c(OH-) )+c(OH-) |
C.c点所得溶液中:c(Na+)<3c(HSO ) ) |
D.d点所得溶液中:c(Na+)>c(SO )>c(HSO )>c(HSO ) ) |
您最近一年使用:0次
2021-02-24更新
|
379次组卷
|
2卷引用:安徽省滁州市定远县育才学校2021届高三下学期开学考试理综化学试题



