名校
1 . 常温下,向0.1mol/LNa2A溶液中不断通入HCl。H2A、HA-、A2-在溶液中所占物质的量分数(纵坐标)与pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是


| A.混合液的碱性不断增强 |
| B.H2A的第二级电离平衡常数的数量级为10-4 |
| C.当溶液呈中性时:c(Na+)=c(HA-)+2c(A2-) |
| D.NaHA水溶液显碱性 |
您最近一年使用:0次
2 . 已知:联氨(N2H4)是二元弱碱(pKb1=6,pKb2=15;pK=-lgK),在水中的电离方式类似于氨气,常温下,向0.1mol·L-1N2H5Cl溶液通入HCl或加入NaOH固体(假设溶液总体积不变),溶液中c(N2H )随pOH变化的曲线如图所示,下列说法错误的是
)随pOH变化的曲线如图所示,下列说法错误的是

 )随pOH变化的曲线如图所示,下列说法错误的是
)随pOH变化的曲线如图所示,下列说法错误的是
A.N2H5Cl溶液c(N2H )>c(N2H4)>c(N2H )>c(N2H4)>c(N2H ) ) |
| B.b点加入NaOH(或HCl)的物质的量与d点加入HCl(或NaOH)物质的量相等 |
| C.水的电离程度:b>a |
D.若c(N2H )>c(N2H4),则pH小于3.5 )>c(N2H4),则pH小于3.5 |
您最近一年使用:0次
2022-03-22更新
|
1391次组卷
|
3卷引用:山东省济南第一中学2023届高三上学期开学考试化学试题
解题方法
3 . 常温下,用0.10mol·L-1的NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的HA溶液和HB溶液,所得的滴定曲线如图所示(其中HA的滴定曲线部分未画出)。下列说法错误的是
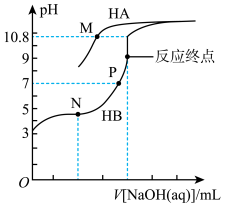
已知:M点溶液中c(A-)=c(HA)

已知:M点溶液中c(A-)=c(HA)
| A.M点溶液中,c(Na+)>c(HA) |
| B.N点溶液中,2c(Na+)=c(HB)+c(B-) |
| C.P点溶液中溶质为NaB和HB,由水电离出的c(H+)=1.0×10-7mol·L-1 |
| D.等体积等浓度的HA溶液和NaB溶液混合后的溶液中:c(OH-)<c(H+) |
您最近一年使用:0次
4 . 已知酸HA和HB的电离平衡常数为 、
、 ,则:
,则:
(1)反应 的化学平衡常数为
的化学平衡常数为_______ 。
(2)常温下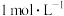 的NaB溶液中
的NaB溶液中
_______ 。
 、
、 ,则:
,则:(1)反应
 的化学平衡常数为
的化学平衡常数为(2)常温下
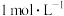 的NaB溶液中
的NaB溶液中
您最近一年使用:0次
5 . 三元酸(用H3A表示),溶液中H3A、H2A-、HA2-、A3-的百分含量随pH的变化曲线如图所示,下列说法中不正确的是


A.曲线c表示 的变化曲线 的变化曲线 |
B. 的第二步电离常数 的第二步电离常数 和第三步电离常数 和第三步电离常数 的比值约为 的比值约为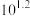 |
C.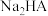 溶液中水的电离受到抑制 溶液中水的电离受到抑制 |
D. 时, 时,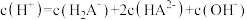 |
您最近一年使用:0次
6 . 下列有关溶液的说法中正确的是
| A.向0.1mol·L-1HF溶液中滴加NaOH溶液至中性,c(Na+)>c(F-) |
B.pH=2的H2SO3溶液与pH=12的NaOH溶液以任意比例混合:c(Na+)+c(H+)=c(OH-)+c( )+2c( )+2c( ) ) |
| C.已知H2CO3:Ka1=4.5×10-7Ka2=4.7×10-11NH3·H2O:Kb=1.8×10-5则NH4HCO3溶液中c(H+)>c(OH-) |
| D.一定温度下将足量的AgCl分别放入下列物质中:①5ml水②10ml0.1mol·L-1的MgCl2溶液③20ml0.1mol·L-1AgNO3溶液,则AgCl的溶解度由大到小的排列顺序①>②=③ |
您最近一年使用:0次
7 . 某温度下,在NaHS溶液中,各离子的浓度随NaHS溶液浓度的变化关系如图所示,下列叙述错误的是

已知:此温度时, 的
的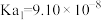 ,
,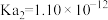 。
。

已知:此温度时,
 的
的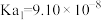 ,
,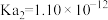 。
。A.0.1mol/L NaHS溶液: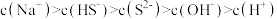 |
B. 溶液中: 溶液中: |
C.室温下,用NaOH溶液滴定等浓度的NaHS溶液,滴定终点刚好形成0.1mol/L的 溶液,该过程可以选用酚酞作指示剂 溶液,该过程可以选用酚酞作指示剂 |
D.当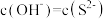 时, 时,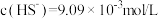 |
您最近一年使用:0次
2022-03-04更新
|
299次组卷
|
3卷引用:四川省泸州市泸县第四中学2023-2024学年高二下学期开学化学试题
名校
8 . 25°C时, H2CO3的Ka1 =4.4 ×10-7,Ka2= 4.7 ×10-11,关于NaHCO3溶液的下列说法正确的是
A.CO 的水解常数Kh =2.3× 10-8 的水解常数Kh =2.3× 10-8 |
B.HCO 的电离程度大于HCO 的电离程度大于HCO 的水解程度 的水解程度 |
| C.加水稀释时水解程度增大,溶液的pH减小 |
D.c(Na+) + c(H+)= c(HCO )+c(CO )+c(CO ) + c(OH-) ) + c(OH-) |
您最近一年使用:0次
2022-02-26更新
|
312次组卷
|
4卷引用:四川省成都外国语学校2021-2022学年高二下学期入学考试化学试题
9 . 回答下列问题
(1)已知:2Cu2S(s) +3O2(g)= 2Cu2O(s)+2SO2(g) △H1=—768.2 kJ·mol-1;
2Cu2O(s) +Cu2S(s)=6Cu(s)+SO2(g) △H2=+116.0kJ ·mol-1。
则Cu2S(s) +O2(g)=2Cu(s)+ SO2(g) △H=___________ 。
(2)某兴趣小组同学如图装置进行实验,观察到两极均有气体产生,Y极溶液逐渐变成紫红色,停止实验后观察到铁电极明显变细,电解液仍澄清。查阅资料知,高铁酸根离子(FeO )在溶液中呈紫红色。
)在溶液中呈紫红色。

①电解过程中,X极溶液的pH___________ (填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为4OH—-4e—=2H2O+O2↑和___________ 。
(3)已知常温下:
①浓度均为0.1mol·L-1的Na2S溶液、NaHCO3和Na2CO3溶液,碱性由强到弱的顺序是___________ (用“>”连接,下同)。
②S2-、HS-、CO 、HCO
、HCO 四种离子结合H+能力由大到小的顺序是
四种离子结合H+能力由大到小的顺序是___________ 。
③NaHSO3的水解常数Kh=___________ (保留 2位有效数字)。
④CH3COONH4溶液显___________ 性;NH4HCO3溶液显___________ 性。
(1)已知:2Cu2S(s) +3O2(g)= 2Cu2O(s)+2SO2(g) △H1=—768.2 kJ·mol-1;
2Cu2O(s) +Cu2S(s)=6Cu(s)+SO2(g) △H2=+116.0kJ ·mol-1。
则Cu2S(s) +O2(g)=2Cu(s)+ SO2(g) △H=
(2)某兴趣小组同学如图装置进行实验,观察到两极均有气体产生,Y极溶液逐渐变成紫红色,停止实验后观察到铁电极明显变细,电解液仍澄清。查阅资料知,高铁酸根离子(FeO
 )在溶液中呈紫红色。
)在溶液中呈紫红色。
①电解过程中,X极溶液的pH
②电解过程中,Y极发生的电极反应为4OH—-4e—=2H2O+O2↑和
(3)已知常温下:
| 弱电解质 | H2S | H2CO3 | H2SO3 | CH3COOH | NH3· H2O |
| 电离常数 | Ka1=1.1 ×10 -7 Ka2=1.3 ×10-13 | Ka1=4.5 ×10-7 Ka2=4.7 ×10-11 | Ka1=1.4 ×10-2 Ka2=6.0 ×10-8 | Ka=1.8 ×10-5 | Kb=1.8 ×10-5 |
①浓度均为0.1mol·L-1的Na2S溶液、NaHCO3和Na2CO3溶液,碱性由强到弱的顺序是
②S2-、HS-、CO
 、HCO
、HCO 四种离子结合H+能力由大到小的顺序是
四种离子结合H+能力由大到小的顺序是③NaHSO3的水解常数Kh=
④CH3COONH4溶液显
您最近一年使用:0次
解题方法
10 . 已知H2C2O4是一种二元弱酸。室温下,通过下列实验探究NaHC2O4溶液的性质。
实验1:测得10 mL0.1 mol·L-1NaHC2O4溶液的pH约为5.5
实验2:向0.1 mol·L-1NaHC2O4溶液中加入等体积0.1 mol·L-1Ba(OH)2溶液,溶液变浑浊
实验3:向酸性KMnO4溶液中滴加过量0.1 mol·L-1NaHC2O4溶液,溶液紫红色褪去。
若忽略溶液混合时的体积变化,下列说法正确的是
实验1:测得10 mL0.1 mol·L-1NaHC2O4溶液的pH约为5.5
实验2:向0.1 mol·L-1NaHC2O4溶液中加入等体积0.1 mol·L-1Ba(OH)2溶液,溶液变浑浊
实验3:向酸性KMnO4溶液中滴加过量0.1 mol·L-1NaHC2O4溶液,溶液紫红色褪去。
若忽略溶液混合时的体积变化,下列说法正确的是
A.0.1 mol·L−1H2C2O4溶液:c(H+)=0.1 mol·L-1+c(C2O )+c(OH−)−c(H2C2O4) )+c(OH−)−c(H2C2O4) |
| B.由实验1可得出:Kw>Ka1(H2C2O4)×Ka2(H2C2O4) |
| C.由实验2推测:Ksp(BaC2O4)>2.5×10−3 |
| D.由实验3推测:NaHC2O4溶液具有漂白性 |
您最近一年使用:0次



