1 . 已知25℃时:H2CO3:Ka1=4.5×10-7、Ka2=4.7×10-11;HClO:Ka=4.0×10-8、lg2=0.3;Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=2.6×10-9。
(1)0.4 mol/LHClO溶液的pH=_______ 。
(2)0.4 mol/LNaClO溶液的pH=_______ 。向该溶液中通入少量CO2,发生反应的离子方程式为_______ 。
(3)1.0 L水中投入0.1 mol BaSO4,得到BaSO4的悬浊液,向该悬浊液中投入Na2CO3固体使BaSO4全部转化为BaCO3,理论上需Na2CO3_______ mol(忽略过程中溶液体积的变化)。
(1)0.4 mol/LHClO溶液的pH=
(2)0.4 mol/LNaClO溶液的pH=
(3)1.0 L水中投入0.1 mol BaSO4,得到BaSO4的悬浊液,向该悬浊液中投入Na2CO3固体使BaSO4全部转化为BaCO3,理论上需Na2CO3
您最近一年使用:0次
2 . 乙二胺(H2NCH2CH2NH2)是二元弱碱,在溶液中的电离类似于氨,且分步电离。25℃时,乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液pOH[pOH=-lgc(OH-)]的变化曲线如图所示。下列说法错误的是


A.H2NCH2CH2NH2在水溶液中第二级电离方程式为:H2NCH2CH2NH +H2O⇌[H3NCH2CH2NH3]2++OH- +H2O⇌[H3NCH2CH2NH3]2++OH- |
| B.乙二胺一级电离平衡常数Kb1与二级电离平衡常数Kb2的比值为103 |
| C.向一定浓度的H2NCH2CH2NH2溶液中滴加稀盐酸,至B点时,溶液中的离子浓度关系:c(Cl-)+c(OH-)=3c([H3NCH2CH2NH3]2+)+c(H+) |
| D.将0.1mol/L 100 ml [H3NCH2CH2NH3]Cl2与0.1mol/L 100 mLH2NCH2CH2NH2混合,所得溶液呈酸性 |
您最近一年使用:0次
2023-02-03更新
|
697次组卷
|
3卷引用:湖北省高中名校联盟2022-2023学年高三下学期第三次联合测评化学试题
名校
3 . 柠檬酸是天然防腐剂和食品添加剂,它是一种有机三元酸,常温下可以与NaOH溶液反应生成柠檬酸钠(用Na3Y表示),下列说法正确的是
A.柠檬酸的电离方程式为H3Y 3H++Y3- 3H++Y3- |
| B.pH=2的H3Y溶液c(H+)=0.03mol•L-1 |
C.Na2HY溶液加水稀释过程中,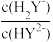 保持不变 保持不变 |
| D.Na3Y溶液的pH随着c(Na3Y)的增大而增大 |
您最近一年使用:0次
2023-02-02更新
|
165次组卷
|
2卷引用:河南省漯河市高级中学2022-2023学年高三下学期开学摸底考试化学试题
名校
解题方法
4 . 常温下,向10 mL0.1 mol·L-1Na2XO3溶液中滴加0.1 mol·L-1盐酸,溶液的pH与盐酸体积(V)的关系如图所示。下列叙述正确的是
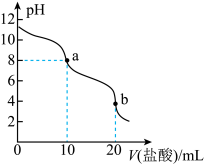

A.0.1 mol·L-1Na2XO3溶液中:c(Na+)>c(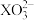 )>c( )>c(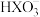 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
B.当溶液pH=7时,溶液中存在:c(Na+)=c(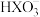 )+c( )+c(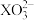 )+c(Cl-) )+c(Cl-) |
| C.常温下,H2XO3的Ka2小于1.0×10-7 |
D.b点溶液中:c(Cl-)=c(H2XO3)+c(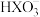 )+c( )+c(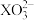 ) ) |
您最近一年使用:0次
2023-01-30更新
|
403次组卷
|
3卷引用:云南省开远市第一中学校2023-2024学年高三上学期开学考试化学试题
名校
5 . 工业上可利用氨水吸收SO2和NO2,原理如下图所示。已知: 25℃时,NH3·H2O的Kb=l.7x10-5, H2SO3的Ka1=1.3x10-2, Ka2=6.2x10-8,下列说法正确的是
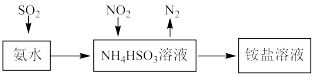
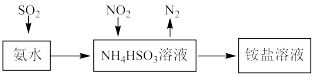
A.向氨水中通入SO2恰好生成NH4HSO3: c(H2SO3)> c(NH3·H2O)+c (SO ) ) |
B.向氨水中通入SO2至pH=7; c( HSO )>c (NH )>c (NH )> c(H+)= c(OH-) )> c(H+)= c(OH-) |
C.反应NH3·H2O + H2SO3 =NH + HSO + HSO + H2O的平衡常数K=2.21×107 + H2O的平衡常数K=2.21×107 |
D.NO2被NH4HSO3吸收的离子方程式: 2NO2+4SO = N2+ 4SO = N2+ 4SO |
您最近一年使用:0次
2023-01-17更新
|
1516次组卷
|
6卷引用: 山东省青岛第二中学2022-2023学年高二下学期期初考试化学试题
名校
解题方法
6 . 室温下,向两份浓度均为0.1 mol/L的HX溶液中分别滴加0.1 mol/L的盐酸和NaOH溶液,向两份0.1 mol/L的HY溶液中也进行同样操作,测得x[ ,其中A=X或Y]与溶液pH的关系如图所示。
,其中A=X或Y]与溶液pH的关系如图所示。

已知:Ka(HX)>Ka(HY)。下列说法正确的是
 ,其中A=X或Y]与溶液pH的关系如图所示。
,其中A=X或Y]与溶液pH的关系如图所示。
已知:Ka(HX)>Ka(HY)。下列说法正确的是
| A.溶液中水的电离程度:a>b>c |
| B.d点溶液中:c(HA)+c(A-)<0.10 mol/L |
| C.b点到c点之间,c(Na+)始终大于c(A-) |
| D.NaY溶液中的Kh=1.0×10-9.25 |
您最近一年使用:0次
2022-12-24更新
|
230次组卷
|
3卷引用:江西省九校2022-2023学年高二下学期开学联考化学试题
名校
解题方法
7 . 25°C时,向10mL0.10mol/L的H3PO2溶液中逐滴加入0.10mol/LNaOH溶液,整个滴定过程中溶液的pH随加入NaOH溶液体积的变化关系如图所示。下列说法不正确的是
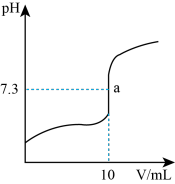

| A.H3PO2是一元弱酸 |
B.NaH2PO2溶液离子浓度: c(Na+)>c(H2PO )>c(OH- )>c(H+) )>c(OH- )>c(H+) |
C.a点: c(H2PO )+c(H3PO2) < c(Na+) )+c(H3PO2) < c(Na+) |
| D.NaH2PO2 水解平衡常数为Kh=2×10-12.4 |
您最近一年使用:0次
2022-12-14更新
|
175次组卷
|
3卷引用:江西省丰城中学2022-2023学年高二下学期开学考试化学试题
名校
解题方法
8 . 已知 时,几种物质的电离平衡常数
时,几种物质的电离平衡常数 如下表:
如下表:
(1)下列四种离子结合 能力最强的是
能力最强的是___________ (填字母)。
a. b.
b. c.
c. d.
d.
(2) 时,
时, 的水解常数
的水解常数
___________ ;若向 溶液中加入少量的
溶液中加入少量的 ,则溶液中
,则溶液中 将
将___________ (填“增大”、“减小”或“不变”)。
(3) 溶液和
溶液和 溶液反应的离子方程式为
溶液反应的离子方程式为___________ 。
(4) 时,浓度均为
时,浓度均为 的
的 溶液和
溶液和 溶液,若要使两溶液的
溶液,若要使两溶液的 相等,应___________(填字母)。
相等,应___________(填字母)。
(5)若将 的
的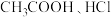 两溶液分别加水稀释,
两溶液分别加水稀释, 变化如图所示,判断曲线I对应的为
变化如图所示,判断曲线I对应的为___________ (填化学式)溶液,图中a、b、c三点对应溶液的导电能力由强到弱的顺序是___________ 。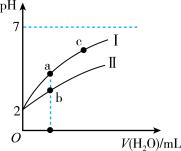
(6) 时,将
时,将 的氨水与
的氨水与 的盐酸等体积混合,反应平衡时溶液中
的盐酸等体积混合,反应平衡时溶液中 ,用含a的代数式表示
,用含a的代数式表示 的电离常数
的电离常数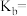
___________ 。
 时,几种物质的电离平衡常数
时,几种物质的电离平衡常数 如下表:
如下表:| 化学式 |  |  | 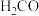 |  |
| 电离常数 |  | 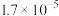 | 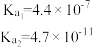 | 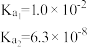 |
 能力最强的是
能力最强的是a.
 b.
b. c.
c. d.
d.
(2)
 时,
时, 的水解常数
的水解常数
 溶液中加入少量的
溶液中加入少量的 ,则溶液中
,则溶液中 将
将(3)
 溶液和
溶液和 溶液反应的离子方程式为
溶液反应的离子方程式为(4)
 时,浓度均为
时,浓度均为 的
的 溶液和
溶液和 溶液,若要使两溶液的
溶液,若要使两溶液的 相等,应___________(填字母)。
相等,应___________(填字母)。A.向 溶液中加适量的水 溶液中加适量的水 | B.向 溶液中加适量的 溶液中加适量的 |
C.向 溶液中加适量的 溶液中加适量的 | D.向 溶液中加适量的水 溶液中加适量的水 |
 的
的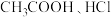 两溶液分别加水稀释,
两溶液分别加水稀释, 变化如图所示,判断曲线I对应的为
变化如图所示,判断曲线I对应的为
(6)
 时,将
时,将 的氨水与
的氨水与 的盐酸等体积混合,反应平衡时溶液中
的盐酸等体积混合,反应平衡时溶液中 ,用含a的代数式表示
,用含a的代数式表示 的电离常数
的电离常数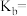
您最近一年使用:0次
2022-12-06更新
|
128次组卷
|
2卷引用:四川省泸州市泸县第四中学2023-2024学年高二下学期开学化学试题
名校
9 . Na2CO3水溶液中存在CO +H2O
+H2O HCO
HCO +OH-平衡。下列说法不正确的是
+OH-平衡。下列说法不正确的是
 +H2O
+H2O HCO
HCO +OH-平衡。下列说法不正确的是
+OH-平衡。下列说法不正确的是A.稀释溶液,  增大 增大 | B.通入CO2,溶液pH减小 |
| C.升高温度,此平衡常数增大 | D.加入NaOH固体,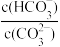 减小 减小 |
您最近一年使用:0次
2022-12-05更新
|
408次组卷
|
19卷引用:云南省大理市下关第一中学2023-2024学年高二下学期开学化学试题
云南省大理市下关第一中学2023-2024学年高二下学期开学化学试题2015届山东省桓台县第二中学高三1月检测化学试卷2016届山东省桓台第二中学高三上学期期中测试化学试卷(已下线)2018年11月1日 《每日一题》人教选修4-盐类水解的影响因素(已下线)2019年1月5日 《每日一题》人教选修4-周末培优【全国百强校】广西南宁市第三中学2018-2019学年高二下学期第一次月考化学试题宁夏吴忠中学2019-2020学年高二上学期期中考试化学试题辽宁省沈阳市城郊市重点联合体2019-2020学年高二上学期期中考试(2)化学试题安徽省青阳县第一中学2019-2020学年高二11月月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 水解平衡常数的应用云南省昆明市东川区明月中学2018-2019学年高二下学期期中考试化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过模拟 2年模拟精编精练山东省泰安市新泰中学2020-2021学年高二上学期第二次阶段性考试化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期期中考试化学试题河南省许昌市鄢陵县职业教育中心2021-2022学年高二上学期期中考试化学试题江西省南昌县莲塘第一中学2022-2023学年高二上学期11月期中化学试题黑龙江省牡丹江市第二高级中学2022-2023学年高二上学期1月期末考试化学试题吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高二上学期1月期末化学试题山东省新泰市第一中学老校区(新泰中学)2023-2024学年高二上学期第二次月考化学试题
名校
解题方法
10 . 常温下,将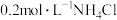 溶液与
溶液与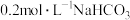 溶液等体积混合后(忽略体积变化),所得混合溶液的pH为7.8。溶液中的含碳粒子和含氮粒子的分布系数(
溶液等体积混合后(忽略体积变化),所得混合溶液的pH为7.8。溶液中的含碳粒子和含氮粒子的分布系数( )随溶液pH的变化如图所示:
)随溶液pH的变化如图所示:

下列有关描述中正确的是
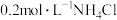 溶液与
溶液与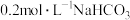 溶液等体积混合后(忽略体积变化),所得混合溶液的pH为7.8。溶液中的含碳粒子和含氮粒子的分布系数(
溶液等体积混合后(忽略体积变化),所得混合溶液的pH为7.8。溶液中的含碳粒子和含氮粒子的分布系数( )随溶液pH的变化如图所示:
)随溶液pH的变化如图所示:
下列有关描述中正确的是
A.常温下,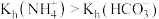 |
B.混合溶液中存在: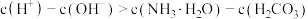 |
C.当向该混合溶液中逐滴加入NaOH溶液时, 、 、 均逐渐减小 均逐渐减小 |
D.当溶液pH=11时,溶液中粒子浓度的大小关系: |
您最近一年使用:0次
2022-11-27更新
|
438次组卷
|
3卷引用:辽宁省瓦房店市高级中学2022-2023学年高三下学期期初考试化学试题



