名校
1 .  时,向
时,向 溶液中滴加
溶液中滴加 的盐酸,用电导率仪测得滴加盐酸体积与溶液电导率的关系如图所示。已知
的盐酸,用电导率仪测得滴加盐酸体积与溶液电导率的关系如图所示。已知 属于三元弱酸,其电离平衡常数的
属于三元弱酸,其电离平衡常数的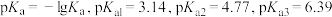 。下列说法正确的是
。下列说法正确的是
 时,向
时,向 溶液中滴加
溶液中滴加 的盐酸,用电导率仪测得滴加盐酸体积与溶液电导率的关系如图所示。已知
的盐酸,用电导率仪测得滴加盐酸体积与溶液电导率的关系如图所示。已知 属于三元弱酸,其电离平衡常数的
属于三元弱酸,其电离平衡常数的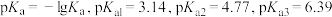 。下列说法正确的是
。下列说法正确的是
A.a点溶液中: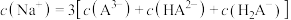 |
B.b点溶液中: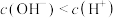 |
C. 点溶液中: 点溶液中: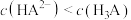 |
D.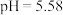 时,溶液中: 时,溶液中: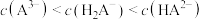 |
您最近一年使用:0次
2024-02-23更新
|
186次组卷
|
4卷引用:河南省郑州市第五高级中学2023-2024学年高三2月开学考理综试题-高中化学
名校
2 . 乙二酸( 或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。
或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。
(1)草酸第一步电离的电离方程式为___________________________ 。
(2)草酸可用来测定未知浓度的 溶液(用草酸滴定
溶液(用草酸滴定 溶液)。
溶液)。
①实验过程中,草酸应用___________ (填“酸式”或“碱式”)滴定管盛装。
②判断达到滴定终点时的现象为_______________________________________________________ 。
③若滴定完成后仰视读数,则测得的 溶液浓度
溶液浓度___________ (“偏高”、“偏低”或“无影响”)。
(3)常温下,草酸溶液中微粒的物质的量分数随溶液pH的变化如图所示:
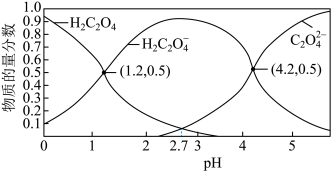
已知:常温下, 的电离平衡常数
的电离平衡常数 ,
, 。
。
①常温下,草酸的电离平衡常数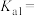
___________ 。
②相同条件下,物质的量浓度均为0.1 的
的 溶液的pH比
溶液的pH比 溶液的pH
溶液的pH__________ (填“大”或“小”)。
③常温下,向10mL 0.1
 溶液中逐滴加入0.1
溶液中逐滴加入0.1 KOH溶液,随着KOH溶液体积的增加,当溶液中
KOH溶液,随着KOH溶液体积的增加,当溶液中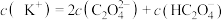 时,加入的V(KOH溶液)
时,加入的V(KOH溶液)___________ (填“>”、“=”或“<”)10mL,若加入KOH溶液体积为10mL溶液中 、
、 、
、 的浓度由大到小的顺序为
的浓度由大到小的顺序为________________________ 。
 或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。
或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。(1)草酸第一步电离的电离方程式为
(2)草酸可用来测定未知浓度的
 溶液(用草酸滴定
溶液(用草酸滴定 溶液)。
溶液)。①实验过程中,草酸应用
②判断达到滴定终点时的现象为
③若滴定完成后仰视读数,则测得的
 溶液浓度
溶液浓度(3)常温下,草酸溶液中微粒的物质的量分数随溶液pH的变化如图所示:

已知:常温下,
 的电离平衡常数
的电离平衡常数 ,
, 。
。①常温下,草酸的电离平衡常数
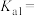
②相同条件下,物质的量浓度均为0.1
 的
的 溶液的pH比
溶液的pH比 溶液的pH
溶液的pH③常温下,向10mL 0.1

 溶液中逐滴加入0.1
溶液中逐滴加入0.1 KOH溶液,随着KOH溶液体积的增加,当溶液中
KOH溶液,随着KOH溶液体积的增加,当溶液中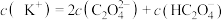 时,加入的V(KOH溶液)
时,加入的V(KOH溶液) 、
、 、
、 的浓度由大到小的顺序为
的浓度由大到小的顺序为
您最近一年使用:0次
2023-02-11更新
|
188次组卷
|
2卷引用:河南省名校2022-2023学年高二下学期开学考试化学试题
3 . 已知25℃时:H2CO3:Ka1=4.5×10-7、Ka2=4.7×10-11;HClO:Ka=4.0×10-8、lg2=0.3;Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=2.6×10-9。
(1)0.4 mol/LHClO溶液的pH=_______ 。
(2)0.4 mol/LNaClO溶液的pH=_______ 。向该溶液中通入少量CO2,发生反应的离子方程式为_______ 。
(3)1.0 L水中投入0.1 mol BaSO4,得到BaSO4的悬浊液,向该悬浊液中投入Na2CO3固体使BaSO4全部转化为BaCO3,理论上需Na2CO3_______ mol(忽略过程中溶液体积的变化)。
(1)0.4 mol/LHClO溶液的pH=
(2)0.4 mol/LNaClO溶液的pH=
(3)1.0 L水中投入0.1 mol BaSO4,得到BaSO4的悬浊液,向该悬浊液中投入Na2CO3固体使BaSO4全部转化为BaCO3,理论上需Na2CO3
您最近一年使用:0次
名校
4 . 柠檬酸是天然防腐剂和食品添加剂,它是一种有机三元酸,常温下可以与NaOH溶液反应生成柠檬酸钠(用Na3Y表示),下列说法正确的是
A.柠檬酸的电离方程式为H3Y 3H++Y3- 3H++Y3- |
| B.pH=2的H3Y溶液c(H+)=0.03mol•L-1 |
C.Na2HY溶液加水稀释过程中,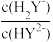 保持不变 保持不变 |
| D.Na3Y溶液的pH随着c(Na3Y)的增大而增大 |
您最近一年使用:0次
2023-02-02更新
|
164次组卷
|
2卷引用:河南省漯河市高级中学2022-2023学年高三下学期开学摸底考试化学试题
名校
5 . 赖氨酸[ ,用HR表示]是人体必需氨基酸。常温下,赖氨酸与足量盐酸反应可得盐酸盐(H3RCl2),H3RCl2呈酸性,在水溶液中存在电离平衡:
,用HR表示]是人体必需氨基酸。常温下,赖氨酸与足量盐酸反应可得盐酸盐(H3RCl2),H3RCl2呈酸性,在水溶液中存在电离平衡: 。下列叙述正确的是
。下列叙述正确的是
 ,用HR表示]是人体必需氨基酸。常温下,赖氨酸与足量盐酸反应可得盐酸盐(H3RCl2),H3RCl2呈酸性,在水溶液中存在电离平衡:
,用HR表示]是人体必需氨基酸。常温下,赖氨酸与足量盐酸反应可得盐酸盐(H3RCl2),H3RCl2呈酸性,在水溶液中存在电离平衡: 。下列叙述正确的是
。下列叙述正确的是A.0.01 H3RCl2的水溶液稀释10倍后,pH=3 H3RCl2的水溶液稀释10倍后,pH=3 |
B. H3RCl2的水溶液中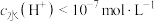 |
C. H3RCl2水溶液中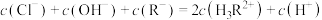 |
D.NaR水溶液中R-的水解平衡常数 与 与 的关系为 的关系为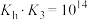 |
您最近一年使用:0次
2022-10-24更新
|
337次组卷
|
11卷引用:河南省百所名校2023届高三上学期开学摸底联考化学试题
河南省百所名校2023届高三上学期开学摸底联考化学试题广东省2023届高三8月开学摸底大联考化学试题河北省秦皇岛市部分学校2022-2023学年高三上学期开学考试化学试题重庆八中2022-2023学年高三上学期入学考试化学试题辽宁省2022-2023学年高三上学期开学摸底联考化学试题陕西省咸阳高新一中2023届高三上学期第一次质量检测化学试题内蒙古自治区阿拉善盟第一中学2023届高三上学期8月月考化学试题浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题江苏省建湖高级中学2023-2024学年高三上学期暑期学情检测(一)化学试题云南省大理市下关第一中学2023-2024学年高二上学期12月月考化学试题
名校
6 . 室温下,向10mL 0.1000mol∙L-1二元酸H2B溶液中滴加0.1000 mol∙L-1 KOH溶液,测得溶液的pH与lgY [Y代表 或
或 ]的关系如图所示。下列相关结论不正确的是
]的关系如图所示。下列相关结论不正确的是

 或
或 ]的关系如图所示。下列相关结论不正确的是
]的关系如图所示。下列相关结论不正确的是
A.曲线N表示的是lg 与pH的变化关系 与pH的变化关系 |
| B.当滴加10mL KOH溶液时,溶液中c(H2B)>c(B2-) |
| C.X点对应的pH为6.5 |
| D.若用酚酞做指示剂,则滴定终点颜色变化为无色变粉红色 |
您最近一年使用:0次
2022-04-01更新
|
617次组卷
|
4卷引用:河南省洛阳市孟津区第一高级中学2022-2023学年高三下学期入学考试化学试题
河南省洛阳市孟津区第一高级中学2022-2023学年高三下学期入学考试化学试题重庆市西南大学附属中学校2022届高三模拟考试(一)化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(全国甲卷)湖北省普通高中2022届高三学业水平选择性考试5月适应性考试化学试题
解题方法
7 . 常温下,用0.10mol·L-1的NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的HA溶液和HB溶液,所得的滴定曲线如图所示(其中HA的滴定曲线部分未画出)。下列说法错误的是
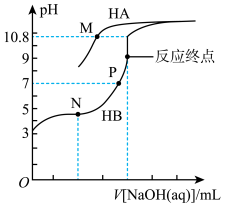
已知:M点溶液中c(A-)=c(HA)

已知:M点溶液中c(A-)=c(HA)
| A.M点溶液中,c(Na+)>c(HA) |
| B.N点溶液中,2c(Na+)=c(HB)+c(B-) |
| C.P点溶液中溶质为NaB和HB,由水电离出的c(H+)=1.0×10-7mol·L-1 |
| D.等体积等浓度的HA溶液和NaB溶液混合后的溶液中:c(OH-)<c(H+) |
您最近一年使用:0次
8 . 室温下,向0.2mol·L-1HA溶液中滴加NaOH溶液,溶液的pH与粒子浓度比值的对数[lg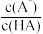 ]关系如图所示。下列叙述正确的是
]关系如图所示。下列叙述正确的是
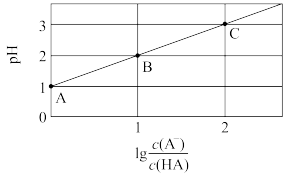
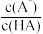 ]关系如图所示。下列叙述正确的是
]关系如图所示。下列叙述正确的是
| A.将A点溶液加水稀释100倍后与C点溶液的pH相等 |
| B.B点溶液中:c(Na+)>c(A-)>c(HA) |
| C.将等浓度的HA、NaA溶液混合,混合液呈碱性 |
| D.室温下,NaA的水解平衡常数Kh=1×10-3 |
您最近一年使用:0次
9 . 草酸(H2C2O4)及其化合物在医药、印染、塑料等方面扮演着重要角色,同时广泛应用于化学实验中。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁( )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:
Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量 溶液,使其充分反应。
溶液,使其充分反应。
Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用___________ (填“酸式”或“碱式”)滴定管盛装,达到滴定终点的现象是___________ 。
②下列关于实验误差的说法正确的是___________ (填标号)。
A.步骤Ⅰ中,若加入的 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高
B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的 含量偏低
含量偏低
C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的 含量偏低
含量偏低
D.步骤Ⅱ中,过滤时间过长,可能导致测得的 含量偏低
含量偏低
③0.50g该样品中 的质量分数为
的质量分数为___________ (不考虑损耗)。
(2)常温下,改变0.1mol/L的 溶液的pH,溶液中
溶液的pH,溶液中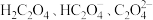 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
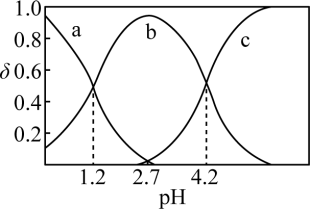
①曲线___________ (填“a”、“b”或“c”)代表 ,
, 时,溶液中
时,溶液中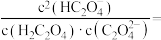
___________ 。
②pH从1.2增大至4.2的过程中,水的电离程度___________ (填“增大”、“减小”或“不变”)。
③ 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为___________ 。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁(
 )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量
 溶液,使其充分反应。
溶液,使其充分反应。Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用
②下列关于实验误差的说法正确的是
A.步骤Ⅰ中,若加入的
 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的
 含量偏低
含量偏低C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的
 含量偏低
含量偏低D.步骤Ⅱ中,过滤时间过长,可能导致测得的
 含量偏低
含量偏低③0.50g该样品中
 的质量分数为
的质量分数为(2)常温下,改变0.1mol/L的
 溶液的pH,溶液中
溶液的pH,溶液中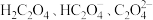 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
①曲线
 ,
, 时,溶液中
时,溶液中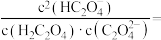
②pH从1.2增大至4.2的过程中,水的电离程度
③
 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为
您最近一年使用:0次
2022-01-21更新
|
129次组卷
|
3卷引用:河南省许平汝联盟2021-2022学年高二下学期开学考试化学试题
名校
10 . 常温下,Ka(HCOOH)=1.77 ×10-4, Ka(CH3COOH)=1.75 × 10-5。下列说法正确的是
| A.相同体积pH均为3的HCOOH和CH3COOH溶液,中和NaOH的能力相同 |
| B.0.2 mol·L-1 HCOOH与0.1 mol·L-1 NaOH等体积混合后:c(HCOO- ) + c(OH -) < c(HCOOH)+ c(H+) |
| C.等浓度的CH3COONa溶液与HCOONa溶液,后者溶液pH大 |
D.将CH3COONa溶液从20°C升温至30°C, 溶液中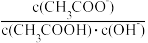 减小 减小 |
您最近一年使用:0次
2022-01-10更新
|
707次组卷
|
3卷引用:河南省周口恒大中学2022-2023学年高二下学期开学考试化学试题



