名校
解题方法
1 . 已知亚磷酸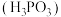 是二元弱酸。常温下,向
是二元弱酸。常温下,向 溶液中滴加
溶液中滴加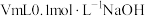 溶液,溶液的
溶液,溶液的 与
与 的关系如图所示。
的关系如图所示。

下列叙述错误的是
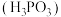 是二元弱酸。常温下,向
是二元弱酸。常温下,向 溶液中滴加
溶液中滴加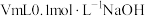 溶液,溶液的
溶液,溶液的 与
与 的关系如图所示。
的关系如图所示。
下列叙述错误的是
A. 时溶液中 时溶液中 |
B. |
C. 的平衡常数 的平衡常数 为 为 |
D.图中 |
您最近一年使用:0次
2024-02-08更新
|
90次组卷
|
2卷引用:河南省南阳市六校2023-2024学年高二上学期1月期末联考化学试题
2 . 常温下,向 、
、 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液, 与
与 的关系如图所示。已知:
的关系如图所示。已知: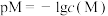 ,
,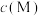 代表
代表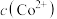 、
、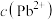 或
或 ;
;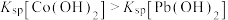 ;当被沉淀的离子的物质的量浓度
;当被沉淀的离子的物质的量浓度 时,认为该离子已沉淀完全。下列叙述错误的是
时,认为该离子已沉淀完全。下列叙述错误的是
 、
、 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液, 与
与 的关系如图所示。已知:
的关系如图所示。已知: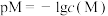 ,
,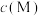 代表
代表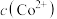 、
、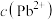 或
或 ;
;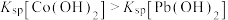 ;当被沉淀的离子的物质的量浓度
;当被沉淀的离子的物质的量浓度 时,认为该离子已沉淀完全。下列叙述错误的是
时,认为该离子已沉淀完全。下列叙述错误的是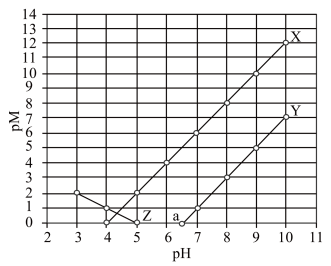
A. 、 、 分别代表 分别代表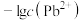 、 、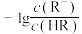 与 与 的关系 的关系 |
B.图中 点对应溶液的 点对应溶液的 为6.5,此时溶液中 为6.5,此时溶液中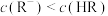 |
C.常温下, 的水解平衡常数 的水解平衡常数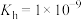 |
D.向浓度均为 的 的 和 和 的混合溶液中逐滴加入 的混合溶液中逐滴加入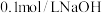 溶液,能通过沉淀的方式将两种离子分离 溶液,能通过沉淀的方式将两种离子分离 |
您最近一年使用:0次
2024-02-04更新
|
569次组卷
|
2卷引用:河南省南阳市2023-2024学年高三上学期1月期末考试理综化学试题
解题方法
3 . 丙二酸( )是二元弱酸。298K时,向一定浓度的
)是二元弱酸。298K时,向一定浓度的 溶液中滴加盐酸,混合溶液中含碳粒子浓度pX与pH的关系如图所示。已知:
溶液中滴加盐酸,混合溶液中含碳粒子浓度pX与pH的关系如图所示。已知: ,
, 或
或 )下列叙述正确的是
)下列叙述正确的是

 )是二元弱酸。298K时,向一定浓度的
)是二元弱酸。298K时,向一定浓度的 溶液中滴加盐酸,混合溶液中含碳粒子浓度pX与pH的关系如图所示。已知:
溶液中滴加盐酸,混合溶液中含碳粒子浓度pX与pH的关系如图所示。已知: ,
, 或
或 )下列叙述正确的是
)下列叙述正确的是
A.直线 表示pH与 表示pH与 的关系 的关系 |
B. 稀溶液与等体积、等浓度的盐酸混合后, 稀溶液与等体积、等浓度的盐酸混合后, |
C.当 时,溶液pH=3.26 时,溶液pH=3.26 |
D. 的溶液中的溶质可能是 的溶液中的溶质可能是 和 和 |
您最近一年使用:0次
名校
解题方法
4 . 常温下,向10 mL0.1 mol·L-1Na2XO3溶液中滴加0.1 mol·L-1盐酸,溶液的pH与盐酸体积(V)的关系如图所示。下列叙述正确的是
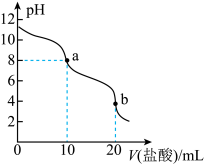

A.0.1 mol·L-1Na2XO3溶液中:c(Na+)>c(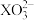 )>c( )>c(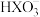 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
B.当溶液pH=7时,溶液中存在:c(Na+)=c(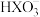 )+c( )+c(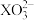 )+c(Cl-) )+c(Cl-) |
| C.常温下,H2XO3的Ka2小于1.0×10-7 |
D.b点溶液中:c(Cl-)=c(H2XO3)+c(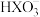 )+c( )+c(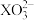 ) ) |
您最近一年使用:0次
2023-01-30更新
|
401次组卷
|
3卷引用:河南省驻马店市2022-2023学年高三上学期1月期末测试化学试题
名校
解题方法
5 . 下列说法正确的是
A.常温下,0.1mol·L-1CH3COONa溶液加水稀释后,溶液中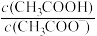 的值增大 的值增大 |
| B.常温下,等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同 |
| C.常温下,反应NH3(g)+HCl(g)=NH4Cl(s)能自发发生反应,则该反应的∆H>0 |
D.常温下,向BaCO3、BaSO4 的饱和溶液中加入少量BaCl2固体,溶液中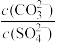 减小 减小 |
您最近一年使用:0次
2022-12-09更新
|
287次组卷
|
6卷引用:河南省安阳市第一中学2020-2021学年高二上学期期末考试化学试题
名校
6 . 常温时,用0.10mol/L NaOH溶液滴定25.00mL 0.10mol/L一元酸HX的溶液,滴定过程中pH变化曲线如图所示。若忽略反应过程中国液体密度变化而导致的体积变化,则下列判断正确的是


A.常温下,HX溶液的电离常数 | B.A点溶液中: |
C.B点溶液中: | D.C点溶液中: |
您最近一年使用:0次
解题方法
7 . 高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和沉淀溶解平衡等,它们在工农业生产中都有广泛的应用。请回答下列问题:
Ⅰ.化学平衡
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g) CO(NH2)2(1)+H2O(l)
CO(NH2)2(1)+H2O(l)
(1)将2 mol NH3和1 mol CO2投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是_______ (填字母)。
a.2υ正(NH3) = υ逆(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d. CO2、NH3的体积分数均不再改变
(2)取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度 下反应达平衡,若在恒温、恒压下充入气体He, CO(NH2)2(l)的质量_______ (填“增加”“减小”或“不变”)。
Ⅱ.电离平衡、水解平衡
(3)某温度下,纯水中c(H+)=2.0 ×10−7 mol∙L−1, 该温度下,0.09 mol∙L−1NaOH溶液与0.01 mol∙L−1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=_______ 。
(4)H2A是一种二元弱酸,25℃时不同pH,H2A、HA-、A2−的物种分布如图所示:

①向0.1 mol∙L−1H2A的溶液中逐滴滴加NaOH溶液,写出pH由3~5时所发生反应的离子方程式:_______ 。
②pH=2.2时,溶液c(H2A):c(HA-)=_______ 。
③0.1 mol∙L−1NaHA溶液显_______ (填“酸性 ”碱性”或“中性”) 。
Ⅲ.沉淀溶解平衡
(5)如图为某温度下,PbS(s)、 ZnS(s)、 FeS(s)分 别在溶液中达到沉淀溶解平衡后,溶液c(S2−)、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是_______ (填化学式)。

(6)已知常温下,FeS的Ksp= 6.3 ×10−18, H2S的饱和溶液中c(H+)与c(S2−)之间存在如下关系: c2(H+)·c(S2−)=1.0×10−22,将适量FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.063 mol∙L−1,应调节溶液的pH=_______ 。
Ⅰ.化学平衡
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(l)
CO(NH2)2(1)+H2O(l)(1)将2 mol NH3和1 mol CO2投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是
a.2υ正(NH3) = υ逆(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d. CO2、NH3的体积分数均不再改变
(2)取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度 下反应达平衡,若在恒温、恒压下充入气体He, CO(NH2)2(l)的质量
Ⅱ.电离平衡、水解平衡
(3)某温度下,纯水中c(H+)=2.0 ×10−7 mol∙L−1, 该温度下,0.09 mol∙L−1NaOH溶液与0.01 mol∙L−1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=
(4)H2A是一种二元弱酸,25℃时不同pH,H2A、HA-、A2−的物种分布如图所示:

①向0.1 mol∙L−1H2A的溶液中逐滴滴加NaOH溶液,写出pH由3~5时所发生反应的离子方程式:
②pH=2.2时,溶液c(H2A):c(HA-)=
③0.1 mol∙L−1NaHA溶液显
Ⅲ.沉淀溶解平衡
(5)如图为某温度下,PbS(s)、 ZnS(s)、 FeS(s)分 别在溶液中达到沉淀溶解平衡后,溶液c(S2−)、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是

(6)已知常温下,FeS的Ksp= 6.3 ×10−18, H2S的饱和溶液中c(H+)与c(S2−)之间存在如下关系: c2(H+)·c(S2−)=1.0×10−22,将适量FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.063 mol∙L−1,应调节溶液的pH=
您最近一年使用:0次
解题方法
8 . 以酚酞为指示剂,用0.3000mol/L的NaOH溶液滴定20.00mL,0.3 mol/L的弱酸H3A溶液。溶液中,含A的粒子分布系数δ随溶液pH的变化关系如图所示[比如H3A的分布系数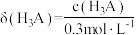 ]。下列叙述正确的是
]。下列叙述正确的是

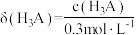 ]。下列叙述正确的是
]。下列叙述正确的是
| A.曲线①代表δ(HA2-),曲线②代表δ(H2A-) |
B.H3A的第三级电离:HA2- H++A3- H++A3- |
| C.H3A的电离常数Ka1=1.0×10-7 |
D.当所加NaOH溶液体积为40mL, 时,c(H2A-)约为106-amol/L 时,c(H2A-)约为106-amol/L |
您最近一年使用:0次
2022-07-10更新
|
439次组卷
|
2卷引用:河南省安阳市滑县2021-2022学年高二下学期期末测评化学试题
解题方法
9 . 25℃时,将 溶液逐滴滴加到
溶液逐滴滴加到 等浓度的KF溶液中,
等浓度的KF溶液中, 与溶液
与溶液 的关系如图所示(以M点为起点)。下列相关结论错误的是
的关系如图所示(以M点为起点)。下列相关结论错误的是

 溶液逐滴滴加到
溶液逐滴滴加到 等浓度的KF溶液中,
等浓度的KF溶液中, 与溶液
与溶液 的关系如图所示(以M点为起点)。下列相关结论错误的是
的关系如图所示(以M点为起点)。下列相关结论错误的是
A.随着 溶液的滴入,溶液中的 溶液的滴入,溶液中的 逐渐减小 逐渐减小 |
| B.F-的水解常数的数量级是10-11 |
C.N点存在: |
| D.当溶液pH每减小1,其加入的HCl溶液的体积不相同 |
您最近一年使用:0次
2022-06-29更新
|
100次组卷
|
2卷引用:河南省南阳市六校2021-2022学年高二下学期期末考试化学试题
10 . 常温下,向20mL0.1mol·L-1的HCOOH溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法正确的是


| A.c、d、f三点中H2O的电离程度的大小顺序为:d>c>f |
| B.e点溶液对应的pH=7 |
| C.常温下,HCOO-的水解平衡常数Kh约为1×10-5mol·L-1 |
| D.b点的溶液呈酸性,粒子浓度之间存在:c(HCOOH)+c(H+)=c(OH-)+c(HCOO-) |
您最近一年使用:0次



