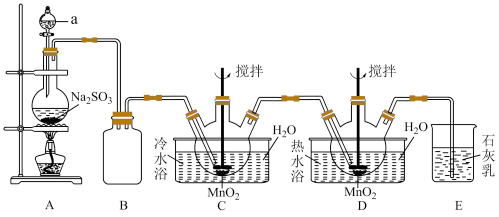
1 . 连二硫酸锰(MnS2O6)常用于灭菌以及水果、蔬菜的保鲜。硫酸锰(MnSO4)是重要的微量元素肥料之一,也用作饲料添加剂,在涂料、造纸、陶瓷、电子、纺织等领域也有广泛应用。利用MnO2悬浊液吸收SO2气体制取MnS2 O6和MnSO4的装置如图所示(部分夹持仪器、加热仪器未画出)。
②连二硫酸锰晶体的化学式为MnS2O6·4H2O。
③连二硫酸钡(BaS2O6)易溶于水,氢氧化锰[Mn(OH)2]难溶于水。
回答下列问题:
(1)仪器a的名称为___________ ,该仪器中装入的试剂最好为___________ (填标号)。
A.稀盐酸 B.70%的浓硫酸 C.98%的浓硫酸 D.稀硝酸
(2)连二硫酸锰在装置___________ (填标号)中生成,装置B的作用为___________ 。
(3)从实验后过滤所得的反应混合液(含有少量杂质MnSO4)中得到纯净的MnS2O6溶液的操作方法和除杂的反应原理为___________ 。
(4)由MnS2O6溶液得到MnS2O6·4H2O晶体的操作方法是___________ 。
(5)测定MnS2O6中锰的含量:称取wg产品充分加热,加适量水溶解,用amol·L-1KMnO4标准溶液进行滴定(Mn元素均转化为MnO2),滴定终点时消耗bmL标准溶液。___________ 。(填标号)
A.滴定管活塞涂凡士林:取下活塞,用滤纸擦干,用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从滴定管架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准溶液体积小于5.00mL,则第二次滴定时可稀释待测液后重新滴定来减小误差
②实验过程中若晶体加热不充分,测得产品中锰的质量分数将___________ (填“偏大”“偏小”或“无影响”)。
③产品中锰的质量分数是___________ (列出计算式)。
②连二硫酸锰晶体的化学式为MnS2O6·4H2O。
③连二硫酸钡(BaS2O6)易溶于水,氢氧化锰[Mn(OH)2]难溶于水。
回答下列问题:
(1)仪器a的名称为
A.稀盐酸 B.70%的浓硫酸 C.98%的浓硫酸 D.稀硝酸
(2)连二硫酸锰在装置
(3)从实验后过滤所得的反应混合液(含有少量杂质MnSO4)中得到纯净的MnS2O6溶液的操作方法和除杂的反应原理为
(4)由MnS2O6溶液得到MnS2O6·4H2O晶体的操作方法是
(5)测定MnS2O6中锰的含量:称取wg产品充分加热,加适量水溶解,用amol·L-1KMnO4标准溶液进行滴定(Mn元素均转化为MnO2),滴定终点时消耗bmL标准溶液。

A.滴定管活塞涂凡士林:取下活塞,用滤纸擦干,用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从滴定管架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准溶液体积小于5.00mL,则第二次滴定时可稀释待测液后重新滴定来减小误差
②实验过程中若晶体加热不充分,测得产品中锰的质量分数将
③产品中锰的质量分数是
您最近一年使用:0次
2023-09-14更新
|
230次组卷
|
2卷引用:山东省金科大联考2023-2024学年高三9月联考化学试题
名校
2 . 常温下, 的溶液A中含有
的溶液A中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的四种,且溶液中各离子的浓度均为0.1
中的四种,且溶液中各离子的浓度均为0.1 。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
 的溶液A中含有
的溶液A中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的四种,且溶液中各离子的浓度均为0.1
中的四种,且溶液中各离子的浓度均为0.1 。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是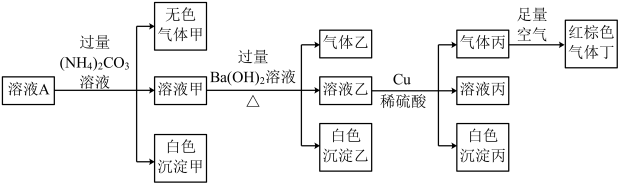
A.溶液A中一定含有 、 、 、 、 、 、 |
B.若实验消耗 14.4g,则生成气体丁的体积为3.36L 14.4g,则生成气体丁的体积为3.36L |
C.沉淀乙中一定有 ,可能有 ,可能有 |
D.溶液A中一定没有 ,但是无法确定是否含有 ,但是无法确定是否含有 |
您最近一年使用:0次
2023-02-08更新
|
240次组卷
|
17卷引用:河北省定州中学2018届高三(承智班)下学期开学考试化学试题
河北省定州中学2018届高三(承智班)下学期开学考试化学试题河南省豫南豫北名校2018届高三精英联赛化学试题1江西省莲塘一中、临川二中2018届高三上学期第一次联考化学试题(已下线)黄金30题系列 高三化学 小题易丢分陕西省陕师大附中2018届高三第五次月考化学试题河南省南阳市第一中学校2018届高三第七次考试理综化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2西藏自治区拉萨中学2018届高三第六次月考理综化学试题湖南省新高考联盟2021届高三下学期3月提升检测化学(A)试题安徽省名校2020-2021学年高二下学期5月第二次联考化学试题陕西省西安中学2021-2022学年高三上学期期中考试化学试题福建省龙岩第一中学2021-2022学年高三上学期第三次月考化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)湖南省常德市第一中学 2023届高三7月摸底考试化学试题(已下线)易错点03 离子反应-备战2023年高考化学考试易错题(已下线)学科特色6 离子推断湖南省永州市祁阳县第四中学2023-2024学年高三上学期第三次段考化学试题
名校
3 . 下列实验方案设计、现象和结论中正确的是
| 选项 | 实验方案设计 | 现象和结论 |
| A | 取A、B两支试管,各加入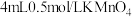 ,然后向A中加入 ,然后向A中加入 ,同时向B中加入 ,同时向B中加入 | A、B中溶液均褪色且B中褪色快,说明其他条件不变时,反应物浓度越大,反应速率越快 |
| B | 将 相同的 相同的 溶液和 溶液和 溶液均稀释10倍 溶液均稀释10倍 |  ,说明 ,说明 酸性弱于 酸性弱于 |
| C | 鉴别 和 和 时,分别取少量固体于两支试管中,加水溶解,再滴加 时,分别取少量固体于两支试管中,加水溶解,再滴加 溶液 溶液 | 产生白色沉淀的试管内为 |
| D | 将乙醇和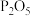 共热产生的气体依次通入足量的 共热产生的气体依次通入足量的 溶液、稀酸性高锰酸钾溶液 溶液、稀酸性高锰酸钾溶液 | 高锰酸钾溶液褪色,证明发生了消去反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-19更新
|
1128次组卷
|
6卷引用:浙江省舟山市舟山中学2021-2022学年高三上学期开学考试化学试题
浙江省舟山市舟山中学2021-2022学年高三上学期开学考试化学试题浙江省宁波“十校”2021-2022学年高三下学期3月份联考化学试题(已下线)卷04 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)2022年浙江省6月高考真题变式题21-25(已下线)2022年浙江1月高考真题变式题(21-25)浙江省舟山市普陀中学2022-2023学年高三上学期9月月考化学试题
4 . 某固体混合物X,含有Al2(SO4)3、FeCl3、Na2CO3和CuSO4中的几种,进行如下实验:
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与NaOH溶液作用,无变化。
下列说法不正确 的是
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与NaOH溶液作用,无变化。
下列说法
| A.混合物X中必定含有Na2CO3,不含Al2(SO4)3 |
| B.溶液Z中溶质主要是钠盐,且必含NaHCO3 |
| C.灼烧沉淀Y,可能得到黑色物质 |
| D.往溶液Z中加入Cu粉,若不溶解,说明X中不含FeCl3 |
您最近一年使用:0次
2021-12-26更新
|
3608次组卷
|
35卷引用:江苏省淮安市车桥中学2022届高三上学期入学调研(A)化学试题
江苏省淮安市车桥中学2022届高三上学期入学调研(A)化学试题(已下线)浙江省2020年1月选考(学考)化学试题2020年浙江省高考化学试卷(1月选考)浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题四川省成都市树德中学2019-2020学年高二下学期期中考试化学试题(已下线)小题必刷05 离子检验与推断——2021年高考化学一轮复习小题必刷(通用版)湖北省宜昌市长阳土家族自治县第一高级中学2020-2021学年高二上学期期中考试化学试题(已下线)小题必刷32 盐类的水解影响因素及应用——2021年高考化学一轮复习小题必刷(通用版本)(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练浙江省杭州市长征中学2020-2021学年高二下学期第二学期阶段性练习化学试题浙江省宁波市北仑中学2020-2021学年高二下学期期中考试化学(1班)试题(已下线)课时08 离子检验与推断-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点04 离子反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点04 离子反应-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第3章 水溶液中的离子反应与平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)专题3.3.2 影响盐类水解的主要因素(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)专题04.离子反应-十年(2012-2021)高考化学真题分项汇编(浙江专用)辽宁省实验中学2022届高三第一次阶段性考试化学试题(已下线)考点03 离子反应-备战2022年高考化学学霸纠错(全国通用)(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)3.3.1 盐溶液的酸碱性及其原因(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)2020年全国卷Ⅱ化学真题变式题西藏拉萨中学2022届高三第七次月考理综化学试题(已下线)考点04 离子反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第25讲 盐类水解(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第28讲 物质的分离、提纯和检验(练)-2023年高考化学一轮复习讲练测(全国通用)浙江省余姚中学2022-2023学年高二上学期期中考试化学试题北京市清华大学附属中学2022-2023学年高二上学期12月月考化学试题(已下线)专题06 离子共存、检验和推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型6 离子定性、定量推断-高考必备50个题型(已下线)考点03 离子共存、离子的检验与推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)黑龙江省齐齐哈尔中学2022-2023学年高三上学期11月期中考试化学试题四川省合江县马街中学校2023-2024学年高二上学期1月期末化学试题
5 . NA为阿伏加 德罗常数的值,下列说法不正确 的是( )
| A.标准状况下,5.6L甲烷和乙烯的混合气体中所含碳氢键数为NA |
| B.足量镁与一定体积的浓硫酸反应,产生气体2.24L(标准状况),则转移的电子数为0.2NA |
| C.含7.8gNa2S的溶液中阴离子总数大于0.1NA |
| D.向100mL1mol•L-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液,则混和液中:N(CO32-)+N(HCO3-)+N(H2CO3)=0.1NA |
您最近一年使用:0次
2020-06-09更新
|
817次组卷
|
5卷引用:模拟卷05(必考+选考)——2020年秋高三化学开学摸底考试卷(全国通用)
模拟卷05(必考+选考)——2020年秋高三化学开学摸底考试卷(全国通用)浙江省温州市2020年4月份普通高中选考适应性测试(二模)化学试题(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(浙江专用)新疆维吾尔自治区和田地区洛浦县2022-2023学年高三上学期11月期中考试化学试题
名校
6 . 等物质的量浓度、等体积的下列溶液中(1)H2CO3 (2)Na2CO3 (3)NaHCO3 (4)NH4HCO3 (5)(NH4)2CO3。下列关系或者说法正确的是( )
| A.c(HCO3-)的大小关系为:(4)>(3)>(5)>(2)>(1) |
| B.c(CO32-)的大小关系为:(1)<(4)<(3)<(5)<(2) |
| C.将溶液蒸干后灼烧后只有(1)不能得到对应的固体物质 |
| D.(2)(3)(4)(5)既能与盐酸反应,又能与NaOH溶液反应 |
您最近一年使用:0次
2019-11-24更新
|
335次组卷
|
12卷引用:2016-2017学年吉林省长春市第十一高中高二上学期期初考试化学试卷
2016-2017学年吉林省长春市第十一高中高二上学期期初考试化学试卷2016届河北省行唐启明中学高三上学期12月月考化学试卷2017届河北省定州中学高三上学期第二次月考化学卷2016-2017学年河北省邢台一中高二上月考二化学卷2016-2017学年山东省桓台二中高二上学期期中化学试卷苏教版高三单元精练检测八化学试题福建省闽侯第六中学2017-2018学年高二12月月考化学试题山东省枣庄市第八中学南校区2017-2018学年高二上学期第二次月考(12月)化学试题河南省鲁山县第一高级中学2019-2020学年高二11月月考化学试题江西省吉安市省重点中学2020-2021学年高二上学期期中联合考试化学试题江西省吉安市2020-2021学年高二上学期期中统考化学试题第3课时 溶液中粒子浓度的大小比较
7 . 羟氨(NH2OH )为一元弱碱(25℃时,电高常数Kb=9.0×10-9),其电离方程式为NH2OH+H2O  NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是
NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是

 NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是
NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是
| A.V1<10 |
| B.A点对应溶液的pH=9.5 |
| C.A 、B、C 、D四点对应的溶液中NH2OH电离常数相等 |
| D.D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH ) |
您最近一年使用:0次
名校
8 . 请你利用所学的化学反应原理解决下列问题:
(1)下列溶液在空气中加热蒸干,并且灼烧之后,所得固体仍为原溶液中的溶质的是__________ 。
A.FeCl3 B.NaClO C.Fe2(SO4)3 D.K2SO3
(2)焙制糕点把NaHCO3作为发酵粉使用,往往添加少量的明矾,就是利用明矾中的Al3+与HCO3-发生双水解,写出离子方程式____________________________
(3)常温下,有0.1mol/L的盐酸,由水电离出的c(H+)=__________ ,该盐酸与0.04mol/L的Ba(OH)2等体积混合,混合后的pH值________
(4)常温下,物质的量浓度均为0.1 mol·L-1的下列溶液:
①Na2CO3溶液 ②NaOH溶液 ③CH3COONa溶液 ④NH4Cl溶液 ⑤NaNO3,溶液的pH由大到小的排列顺序是__________________
(5)实验:①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
A. 写出AgCl沉淀溶解平衡方程式______________________
B. ③中颜色变化说明Ksp(AgCl)____ Ksp(AgI)(填“>”、“<”、“=”)
(1)下列溶液在空气中加热蒸干,并且灼烧之后,所得固体仍为原溶液中的溶质的是
A.FeCl3 B.NaClO C.Fe2(SO4)3 D.K2SO3
(2)焙制糕点把NaHCO3作为发酵粉使用,往往添加少量的明矾,就是利用明矾中的Al3+与HCO3-发生双水解,写出离子方程式
(3)常温下,有0.1mol/L的盐酸,由水电离出的c(H+)=
(4)常温下,物质的量浓度均为0.1 mol·L-1的下列溶液:
①Na2CO3溶液 ②NaOH溶液 ③CH3COONa溶液 ④NH4Cl溶液 ⑤NaNO3,溶液的pH由大到小的排列顺序是
(5)实验:①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
A. 写出AgCl沉淀溶解平衡方程式
B. ③中颜色变化说明Ksp(AgCl)
您最近一年使用:0次
2018-01-03更新
|
573次组卷
|
4卷引用:甘肃省天水市第一中学2017-2018学年高二下学期入学考试化学试题
名校
9 . 下列物质的水溶液经加热浓缩、蒸干灼烧仍能得到原物质的是
| A.Ca(HCO3)2 | B.Na2SO3 | C.AlCl3 | D.NaAlO2 |
您最近一年使用:0次
2017-11-07更新
|
272次组卷
|
2卷引用:四川省成都市七中实验学校2018届高三上学期入学考试化学试题
名校
解题方法
10 . 如图是工业制取菱镁矿MgCO3(含杂质Al2O3、FeCO3)制取镁的工艺流程
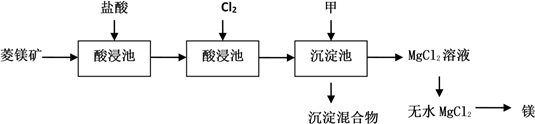
请回答有关问题:
(1)菱镁矿进入酸浸池前需要粉碎,目的是___________ 。
(2)氧化池通入Cl2的目的是氧化___________ (填化学式),工业上不选用硝酸做氧化剂的原因是___________ 和___________ 。
(3)物质甲可以是___________
A、MgO B、Mg(OH)2 C、NaOH溶液 D、稀氨水
(4)由MgCl2溶液制取无水MgCl2的操作方法___________ 。
(5)当Fe3+完全沉淀时,求最小pH___________ 。已知:氢氧化铁ksp=1.0×10-38,离子浓度小于1×10-5 mol/L认为沉淀完全

请回答有关问题:
(1)菱镁矿进入酸浸池前需要粉碎,目的是
(2)氧化池通入Cl2的目的是氧化
(3)物质甲可以是
A、MgO B、Mg(OH)2 C、NaOH溶液 D、稀氨水
(4)由MgCl2溶液制取无水MgCl2的操作方法
(5)当Fe3+完全沉淀时,求最小pH
您最近一年使用:0次
2017-09-01更新
|
373次组卷
|
3卷引用:黑龙江省大庆实验中学2018届高三上学期期初考试化学试题



