解题方法
1 . 贵金属银有广泛用途。工业上用银锰精矿(主要含 、MnS、
、MnS、 等)制备银,同时获得二氧化锰的流程如下。
等)制备银,同时获得二氧化锰的流程如下。
(1)“浸锰”步骤中产生的浸锰液主要含有 ,生成气体的主要成分为
,生成气体的主要成分为_______ ;用惰性电极电解浸锰液制 ,写出电解总反应的化学方程式
,写出电解总反应的化学方程式_______ 。
(2)已知“浸铁”步骤中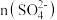 保持不变,反应中n(氧化剂):n(还原剂)=
保持不变,反应中n(氧化剂):n(还原剂)=_______ ;浸铁滤饼的主要成分为S和_______ 。
(3)“浸银”时发生反应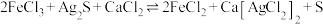 ,其中
,其中 在溶液中是一种稳定配合物。加入
在溶液中是一种稳定配合物。加入 的作用是
的作用是_______ ;结合离子方程式,从平衡角度分析选用氯化物浓溶液的原因是_______ 。
(4)“沉银”步骤中,生成单质银的离子反应方程式为_______ ,沉银液经处理可再利用,方法是向沉银液中通入_______ (写化学式),通过一步转化后循环再用。
 、MnS、
、MnS、 等)制备银,同时获得二氧化锰的流程如下。
等)制备银,同时获得二氧化锰的流程如下。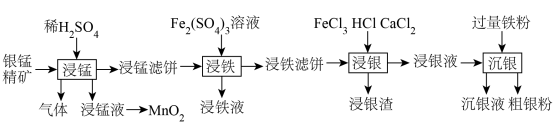
(1)“浸锰”步骤中产生的浸锰液主要含有
 ,生成气体的主要成分为
,生成气体的主要成分为 ,写出电解总反应的化学方程式
,写出电解总反应的化学方程式(2)已知“浸铁”步骤中
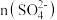 保持不变,反应中n(氧化剂):n(还原剂)=
保持不变,反应中n(氧化剂):n(还原剂)=(3)“浸银”时发生反应
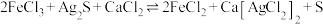 ,其中
,其中 在溶液中是一种稳定配合物。加入
在溶液中是一种稳定配合物。加入 的作用是
的作用是(4)“沉银”步骤中,生成单质银的离子反应方程式为
您最近一年使用:0次
名校
2 . 镍常作催化剂。以镍废料(主要成分为Ni,含 、NiO、FeO、CaO和
、NiO、FeO、CaO和 )为原料制备纯镍的流程如图所示:
)为原料制备纯镍的流程如图所示:
(1)“酸浸”得到滤渣1的主要成分是 和
和__________ (填化学式)。“酸浸”中镍浸出率与硫酸浓度的关系如图所示。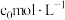 时,镍浸出率降低的可能原因是
时,镍浸出率降低的可能原因是_____________________ (答一条)。
(2)“氧化”中双氧水的作用是______________________ (用离子方程式表示)。
(3)“沉铝”中NiO的作用是________________________________________ 。
(4) 在隔绝空气条件下的热失重曲线如图所示。
在隔绝空气条件下的热失重曲线如图所示。________________________ ,c点对应的氧化物为____________ (填化学式)。
(5)Ni和Nb可组成一种合金材料,其晶胞结构如图所示。 代表阿伏加德罗常数的值,
代表阿伏加德罗常数的值,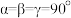 ,该晶胞中Ni、Nb的个数之比为
,该晶胞中Ni、Nb的个数之比为_____________ 。该晶体的密度为_________  (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
 、NiO、FeO、CaO和
、NiO、FeO、CaO和 )为原料制备纯镍的流程如图所示:
)为原料制备纯镍的流程如图所示: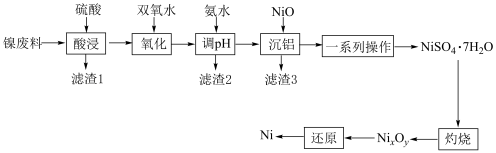
(1)“酸浸”得到滤渣1的主要成分是
 和
和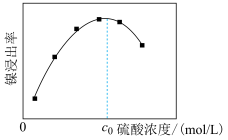
 时,镍浸出率降低的可能原因是
时,镍浸出率降低的可能原因是(2)“氧化”中双氧水的作用是
(3)“沉铝”中NiO的作用是
(4)
 在隔绝空气条件下的热失重曲线如图所示。
在隔绝空气条件下的热失重曲线如图所示。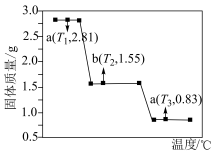
(5)Ni和Nb可组成一种合金材料,其晶胞结构如图所示。
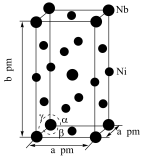
 代表阿伏加德罗常数的值,
代表阿伏加德罗常数的值,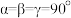 ,该晶胞中Ni、Nb的个数之比为
,该晶胞中Ni、Nb的个数之比为 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
3 . 某化学实验小组设计如下实验探究Zn与溶液中Fe3+发生反应的原理。
下列说法错误的是
| 实验 | 试剂 | 现象 |
| I | 2 mL0.1 mol· L-1FeCl3溶液、过量锌粉 | 黄色溶液很快变浅,接着有无色气泡产生,固体中未检出铁单质 |
| Ⅱ | 2 mL1 mol· L-1FeCl3溶液(pH≈0.70)、过量锌粉 | 很快有大量气体产生,出现红褐色浑浊,30 min左右产生红褐色沉淀,溶液颜色变浅,产生少量铁单质 |
| A.实验I说明Fe3+被还原为Fe2+ |
| B.可用酸性高锰酸钾溶液检验实验I得到的溶液中含有Fe2+ |
| C.实验Ⅱ发生了置换反应和复分解反应 |
| D.实验说明Fe3+、H+与Zn的反应与离子浓度有关 |
您最近一年使用:0次
2023-05-23更新
|
1502次组卷
|
11卷引用:第6讲 铁及其重要化合物
(已下线)第6讲 铁及其重要化合物(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题06 元素及其化合物 -2023年高考化学真题题源解密(新高考专用)(已下线)选择题6-10(已下线)热点19 化学微型实验河南省安阳市2023届高三下学期第三次模拟考试理科综合化学试题(已下线)【知识图鉴】单元讲练测必修第一册第三单元02基础练辽宁省沈阳市第一二〇中学2023-2024学年高三上学期第一次质量检测化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五高级中学(前郭五中)2023-2024学年高三上学期第三次考试 化学试卷 (已下线)2023-2024学年度第二学期高三化学零模试卷北京市师范大学附属实验中学2024届高三零模化学试题
名校
解题方法
4 . 下列离子能大量存在于指定溶液中的是
A.某中性溶液中: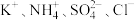 |
B.能使Al粉转化为 的溶液: 的溶液: |
C.能使pH试纸变深蓝色的溶液: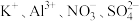 |
D.遇KSCN显红色的溶液: |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
5 . 分别测浓度均为 的
的 和
和 溶液的
溶液的 ,后者大于前者,可知
,后者大于前者,可知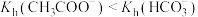 。( )
。( )
 的
的 和
和 溶液的
溶液的 ,后者大于前者,可知
,后者大于前者,可知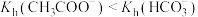 。( )
。( )
您最近一年使用:0次
名校
6 . 常温下, 的溶液A中含有
的溶液A中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的四种,且溶液中各离子的浓度均为0.1
中的四种,且溶液中各离子的浓度均为0.1 。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
 的溶液A中含有
的溶液A中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的四种,且溶液中各离子的浓度均为0.1
中的四种,且溶液中各离子的浓度均为0.1 。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是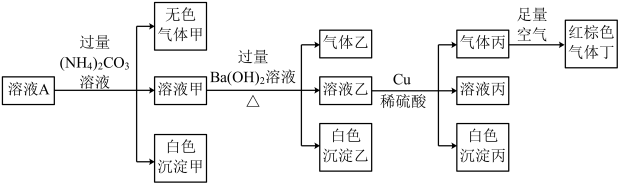
A.溶液A中一定含有 、 、 、 、 、 、 |
B.若实验消耗 14.4g,则生成气体丁的体积为3.36L 14.4g,则生成气体丁的体积为3.36L |
C.沉淀乙中一定有 ,可能有 ,可能有 |
D.溶液A中一定没有 ,但是无法确定是否含有 ,但是无法确定是否含有 |
您最近一年使用:0次
2023-02-08更新
|
241次组卷
|
17卷引用:黄金30题系列 高三化学 小题易丢分
(已下线)黄金30题系列 高三化学 小题易丢分(已下线)易错点03 离子反应-备战2023年高考化学考试易错题(已下线)学科特色6 离子推断河南省豫南豫北名校2018届高三精英联赛化学试题1江西省莲塘一中、临川二中2018届高三上学期第一次联考化学试题陕西省陕师大附中2018届高三第五次月考化学试题河南省南阳市第一中学校2018届高三第七次考试理综化学试题河北省定州中学2018届高三(承智班)下学期开学考试化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2西藏自治区拉萨中学2018届高三第六次月考理综化学试题湖南省新高考联盟2021届高三下学期3月提升检测化学(A)试题安徽省名校2020-2021学年高二下学期5月第二次联考化学试题陕西省西安中学2021-2022学年高三上学期期中考试化学试题福建省龙岩第一中学2021-2022学年高三上学期第三次月考化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)湖南省常德市第一中学 2023届高三7月摸底考试化学试题湖南省永州市祁阳县第四中学2023-2024学年高三上学期第三次段考化学试题
名校
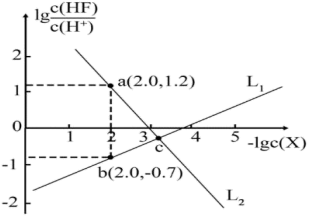
7 . 已知 是难溶于水、可溶于酸的盐。常温下,用盐酸调节
是难溶于水、可溶于酸的盐。常温下,用盐酸调节 浊液的pH,测得在不同pH条件下,体系中
浊液的pH,测得在不同pH条件下,体系中 与
与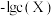 (X为
(X为 或
或 )的关系如图所示。下列说法错误的是
)的关系如图所示。下列说法错误的是
 是难溶于水、可溶于酸的盐。常温下,用盐酸调节
是难溶于水、可溶于酸的盐。常温下,用盐酸调节 浊液的pH,测得在不同pH条件下,体系中
浊液的pH,测得在不同pH条件下,体系中 与
与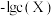 (X为
(X为 或
或 )的关系如图所示。下列说法错误的是
)的关系如图所示。下列说法错误的是
A. 表示 表示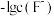 与 与 的变化曲线 的变化曲线 |
B.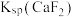 的数量级为 的数量级为 |
C.a、b两点的溶液中均存在: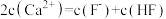 |
D.c点的溶液中: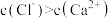 |
您最近一年使用:0次
2023高三·全国·专题练习
8 . 叠氮酸(HN3)与NaOH溶液反应生成NaN3。已知NaN3溶液呈碱性,下列叙述正确的是
A.0.01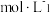 HN3溶液的pH=2 HN3溶液的pH=2 |
| B.HN3溶液的pH随温度升高而减小 |
| C.NaN3的电离方程式:NaN3=Na++3N- |
D.0.01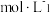 NaN3溶液中:c(H+)+c(Na+)=c( NaN3溶液中:c(H+)+c(Na+)=c( )+c(HN3) )+c(HN3) |
您最近一年使用:0次
名校
解题方法
9 . 常温下,用 盐酸滴定25.00mL
盐酸滴定25.00mL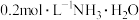 溶液,所得溶液pH、
溶液,所得溶液pH、 和
和 的物质的量分数与滴加盐酸体积的关系如图所示。下列说法不正确的是
的物质的量分数与滴加盐酸体积的关系如图所示。下列说法不正确的是

 盐酸滴定25.00mL
盐酸滴定25.00mL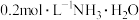 溶液,所得溶液pH、
溶液,所得溶液pH、 和
和 的物质的量分数与滴加盐酸体积的关系如图所示。下列说法不正确的是
的物质的量分数与滴加盐酸体积的关系如图所示。下列说法不正确的是
A.曲线①代表 ,曲线②代表 ,曲线②代表 |
| B.当溶液显中性时,滴入盐酸的体积小于25mL |
C. 的电离常数的数量级为 的电离常数的数量级为 |
D.a点溶液中存在 |
您最近一年使用:0次
2022-11-05更新
|
1120次组卷
|
5卷引用:模拟卷03-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)
(已下线)模拟卷03-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试平行卷河南省南阳市2022-2023学年高三上学期期中质量评估化学试题河南省南阳市2022-2023学年高三上学期11月期中考试化学试题宁夏六盘山高级中学2023-2024学年高三一模考试化学试题
10 . 元素化合物在化工生产和环境科学中有着重要的用途。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为____ 、____ 、____ 。
(2)自然界中Cr主要以+3价和+6价形式存在。 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:____ 。
(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:____ 。
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化Br-,也能氧化Fe2+。
①取10mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+____ Br- (填“>”或“<”)。
②若在400mL0.1mol/LFeBr2溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈____ 色,写出该反应的离子方程式____ 。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为
(2)自然界中Cr主要以+3价和+6价形式存在。
 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化Br-,也能氧化Fe2+。
①取10mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+
②若在400mL0.1mol/LFeBr2溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈
您最近一年使用:0次



