1 . 已知:AgX(X=Cl、Br)溶液中,p(Ag+)=-1gc(Ag+),p(X-)=-lgc(X-)。t℃时,p(X-)与p(Ag+)的相互关系如图。下列说法不正确的是
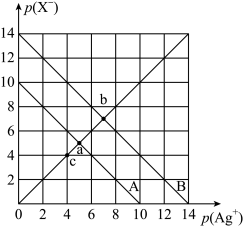

| A.A线表示的是AgBr |
| B.t℃时,c点浓度溶液中会有AgCl固体析出 |
| C.取a、b两点处溶液等体积混合,向溶液中加入足量浓硝酸银溶液,生成的沉淀n(AgBr)>n(AgCl) |
D.t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K=104 AgBr(s)+Cl-(aq)的平衡常数K=104 |
您最近一年使用:0次
解题方法
2 . 已知常温下,AgBr的Ksp=4.9×10﹣13 mol2•L﹣2、AgI的Ksp=8.3×10﹣17mol2•L﹣2。
(1)现向含有AgI的饱和溶液中:
①加入AgNO3固体,则c(I﹣)_______ (填“变大”“变小”或“不变”,下同)。
②若改加更多的AgI固体,则c(Ag+)_______ 。
③若改加AgBr固体,则c(I﹣)_______ ,c(Ag+)_______ 。
(2)现向含有NaBr、KI均为0.002mol•L﹣1的溶液中加入等体积、浓度为4×10﹣3mol•L﹣1的AgNO3溶液,则产生的沉淀是_______ (填化学式);若向其中再加入适量的NaI固体,则可发生沉淀转化的总反应的离子方程式为_______ 。
(1)现向含有AgI的饱和溶液中:
①加入AgNO3固体,则c(I﹣)
②若改加更多的AgI固体,则c(Ag+)
③若改加AgBr固体,则c(I﹣)
(2)现向含有NaBr、KI均为0.002mol•L﹣1的溶液中加入等体积、浓度为4×10﹣3mol•L﹣1的AgNO3溶液,则产生的沉淀是
您最近一年使用:0次
3 . NaNbO3是一种很好的压电和介电材料,一种以铌铁矿(主要成分为SiO2、Nb2O3、MnO2和少量的FeO、CaO、MgO)为原料的制取工艺流程如下:
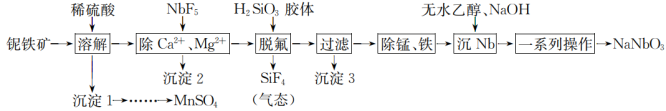
回答下列问题:
(1)为了加速“溶解”,可采取的措施有_______ (写出两种)该过程中MnO2与FeO反应生成MnSO4和Fe2(SO4)3的离子方程式为_______ 。
(2)“除Ca2+、Mg2+时,若溶液酸度过高,沉淀不完全,其原因是_______ ;当溶液中c(Ca2+)= 1×10-6mol·L-1时,溶液中c(Mg2+ )的最大值为_______ mol·L-1 (已知Ksp(CaF2)=2.5×10-11,Ksp(MgF2)= 6.4×10-9)
(3)“脱氟”过程发生反应的化学方程式为_______ 。
(4)“一系列操作”包括过滤、洗涤、干燥,其中证明NaNbO3洗涤干净的操作是_______ 。
(5)电解MnSO4溶液可制备Mn和MnO2,阳极电极反应式为_______ 。

回答下列问题:
(1)为了加速“溶解”,可采取的措施有
(2)“除Ca2+、Mg2+时,若溶液酸度过高,沉淀不完全,其原因是
(3)“脱氟”过程发生反应的化学方程式为
(4)“一系列操作”包括过滤、洗涤、干燥,其中证明NaNbO3洗涤干净的操作是
(5)电解MnSO4溶液可制备Mn和MnO2,阳极电极反应式为
您最近一年使用:0次
名校
4 . 将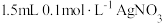 溶液和
溶液和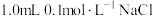 溶液混合,得到浊液a,过滤得到滤液b和白色沉淀c。已知:
溶液混合,得到浊液a,过滤得到滤液b和白色沉淀c。已知: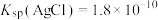 ,
, 。下列分析错误的是
。下列分析错误的是
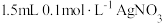 溶液和
溶液和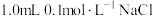 溶液混合,得到浊液a,过滤得到滤液b和白色沉淀c。已知:
溶液混合,得到浊液a,过滤得到滤液b和白色沉淀c。已知: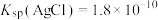 ,
, 。下列分析错误的是
。下列分析错误的是A.浊液a中存在沉淀溶解平衡: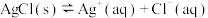 |
B.滤液b中不含 |
C.向滤液b中滴加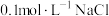 溶液,会出现白色沉淀 溶液,会出现白色沉淀 |
D.向沉淀c中滴加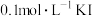 溶液,沉淀变为黄色 溶液,沉淀变为黄色 |
您最近一年使用:0次
2022-08-18更新
|
150次组卷
|
2卷引用:河北省武强中学2021-2022学年高二上学期12月联考化学试题
名校
5 . 下列用途或转化,不能用沉淀溶解平衡原理解释的是
A. 溶液可使PbS转化为CuS 溶液可使PbS转化为CuS |
B.向 饱和溶液中加入少量纯碱,有白色沉淀生成 饱和溶液中加入少量纯碱,有白色沉淀生成 |
C.Fe可除去 溶液中的 溶液中的 杂质 杂质 |
D.向 悬浊液中加入稀盐酸后,悬浊液变澄清 悬浊液中加入稀盐酸后,悬浊液变澄清 |
您最近一年使用:0次
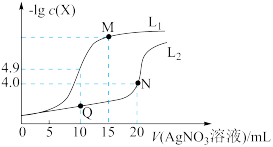
6 . t℃时,将0.1 mol·L-1AgNO3溶液分别滴加到10. 00 mL0.1 mol·L-1KCl、10.00 ml0.1 mol· L-1K2CrO4溶液中,AgNO3溶液体积(V)与-lg c(X)(X为Cl-或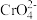 )的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
)的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
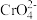 )的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
)的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
| A.曲线L2表示-lg c(Cl-)与V(AgNO3溶液)的变化关系 |
| B.t℃时,铬酸银的溶度积常数为4.0 ×10-12 |
| C.若仅将c(K2CrO4)改为0.05 mol·L-1,则曲线L2中N点移到Q点 |
D.M点溶液中:c( )>c(K+ )>c(Ag+ )>c(OH- )>c(H+ ) )>c(K+ )>c(Ag+ )>c(OH- )>c(H+ ) |
您最近一年使用:0次
2022-08-10更新
|
147次组卷
|
2卷引用:山西省怀仁市第一中学2021-2022学年高二上学期期中理科综合化学试题
名校
7 . 烟气中的 会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:
会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:
方法1(双碱法):用NaOH吸收 ,并用CaO使NaOH再生,即NaOH溶液
,并用CaO使NaOH再生,即NaOH溶液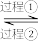
 溶液。
溶液。
(1)过程①的离子方程式为_______ 。
(2)常温下,用NaOH溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡_______ (填“向左”“向右”或“不”)移动。该溶液中由水电离出的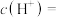
_______  ;
; 溶液显
溶液显_______ (填“酸”、“碱”或“中”)性。(常温下 的电离平衡常数
的电离平衡常数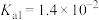 ,
,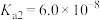 )
)
(3)CaO在水中存在如下转化: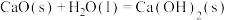 ,
,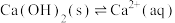
 ,从化学反应原理的角度解释过程②NaOH再生的原理:
,从化学反应原理的角度解释过程②NaOH再生的原理:_______ 。
(4)理论上,该工艺中NaOH只作为启动碱,实际主要消耗的是生石灰。实际吸收过程中,由于存在一定氧气,会发生副反应:_______ (填化学方程式),因副产物_______ (填化学式)在工艺中较难循环再生成NaOH,需要不断向系统中补充NaOH。
方法2:用氨水除去。
(5)已知常温时 的
的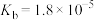 ,若氨水的浓度为
,若氨水的浓度为 ,溶液中
,溶液中
_______  。将
。将 通入该氨水中,当溶液恰好呈中性时,溶液中
通入该氨水中,当溶液恰好呈中性时,溶液中
_______ 。
 会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:
会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:方法1(双碱法):用NaOH吸收
 ,并用CaO使NaOH再生,即NaOH溶液
,并用CaO使NaOH再生,即NaOH溶液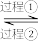
 溶液。
溶液。(1)过程①的离子方程式为
(2)常温下,用NaOH溶液吸收
 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡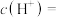
 ;
; 溶液显
溶液显 的电离平衡常数
的电离平衡常数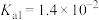 ,
,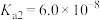 )
)(3)CaO在水中存在如下转化:
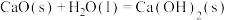 ,
,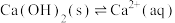
 ,从化学反应原理的角度解释过程②NaOH再生的原理:
,从化学反应原理的角度解释过程②NaOH再生的原理:(4)理论上,该工艺中NaOH只作为启动碱,实际主要消耗的是生石灰。实际吸收过程中,由于存在一定氧气,会发生副反应:
方法2:用氨水除去。
(5)已知常温时
 的
的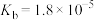 ,若氨水的浓度为
,若氨水的浓度为 ,溶液中
,溶液中
 。将
。将 通入该氨水中,当溶液恰好呈中性时,溶液中
通入该氨水中,当溶液恰好呈中性时,溶液中
您最近一年使用:0次
名校
8 . 已知p(A)=-lgc平(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
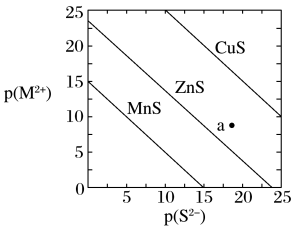

| A.a点有ZnS沉淀生成 |
| B.可用MnS除去MnCl2溶液中混有的少量ZnCl2 |
| C.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c平(S2-)不变 |
D.CuS和MnS共存的悬浊液中,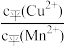 =10-20 =10-20 |
您最近一年使用:0次
2022-01-05更新
|
75次组卷
|
2卷引用:河北省张家口市第一中学2021-2022学年高二上学期12月月考化学试题
解题方法
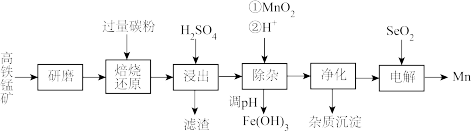
9 . 在钢铁工业中,主要用锰脱硫和脱氧:锰也是作为合金的添加料。一种以高铁锰矿(含 、
、 及少量
及少量 、
、 、
、 、
、 )为原料生产金属锰的工艺流程如图。
)为原料生产金属锰的工艺流程如图。
已知:常温下, 的
的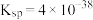 ;
; ;溶液中某离子浓度小于
;溶液中某离子浓度小于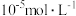 认为该离子沉淀完全。
认为该离子沉淀完全。
回答下列问题:
(1)研磨的目的是_______ 。
(2)“焙烧还原”时,原料中高铁锰矿中 被还原为
被还原为 ,还有能被还原的成分为
,还有能被还原的成分为_______ 、_______ 。(填化学式)
(3)下表数据是焙烧后 元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为
元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为_______  。
。
(4)“浸出”产生两种“滤渣”的成分为_______ 、_______ (填化学式):该步骤中,工业上往往需再加入少量固体 以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因
以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因_______ 。
(5)常温下,“除杂”时 参加的反应的离子方程式为
参加的反应的离子方程式为_______ ;再逐步调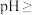
_______ 至 完全沉淀。
完全沉淀。
(6)研究表明,加入适量的 有利于
有利于 在电极上析出,电解过程中
在电极上析出,电解过程中 与水反应生成的
与水反应生成的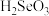 (二元弱酸)在阴极放电生成
(二元弱酸)在阴极放电生成 单质,该电极反应式为
单质,该电极反应式为_______ 。
 、
、 及少量
及少量 、
、 、
、 、
、 )为原料生产金属锰的工艺流程如图。
)为原料生产金属锰的工艺流程如图。
已知:常温下,
 的
的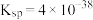 ;
; ;溶液中某离子浓度小于
;溶液中某离子浓度小于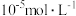 认为该离子沉淀完全。
认为该离子沉淀完全。回答下列问题:
(1)研磨的目的是
(2)“焙烧还原”时,原料中高铁锰矿中
 被还原为
被还原为 ,还有能被还原的成分为
,还有能被还原的成分为(3)下表数据是焙烧后
 元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为
元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为 。
。还原温度/ | 焙烧后 元素在主要含锰物质中的分布/% 元素在主要含锰物质中的分布/% | ||
 | 高价锰( ) ) | 低价锰( ) ) | |
| 600 800 1000 1100 1200 | 40.92 10.56 6.01 痕量 痕量 | 34.76 6.63 2.70 0.46 0.30 | 24.32 82.81 91.29 98.76 97.94 |
 以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因
以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因(5)常温下,“除杂”时
 参加的反应的离子方程式为
参加的反应的离子方程式为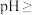
 完全沉淀。
完全沉淀。(6)研究表明,加入适量的
 有利于
有利于 在电极上析出,电解过程中
在电极上析出,电解过程中 与水反应生成的
与水反应生成的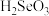 (二元弱酸)在阴极放电生成
(二元弱酸)在阴极放电生成 单质,该电极反应式为
单质,该电极反应式为
您最近一年使用:0次
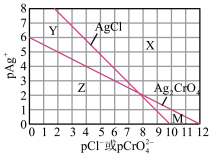
10 . 为研究用 溶液将混合溶液中的
溶液将混合溶液中的 和
和 沉淀分离,绘制了25℃时AgCl和
沉淀分离,绘制了25℃时AgCl和 两种难溶化合物的溶解平衡曲线。其中,
两种难溶化合物的溶解平衡曲线。其中, ,其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法中不正确的是
,其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法中不正确的是
 溶液将混合溶液中的
溶液将混合溶液中的 和
和 沉淀分离,绘制了25℃时AgCl和
沉淀分离,绘制了25℃时AgCl和 两种难溶化合物的溶解平衡曲线。其中,
两种难溶化合物的溶解平衡曲线。其中, ,其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法中不正确的是
,其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法中不正确的是
A.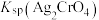 约为 约为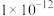 , ,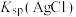 的数量级为 的数量级为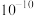 |
B.M区域内可析出 沉淀,而不析出AgCl沉淀 沉淀,而不析出AgCl沉淀 |
C.向 、 、 均为0.1mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀 均为0.1mol/L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀 |
D.向 、AgCl混合固体和水的溶解平衡体系中加少量水, 、AgCl混合固体和水的溶解平衡体系中加少量水, 增大 增大 |
您最近一年使用:0次
2023-01-13更新
|
504次组卷
|
11卷引用:第26讲 难溶电解质的溶解平衡(精练)-2022年高考化学一轮复习讲练测
(已下线)第26讲 难溶电解质的溶解平衡(精练)-2022年高考化学一轮复习讲练测云南省昆明市第一中学2019-2020高三第三次双基检测化学试题2020届高三《新题速递·化学》12月第02期(考点07-11)2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡的曲线分析【精编25题】广东省韶关市2020届高三下学期线上教学摸底自测化学试题山西省临汾市2020届高考考前适应性训练考试(一)理综化学试题黑龙江省大庆铁人、鸡西一中、鹤岗一中三校2021届高三上学期联考化学试题广东省深圳市福田区福田中学2022-2023学年高三上学期第三次考试化学试题浙江省余姚中学2022-2023学年高二下学期期中考试 化学试题(已下线)第6讲 沉淀溶解平衡图像分析黑龙江省大庆市大庆中学2022-2023学年高三第二次模拟考试化学试题



