名校
解题方法
1 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。
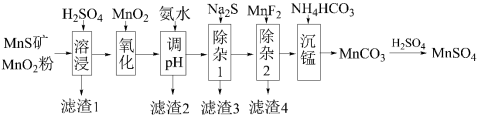
已知:①“滤渣1”含有S和 ;
;
②相关金属离子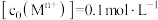 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)“氧化”中添加适量的 的作用是
的作用是________ 。
(2)“调pH”的目的是除铁和铝,则溶液的pH范围应调节为________ ~6之间。
(3)“除杂1”的目的是除去 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是________ 。
(4)“除杂2”的目的是生成 时沉淀除去
时沉淀除去 。该步骤维持溶液pH恒为4.0,若1 L溶液中
。该步骤维持溶液pH恒为4.0,若1 L溶液中 的初始浓度为0.1 mol/L,现欲将
的初始浓度为0.1 mol/L,现欲将 沉淀完全(即剩余离子浓度小于
沉淀完全(即剩余离子浓度小于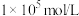 时),则需要加入的
时),则需要加入的 固体至少达到
固体至少达到________ mol( 为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高,
为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是________ 。(已知: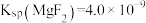 ;
; )
)
(5)写出“沉猛”的离子方程式:________ 。
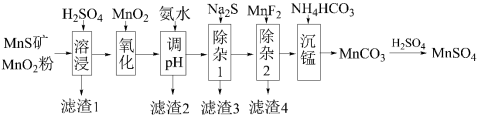
已知:①“滤渣1”含有S和
 ;
;②相关金属离子
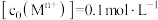 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“氧化”中添加适量的
 的作用是
的作用是(2)“调pH”的目的是除铁和铝,则溶液的pH范围应调节为
(3)“除杂1”的目的是除去
 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是(4)“除杂2”的目的是生成
 时沉淀除去
时沉淀除去 。该步骤维持溶液pH恒为4.0,若1 L溶液中
。该步骤维持溶液pH恒为4.0,若1 L溶液中 的初始浓度为0.1 mol/L,现欲将
的初始浓度为0.1 mol/L,现欲将 沉淀完全(即剩余离子浓度小于
沉淀完全(即剩余离子浓度小于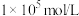 时),则需要加入的
时),则需要加入的 固体至少达到
固体至少达到 为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高,
为易溶的强电解质,忽略加入固体时溶液体积改变)。若溶液中酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是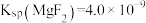 ;
; )
)(5)写出“沉猛”的离子方程式:
您最近一年使用:0次
2022-03-08更新
|
184次组卷
|
2卷引用:河南省范县第一中学等学校2021-2022学年高二上学期联考检测化学试题
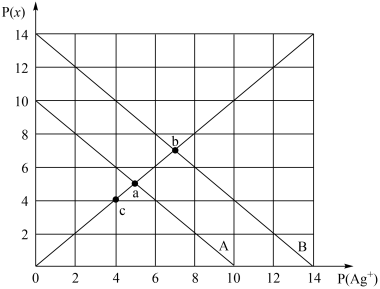
2 .  时,AgX(X=Cl、Br)的溶度积与
时,AgX(X=Cl、Br)的溶度积与 和
和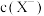 的相互关系如图所示,已知
的相互关系如图所示,已知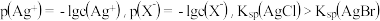 。下列说法不正确的是
。下列说法不正确的是
 时,AgX(X=Cl、Br)的溶度积与
时,AgX(X=Cl、Br)的溶度积与 和
和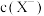 的相互关系如图所示,已知
的相互关系如图所示,已知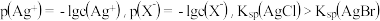 。下列说法不正确的是
。下列说法不正确的是
A. 点可表示 点可表示 的过饱和溶液,在此条件下会生成 的过饱和溶液,在此条件下会生成 沉淀 沉淀 |
B.反应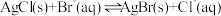 的平衡常数 的平衡常数 |
C.取 点的 点的 溶液和 溶液和 点 点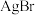 溶液等体积混合,会析出 溶液等体积混合,会析出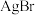 沉淀 沉淀 |
D. 点的 点的 溶液加入 溶液加入 晶体可以移到 晶体可以移到 点 点 |
您最近一年使用:0次
2022-03-04更新
|
87次组卷
|
2卷引用:湖北省石首市第一中学2021-2022学年高二上学期12月月考化学试题
名校
3 . 在25℃时,碳酸钙在水中的溶解平衡曲线如图所示,已知25℃硫酸钙的Ksp=9.1×10-6。下列说法错误的是
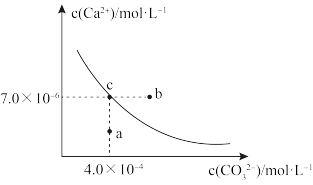

| A.通过蒸发,可使溶液由a点变化到c点 |
| B.图中b点碳酸钙的结晶速率大于其溶解速率 |
| C.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除 |
D.在25℃时,反应CaSO4(s)+CO (aq)=CaCO3(s)+SO (aq)=CaCO3(s)+SO (aq)的平衡常数K=3250 (aq)的平衡常数K=3250 |
您最近一年使用:0次
4 . 铬酸银(Ag2CrO4)微溶于水。常用作分析试剂,有机合成催化剂,电镀, 卤化物滴定确定终点的指示剂等。在 t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp = 1.8×10−10。下列说法不正确的是
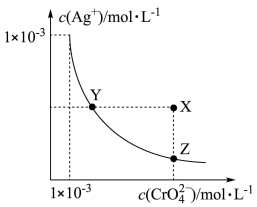

| A.t ℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 |
| C.t ℃时,Ag2CrO4的Ksp为 1×10−9 |
D.t ℃时,将 0.01 mol·L−1AgNO3溶液滴入20 mL0.01mol·L−1KCl和 0.01 mol·L−1K2CrO4的混合溶液中,CrO 先沉淀 先沉淀 |
您最近一年使用:0次
名校
解题方法
5 . 铬酸银(Ag2CrO4)微溶于水,常用作分析试剂、有机合成催化剂、电镀、卤化物滴定终点指示剂等。在T℃时,Ag2CrO4在水溶液中的沉淀溶解平衡曲线如图所示。已知:T℃时,AgCl的Ksp=1.8×10-10。下列说法错误的是
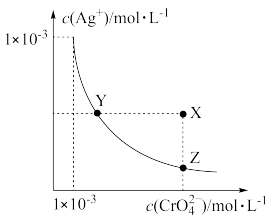

| A.T℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| B.向T℃饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 |
| C.T℃时,Ag2CrO4的Ksp为1×10-6 |
| D.T℃时,将0.01molAgNO3溶液滴入20mL0.01mol·L-1KCl和0.01mol·L-1K2CrO4的混合溶液中,Cl-先沉淀 |
您最近一年使用:0次
2022-02-19更新
|
111次组卷
|
4卷引用:选择性必修1(SJ)专题3专题培优专练
解题方法
6 . 下列实验操作能达到实验目的的是
| 选项 | 操作 | 目的 |
| A | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取NaClO溶液滴于试纸的中部,与标准比色卡对比 | 测定NaClO溶液的pH |
| B | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液颜色的变化 | 证明Na2CO3溶液中存在水解平衡 |
| C | 在含等物质的量浓度Na2CO3、Na2SO4的混合溶液中,滴加少量BaCl2溶液 | 探究Ksp(BaCO3)和Ksp(BaSO4)的相对大小 |
| D | 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 | 检验Fe(NO3)2样品是否变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 常温下,在含有大量Cu(OH)2(s)的浊液中,改变条件发生相应变化的趋向错误 的是
A.通入少量HCl | B.加少量蒸馏水 |
C.加少量NaOH(s) 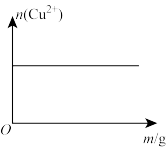 | D.适当升高温度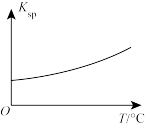 |
您最近一年使用:0次
2022-02-16更新
|
127次组卷
|
4卷引用:河南省范县第一中学2021-2022学年高二上学期第三次月考检测化学试题
河南省范县第一中学2021-2022学年高二上学期第三次月考检测化学试题(已下线)卷07 化学反应速率与化学平衡-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)新疆岳普湖县2021-2022学年高二下学期第一次学情调研测试化学试题内蒙古乌兰浩特市第四中学2022-2023学年高二上学期第三次月考化学试题
2021高二·全国·专题练习
解题方法
8 . 向含有AgI固体的饱和溶液中:
(1)加入固体AgNO3,则c(I-)___________ (填“变大”、“变小”或“不变”,下同)。
(2)若改加更多的AgI,则c(Ag+)将___________ 。
(3)若改加AgBr固体,则c(I-)___________ ,而c(Ag+)___________ 。
(1)加入固体AgNO3,则c(I-)
(2)若改加更多的AgI,则c(Ag+)将
(3)若改加AgBr固体,则c(I-)
您最近一年使用:0次
2021高二·全国·专题练习
9 . 回答下列问题
(1)18 ℃时,Mg(OH)2的Ksp=1.8×10-11,其饱和溶液中Mg2+的物质的量浓度是___________ 。
(2)已知在Ca3(PO4)2的饱和溶液中存在平衡:Ca3(PO4)2(s) 3Ca2+(aq)+2PO
3Ca2+(aq)+2PO (aq),若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol·L-1,c(PO
(aq),若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol·L-1,c(PO )=1.58×10-6 mol·L-1,则Ksp=
)=1.58×10-6 mol·L-1,则Ksp=___________ 。
(1)18 ℃时,Mg(OH)2的Ksp=1.8×10-11,其饱和溶液中Mg2+的物质的量浓度是
(2)已知在Ca3(PO4)2的饱和溶液中存在平衡:Ca3(PO4)2(s)
 3Ca2+(aq)+2PO
3Ca2+(aq)+2PO (aq),若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol·L-1,c(PO
(aq),若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol·L-1,c(PO )=1.58×10-6 mol·L-1,则Ksp=
)=1.58×10-6 mol·L-1,则Ksp=
您最近一年使用:0次
2021高二·全国·专题练习
解题方法
10 . 痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下;
①HUr(尿酸,aq)⇌Ur-(尿酸根,aq)+H+(aq)(37 ℃时,Ka=4.0×10-6)
②NaUr(s) ⇌Ur-(aq)+Na+(aq)
(1)37 ℃时,1.0 L水中最多可溶解8.0×10-3 mol尿酸钠,此温度下尿酸钠的Ksp为_______ 。
(2)关节炎发作多在脚趾和手指的关节处,这说明温度降低时,尿酸钠的Ksp_______ (填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是_______ (填“放热”或“吸热”)反应。
(3)37 ℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3 mol·L-1,其中尿酸分子的浓度为5.0×10-4 mol·L-1,该病人尿液的c(H+)为_______ ,pH_______ 7(填“>”、“<”或“=”)。
①HUr(尿酸,aq)⇌Ur-(尿酸根,aq)+H+(aq)(37 ℃时,Ka=4.0×10-6)
②NaUr(s) ⇌Ur-(aq)+Na+(aq)
(1)37 ℃时,1.0 L水中最多可溶解8.0×10-3 mol尿酸钠,此温度下尿酸钠的Ksp为
(2)关节炎发作多在脚趾和手指的关节处,这说明温度降低时,尿酸钠的Ksp
(3)37 ℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3 mol·L-1,其中尿酸分子的浓度为5.0×10-4 mol·L-1,该病人尿液的c(H+)为
您最近一年使用:0次
2022-01-17更新
|
798次组卷
|
3卷引用:专题3 溶液中的离子反应 综合评价(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
(已下线)专题3 溶液中的离子反应 综合评价(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)第四节 沉淀溶解平衡 第1课时 难溶电解质的沉淀溶解平衡第三章 第四节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用



