名校
解题方法
1 . 某研究性学习小组通过传感器测量一定温度下物质的电导率,各物质的电导率数据如表:
下列分析不正确 的是
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 物质 | CaCO3(固体) | H2O | CaCO3 饱和溶液 | CaSO4 饱和溶液 | 0.001mol·L-1NaCl溶液 | 0.001mol·L-1AgNO3溶液 | AgCl 饱和溶液 |
| 电导率 | 0 | 7 | 37 | 389 | 1989 | 1138 | 13 |
| A.依据表中数据分析,CaCO3固体中不存在能自由移动的离子 |
| B.对比②和⑦,说明⑦中存在:AgCl=Ag++Cl- |
| C.对比③和④,可推出该温度下,Ksp(CaCO3)<Ksp(CaSO4) |
| D.⑤、⑥等体积混合后过滤,推测滤液的电导率等于13 |
您最近一年使用:0次
解题方法
2 . 将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小排列的顺序是
①20 mL 0.01 mol·L-1NH4Cl溶液
②30 mL 0.02 mol·L-1 CaCl2溶液
③40 mL 0.03 mol·L-1盐酸
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1AgNO3溶液
①20 mL 0.01 mol·L-1NH4Cl溶液
②30 mL 0.02 mol·L-1 CaCl2溶液
③40 mL 0.03 mol·L-1盐酸
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1AgNO3溶液
| A.①②③④⑤ | B.④①③②⑤ | C.⑤④②①③ | D.④③⑤②① |
您最近一年使用:0次
解题方法
3 . 已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10 mol2·L-2,则下列说法正确的是
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液为AgCl饱和溶液 |
| D.将固体AgCl加入到KI溶液中,固体由白色变为黄色,AgCl完全转化为AgI,AgCl的溶解度小于AgI的溶解度 |
您最近一年使用:0次
2021-04-23更新
|
535次组卷
|
5卷引用:3.4.1 沉淀溶解平衡原理-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)
(已下线)3.4.1 沉淀溶解平衡原理-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)作业10 沉淀溶解平衡-2021年高二化学暑假作业(人教版2019)广西百色市德保高中2021-2022学年高二上学期段考化学试题福建省莆田第十五中学2018-2019学年高二下学期期中测试化学试题(已下线)第21讲 难溶电解质的沉淀溶解平衡(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
20-21高三上·全国·阶段练习
4 . 下列图示与对应叙述相符的是
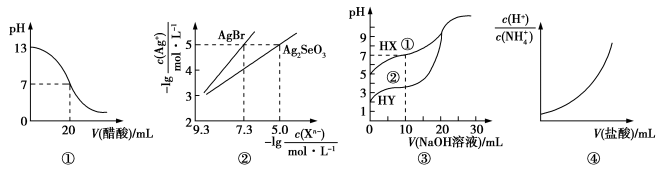

| A.图①表示25℃时,用0.1 mol·L−1醋酸滴定20 mL 0.1 mol·L−1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②表示将AgNO3溶液滴加到等浓度的NaBr、Na2SeO3混合溶液中所得的沉淀溶解平衡曲线(不考虑 的水解),则溶液中首先析出Ag2SeO3沉淀 的水解),则溶液中首先析出Ag2SeO3沉淀 |
| C.图③表示用0.1000 mol·L−1 NaOH溶液分别滴定20 mL 0.1000 mol·L−1的一元酸HX和HY的pH变化曲线,说明酸性:HX>HY |
D.图④表示向0.1 mol·L−1的NH4Cl溶液中滴加0.1 mol·L−1的盐酸,溶液中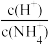 随盐酸的体积变化关系 随盐酸的体积变化关系 |
您最近一年使用:0次
名校
5 . 某温度下硫酸钡与水组成的混合物中加入少量硫酸钠固体,下列说法错误的是
| A.BaSO4的电离程度减小 | B.BaSO4溶解的量减小 |
C.c(Ba2+)与c(SO )的乘积不变 )的乘积不变 | D.溶液的导电能力增强 |
您最近一年使用:0次
2021-03-30更新
|
602次组卷
|
5卷引用:3.4.1 沉淀溶解平衡原理-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)
(已下线)3.4.1 沉淀溶解平衡原理-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)上海交通大学附属中学2021届高三下学期3月月考化学试题上海市控江中学2022-2023学年高三上学期第一次月考化学试题【精品卷】3.3.1 难溶电解质的沉淀溶解平衡课堂例题-人教版2023-2024学年选择性必修1题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
6 . 某温度下,向10mL 0.1mol/L CaCl2溶液中滴加0.1mol/L的Na2C2O4溶液,滴加过程中溶液中-lgc(Ca2+)与Na2C2O4溶液体积(V)的关系如图所示,下列有关说法正确的是(已知:lg2=0.3)


| A.a、b、c三点中,水的电离程度最大的为b点 |
| B.a点:2c(Ca2+)+c(H+)=c(Cl-)+c(OH-) |
| C.该温度下,Ksp(CaC2O4)=2.5×10-13mol2/L2 |
D.c点:c(C2O )+c(HC2O )+c(HC2O )+c(H2C2O4)=2c(Cl-) )+c(H2C2O4)=2c(Cl-) |
您最近一年使用:0次
2021-03-22更新
|
321次组卷
|
4卷引用:3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)
(已下线)3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)河北省祖冲之中学2020-2021学年高二上学期期末考试化学试题(已下线)3.4.1 沉淀溶解平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)河北省行唐启明中学2022-2023学年高二上学期12月月考化学试题
名校
7 . 把Ca(OH)2加入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),下列说法正确的是
Ca2+(aq)+2OH-(aq),下列说法正确的是
 Ca2+(aq)+2OH-(aq),下列说法正确的是
Ca2+(aq)+2OH-(aq),下列说法正确的是| A.恒温下向溶液中加CaO,溶液的pH升高 |
| B.加水稀释,平衡向正向移动,溶解度增大 |
| C.向溶液中加入Na2CO3,其中固体质量增加 |
| D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 |
您最近一年使用:0次
2021-03-02更新
|
265次组卷
|
3卷引用:3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)
(已下线)3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)甘肃省天水市一中2020-2021学年高二上学期第二学段(期末)考试化学试题【精品卷】3.3.1 难溶电解质的沉淀溶解平衡课堂例题-人教版2023-2024学年选择性必修1
2021高三·全国·专题练习
名校
8 . 将足量BaCO3固体分别加入:①30 mL水;②10 mL 0.2 mol·L-1Na2CO3溶液;③50 mL 0.01 mol·L-1 BaCl2溶液;④100 mL 0.01 mol·L-1盐酸中溶解至溶液饱和。请确定各溶液中c(Ba2+)由大到小的顺序为
| A.①②③④ | B.③④①② |
| C.④③①② | D.②①④③ |
您最近一年使用:0次
解题方法
9 . 某小组探究 沉淀向
沉淀向 沉淀转化过程中发生了异常现象,便进一步探究原因:
沉淀转化过程中发生了异常现象,便进一步探究原因:
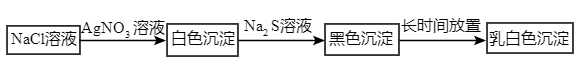
(1)已知 时,
时, 的溶度积
的溶度积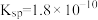 ,则下列说法正确的是
,则下列说法正确的是___________ 。
A.温度一定,当溶液中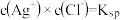 时,此溶液为
时,此溶液为 的饱和溶液
的饱和溶液
B. 溶液与
溶液与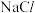 溶液混合后的溶液中,一定有
溶液混合后的溶液中,一定有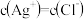
C.向饱和 水溶液中加入盐酸,
水溶液中加入盐酸, 值变大
值变大
D. 时,与水中相比,
时,与水中相比, 在
在 溶液中的溶解度、
溶液中的溶解度、 均要小
均要小
(2)写出 沉淀向
沉淀向 沉淀转化的离子方程式:
沉淀转化的离子方程式:___________ 。
(3)该小组同学认为长时间放置后产生乳白色沉淀与空气中的氧气有关,其反应的化学方程式为: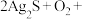 □
□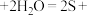 □
□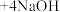 (请在答题卷的方框中填入物质及计量数)
(请在答题卷的方框中填入物质及计量数) ___________ 。
(4)为避免 沉淀向
沉淀向 沉淀转化过程中出现异常现象,需控制的反应条件是
沉淀转化过程中出现异常现象,需控制的反应条件是___________ 。
 沉淀向
沉淀向 沉淀转化过程中发生了异常现象,便进一步探究原因:
沉淀转化过程中发生了异常现象,便进一步探究原因:
(1)已知
 时,
时, 的溶度积
的溶度积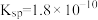 ,则下列说法正确的是
,则下列说法正确的是A.温度一定,当溶液中
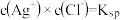 时,此溶液为
时,此溶液为 的饱和溶液
的饱和溶液B.
 溶液与
溶液与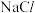 溶液混合后的溶液中,一定有
溶液混合后的溶液中,一定有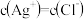
C.向饱和
 水溶液中加入盐酸,
水溶液中加入盐酸, 值变大
值变大D.
 时,与水中相比,
时,与水中相比, 在
在 溶液中的溶解度、
溶液中的溶解度、 均要小
均要小(2)写出
 沉淀向
沉淀向 沉淀转化的离子方程式:
沉淀转化的离子方程式:(3)该小组同学认为长时间放置后产生乳白色沉淀与空气中的氧气有关,其反应的化学方程式为:
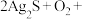 □
□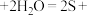 □
□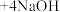 (请在答题卷的方框中填入物质及计量数)
(请在答题卷的方框中填入物质及计量数) (4)为避免
 沉淀向
沉淀向 沉淀转化过程中出现异常现象,需控制的反应条件是
沉淀转化过程中出现异常现象,需控制的反应条件是
您最近一年使用:0次
10 . 向氯化铁溶液中加入过量氢氧化钠溶液,振荡后静置一段时间。下列关于该体系的说法中错误的是
| A.溶液中不再存在Fe3+ |
| B.生成了氢氧化铁沉淀 |
| C.体系中存在氢氧化铁的沉淀溶解平衡 |
| D.加入少量盐酸,则溶液中Fe3+浓度会上升 |
您最近一年使用:0次
2021-02-20更新
|
191次组卷
|
4卷引用:苏教2020版选择性必修1专题3第四单元 沉淀溶解平衡课后习题



