名校
解题方法
1 . 已知:25℃时,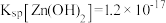 ,
, 。该温度下,下列说法错误的是
。该温度下,下列说法错误的是
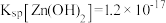 ,
, 。该温度下,下列说法错误的是
。该温度下,下列说法错误的是A. 的水解常数为 的水解常数为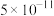 |
B. 溶于水形成的饱和溶液中, 溶于水形成的饱和溶液中,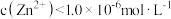 |
C.向 悬浊液中加入 悬浊液中加入 ,溶液中 ,溶液中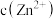 增大 增大 |
D.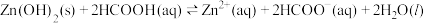 的平衡常数 的平衡常数 |
您最近一年使用:0次
2020-10-13更新
|
736次组卷
|
4卷引用:选择性必修1(SJ)专题3专题综合检测
2 . 25℃时,5种银盐的溶度积常数( )如表所示:
)如表所示:
下列说法正确的是
 )如表所示:
)如表所示:| 物质 |  |  |  | 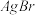 |  |
溶度积常数( ) ) |  | 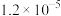 | 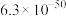 |  | 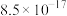 |
| A.氯化银、溴化银和碘化银的溶解度依次增大 |
| B.将硫酸银溶解于水形成饱和溶液后,向其中加入少量硫化钠溶液,不可能得到黑色沉淀 |
C.在 的 的 溶液中加入1滴( 溶液中加入1滴( 约20滴) 约20滴) 的 的 溶液(忽略溶液体积变化),不能观察到白色沉淀 溶液(忽略溶液体积变化),不能观察到白色沉淀 |
| D.将足量浅黄色溴化银固体浸泡在饱和氯化钠溶液中,有少量白色固体生成 |
您最近一年使用:0次
2020-10-13更新
|
479次组卷
|
2卷引用:选择性必修1(SJ)专题3易错疑难集训(二)
3 . 常温时,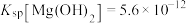 ,
, ,
, ,
,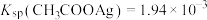 ,下列叙述不正确的是
,下列叙述不正确的是
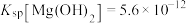 ,
, ,
, ,
,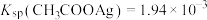 ,下列叙述不正确的是
,下列叙述不正确的是A.浓度均为 的 的 溶液和 溶液和 溶液等体积混合一定产生 溶液等体积混合一定产生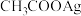 沉淀 沉淀 |
B.将 的 的 溶液滴入浓度均为 溶液滴入浓度均为 的 的 和 和 的混合溶液中,先产生 的混合溶液中,先产生 沉淀 沉淀 |
C.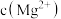 为 为 的溶液要产生 的溶液要产生 沉淀,溶液的pH应控制在8.5以上 沉淀,溶液的pH应控制在8.5以上 |
D.在其他条件不变的情况下,向饱和 溶液中加入 溶液中加入 溶液, 溶液,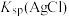 不变 不变 |
您最近一年使用:0次
2020-10-13更新
|
311次组卷
|
2卷引用:选择性必修1(SJ)专题3易错疑难集训(二)
名校
解题方法
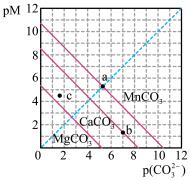
4 . 一定温度下,三种碳酸盐 (
(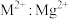 、
、 、
、 )的沉淀溶解平衡曲线如图所示。已知:
)的沉淀溶解平衡曲线如图所示。已知: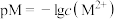 ,
, 。下列说法正确的是
。下列说法正确的是
 (
(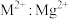 、
、 、
、 )的沉淀溶解平衡曲线如图所示。已知:
)的沉淀溶解平衡曲线如图所示。已知: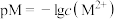 ,
, 。下列说法正确的是
。下列说法正确的是
A. 、 、 、 、 的 的 依次增大 依次增大 |
B.a点可表示 的饱和溶液,且 的饱和溶液,且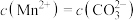 |
C.b点可表示 的饱和溶液,且 的饱和溶液,且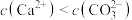 |
D.c点可表示 的不饱和溶液,且 的不饱和溶液,且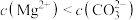 |
您最近一年使用:0次
2020-10-05更新
|
517次组卷
|
9卷引用:课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析
课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡 课时2 Ksp图象及其相关计算高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时2 Ksp图像及其相关计算人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 作业帮辽宁省沈阳市郊联体2021-2022学年高二上学期期中考试化学试题天津市南开中学2021-2022学年高二上学期期中检测化学试题河南省洛阳市2021-2022学年高二上期期中考试化学试题云南省玉溪第三中学2021-2022学年高二下学期3月入学考试化学试题黑龙江省哈尔滨市第六中学2022-2023学年高三8月月考化学试题
2014高三·全国·专题练习
名校
5 . 在一定温度下,当Mg(OH)2固体在水溶液中达到平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是( )
Mg2+(aq)+2OH-(aq),要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是( )
 Mg2+(aq)+2OH-(aq),要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是( )
Mg2+(aq)+2OH-(aq),要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是( )| A.加MgSO4固体 | B.加盐酸 | C.加NaOH固体 | D.加水 |
您最近一年使用:0次
2020-09-21更新
|
1294次组卷
|
23卷引用:课时1 沉淀溶解平衡及其应用
课时1 沉淀溶解平衡及其应用(已下线)第3章 水溶液中的离子反应与平衡(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡 课时1 沉淀溶解平衡及其应用高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时1 溶解平衡及其应用(已下线)3.4.1 沉淀溶解平衡原理(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)(已下线)3.4 难溶电解质的溶解平衡(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)云南省新平县一中2020-2021学年高二下学期期中考试化学试题四川省雅安市2020-2021学年高二下学期期末检测化学试题(已下线)2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷2015-2016学年福建省三明市A片区高中联盟校高二上期末化学试卷湖北省襄阳市第四中学2017-2018学年高二10月月考化学试题【市级联考】广西壮族自治区贺州市2018-2019学年高二上学期期末考试化学试题福建省永春县第一中学2018-2019学年高二上学期期末考试(理)化学试题广东省中山市第一中学2019-2020学年高二上学期第二次段考化学试题苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷重庆市云阳江口中学校2019-2020学年高二上学期第二次月考化学试题广东省湛江第一中学2019-2020学年高二12月月考化学试题宁夏吴忠市盐池高级中学2019-2020学年高二上学期期末检测化学试题宁夏自治区银川市北方民族大学附属中学2019-2020学年度(下)高二月考试卷广东省汕头市2017-2018学年高二下学期期末统考化学试题(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)广东省大湾区2022-2023学年高二上学期期末联考化学试题广东省深圳市罗湖高级中学2023-2024学年高二上学期12月阶段性考试化学试题
名校
6 . I.常温下, 的
的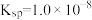 ,饱和溶液中存在平衡:
,饱和溶液中存在平衡: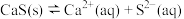 。
。
(1)①该温度下,将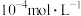 氯化钙溶液与
氯化钙溶液与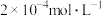 硫化钠溶液等体积混合,能否产生沉淀并说明理由:
硫化钠溶液等体积混合,能否产生沉淀并说明理由:_________ ;温度升高时,
_________ (填“增大”“减小”或“不变”,下同)。
②向 悬浊液中滴加少量浓盐酸,
悬浊液中滴加少量浓盐酸,
______ ,原因是_______ (用文字和离子方程式说明)。
(2)若向 悬浊液中加入
悬浊液中加入 溶液,生成一种黑色固体物质,写出该过程中发生反应的离子方程式:
溶液,生成一种黑色固体物质,写出该过程中发生反应的离子方程式:_________ 。
Ⅱ.已知常温下,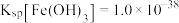 ,欲使
,欲使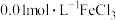 溶液开始产生
溶液开始产生 沉淀,应调整溶液
沉淀,应调整溶液 ,使
,使
____________ ,若要使其沉淀完全, 应
应____________ 。
 的
的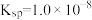 ,饱和溶液中存在平衡:
,饱和溶液中存在平衡: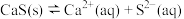 。
。(1)①该温度下,将
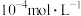 氯化钙溶液与
氯化钙溶液与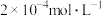 硫化钠溶液等体积混合,能否产生沉淀并说明理由:
硫化钠溶液等体积混合,能否产生沉淀并说明理由:
②向
 悬浊液中滴加少量浓盐酸,
悬浊液中滴加少量浓盐酸,
(2)若向
 悬浊液中加入
悬浊液中加入 溶液,生成一种黑色固体物质,写出该过程中发生反应的离子方程式:
溶液,生成一种黑色固体物质,写出该过程中发生反应的离子方程式:Ⅱ.已知常温下,
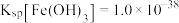 ,欲使
,欲使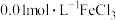 溶液开始产生
溶液开始产生 沉淀,应调整溶液
沉淀,应调整溶液 ,使
,使
 应
应
您最近一年使用:0次
2020-09-21更新
|
198次组卷
|
5卷引用:3.4.2 沉淀溶解平衡的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)3.4.2 沉淀溶解平衡的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练(已下线)3.4 难溶电解质的溶解平衡(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)云南省澄江市第一中学2021-2022年高二下学期3月月考化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期3月份考试化学试题
7 . T℃时,取一定量的 固体配成饱和溶液,t时刻改变某一外界条件,离子浓度随时间变化如图所示。下列有关说法正确的是
固体配成饱和溶液,t时刻改变某一外界条件,离子浓度随时间变化如图所示。下列有关说法正确的是
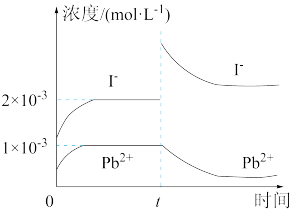
 固体配成饱和溶液,t时刻改变某一外界条件,离子浓度随时间变化如图所示。下列有关说法正确的是
固体配成饱和溶液,t时刻改变某一外界条件,离子浓度随时间变化如图所示。下列有关说法正确的是
A.T℃时,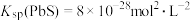 ,向 ,向 的悬浊液中加入 的悬浊液中加入 溶液,反应 溶液,反应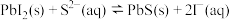 的化学平衡常数的数值为 的化学平衡常数的数值为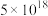 |
B.T℃时, |
C.温度不变,t时刻改变的条件可能是向溶液中加入了 固体, 固体,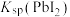 增大 增大 |
D.温度不变,向 饱和溶液中加入少量 饱和溶液中加入少量 浓溶液,平衡向左移动, 浓溶液,平衡向左移动, 的浓度减小 的浓度减小 |
您最近一年使用:0次
名校
8 . 下列有关 沉淀溶解平衡的说法正确的是
沉淀溶解平衡的说法正确的是
 沉淀溶解平衡的说法正确的是
沉淀溶解平衡的说法正确的是A.平衡时 沉淀生成和溶解的速率都等于零 沉淀生成和溶解的速率都等于零 |
B. 难溶于水,溶液中不存在 难溶于水,溶液中不存在 和 和 |
C.向 沉淀溶解平衡体系中加入 沉淀溶解平衡体系中加入 固体, 固体, 的 的 不变 不变 |
D.升高温度, 的溶解度不变 的溶解度不变 |
您最近一年使用:0次
2020-09-19更新
|
495次组卷
|
8卷引用:3.4.1 难溶电解质的沉淀溶解平衡(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)3.4.1 难溶电解质的沉淀溶解平衡(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)湖南省长沙市明德中学2020-2021学年高二下学期开学考化学试卷湖北省十堰市汉江中学2021-2022学年高二上学期期中考试化学试题(已下线)第三章 水溶液中的离子平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)黑龙江省佳木斯市第八中学2021-2022学年高二下学期开学考试化学试题甘肃省金昌市永昌县第一高级中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
9 . 下列事实不能用沉淀溶解平衡原理来解释的是( )
| A.碳酸钡不能用作“钡餐”而硫酸钡则能 |
| B.溶洞、珊瑚的形成 |
| C.用Na2CO3溶液浸泡锅炉水垢中的CaSO4 |
| D.用硝酸清洗试管内的银镜 |
您最近一年使用:0次
2020-09-18更新
|
115次组卷
|
3卷引用:3.4.2 沉淀溶解平衡的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)3.4.2 沉淀溶解平衡的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)四川省江油中学2019-2020学年高二下学期开学考试化学试题四川省绵阳市盐亭中学2021-2022学年高二下学期第四次月考化学试题
名校
解题方法
10 . 化学上常认为残留在溶液中的离子浓度≤1×10-5mol/L时,沉淀就已达完全。已知:常温下Ksp[M(OH)2]=1×10-21mol3/L3。则溶液中M2+沉淀完全时的pH最小值为
| A.7 | B.4 | C.5 | D.6 |
您最近一年使用:0次
2020-09-13更新
|
732次组卷
|
15卷引用:课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析
课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡 课时2 Ksp图象及其相关计算高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时2 Ksp图像及其相关计算(已下线)3.4 难溶电解质的溶解平衡(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)专题27 难溶电解质的溶解平衡(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练3.4.2沉淀溶解平衡原理的应用 课中黑龙江省大庆市大庆十中、二中、二十三中、二十八中2017-2018学年高二第一次联考化学试题广东省深圳市罗湖区2017-2018学年高二上学期期末模拟化学试题(已下线)2017-2018学年上学期期末复习备考之精准复习模拟题高二化学选修4(A卷)甘肃省武威第十八中学2017-2018学年高二上学期期末考试化学试题江西省吉安县第三中学2017-2018学年高二1月月考化学试题宁夏吴忠中学2017-2018学年高二上学期期末考试化学试题宁夏吴忠市吴忠中学2017-2018学年第一学期高二化学期末考试试卷(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)



