1 . 常温下,用 溶液分别滴定浓度均为
溶液分别滴定浓度均为 的
的 、
、 溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是
溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是
 溶液分别滴定浓度均为
溶液分别滴定浓度均为 的
的 、
、 溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是
溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是
A.曲线Ⅱ表示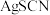 溶解平衡曲线 溶解平衡曲线 |
B. 点表示的是 点表示的是 的不饱和溶液 的不饱和溶液 |
C.沉淀废液中的 用 用 溶液比等浓度的 溶液比等浓度的 溶液效果好 溶液效果好 |
D.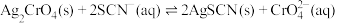 的平衡常数为 的平衡常数为 |
您最近一年使用:0次
2022-11-30更新
|
460次组卷
|
5卷引用:江西省赣州市重点中学六校2022-2023学年高二上学期期中联考化学试题
名校
解题方法
2 . 下列实验过程可以达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 测定中和热 | 将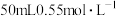 的NaOH溶液一次性迅速倒入盛 的NaOH溶液一次性迅速倒入盛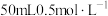 盐酸的烧杯中 盐酸的烧杯中 |
| B | 证明炭可与浓 反应生成 反应生成 | 向浓 中插入红热的炭,产生红棕色气体 中插入红热的炭,产生红棕色气体 |
| C | 证明AgCl的溶解度大于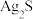 | 向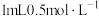 的 的 溶液中滴加几滴NaCl溶液,产生白色沉淀,再滴加几滴 溶液中滴加几滴NaCl溶液,产生白色沉淀,再滴加几滴 溶液产生黑色沉淀 溶液产生黑色沉淀 |
| D | 制取氨气并干燥 | 加热氯化铵和氢氧化钙的混合物,将产生的气体通过装有无水氯化钙的干燥管 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-30更新
|
270次组卷
|
2卷引用:江西省临川第一中学2022-2023学年高三上学期11月教学质量检测化学试题
名校
解题方法
3 . 下列实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 取两支试管,分别加入4mL 0.01mol/L KMnO4酸性溶液,然后向一支试管中加入0.1mol/L H2C2O4溶液2mL,向另一支试管中加入0.1mol/L H2C2O4溶液4mL,记录褪色时间。 | 可以证明H2C2O4浓度越大反应速率越快。 |
| B | 向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀。 | 可以证明在相同温度下,溶解度Mg(OH)2>Fe(OH)3 |
| C | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大。 | 证明了非金属性S>C |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅。 | 可以证明Na2CO3溶液中存在水解平衡。 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 下列实验事实不能用平衡移动原理解释的是
| A.向pH=4的乙酸溶液稀释10倍后溶液pH<5 |
| B.相比较于常温,加热后的纯碱溶液去除厨房的油污的效果更好 |
C.对 平衡体系压缩容器后可使气体颜色变深 平衡体系压缩容器后可使气体颜色变深 |
| D.水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除 |
您最近一年使用:0次
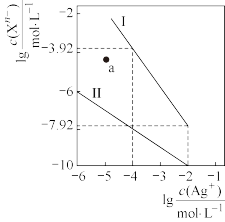
5 . 根据下列图示所得出的结论正确的是
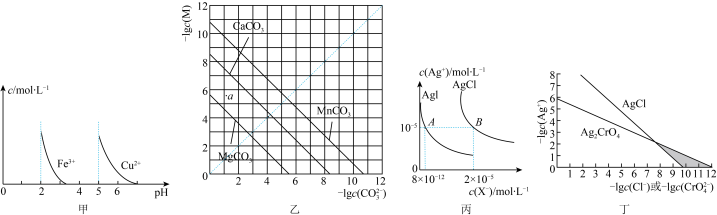

| A.由图甲可知,除去CuSO4溶液中的Fe3+可加入适量NaOH溶液调节pH至4左右 |
B.图乙是一定温度下三种碳酸盐的沉淀溶解平衡曲线,a点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO ) ) |
| C.图丙是室温下AgCl和AgI的饱和溶液中离子浓度的关系曲线,该温度下反应AgCl(s)+I-(aq)⇌AgI(s)+Cl-(aq)的平衡常数K=2.5×106 |
| D.图丁是室温下AgCl和Ag2CrO4的沉淀溶解平衡曲线,阴影区域中的点可以同时生成Ag2CrO4沉淀和AgCl沉淀 |
您最近一年使用:0次
2022-11-26更新
|
398次组卷
|
2卷引用:江西省新余市第一中学2022-2023高二上学期期末考试化学试题
6 . 常温下,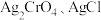 的
的 值分别为
值分别为 ,下列说法正确的是
,下列说法正确的是
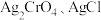 的
的 值分别为
值分别为 ,下列说法正确的是
,下列说法正确的是A.反应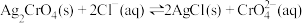 的平衡常数 的平衡常数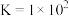 |
B.在食盐水中, 的溶解度及 的溶解度及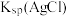 均比在蒸馏水中小 均比在蒸馏水中小 |
C.常温下, 饱和溶液中 饱和溶液中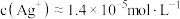 |
D.向饱和 中加入 中加入 溶液有沉淀生成, 溶液有沉淀生成, 减小 减小 |
您最近一年使用:0次
22-23高二上·北京西城·期中
7 . 下列实验方案不能达到相应目的的是
| 目的 | A.验证Fe是否被氧化 | B.研究浓度对FeCl3水解平衡的影响 |
| 实验方案 | 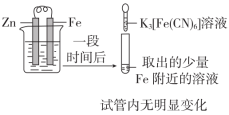 |  |
| 目的 | C.比较CH3COOH和H3BO3(硼酸,一元弱酸)酸性的强弱 | D.比较AgCl和AgI溶解度的大小 |
| 实验方案 |  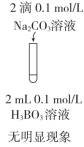 | 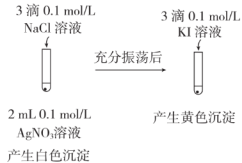 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 下列实验中,现象及结论都正确,且二者之间有因果的是
选项 | 实验操作 | 现象 | 结论 |
A | 用两支试管各取5 mL 0.1 mol/L酸性KMnO4溶液,分别加入2 mL 0.1 mol/L和0.2 mol/L H2C2O4溶液 | 两试管溶液均褪色,且加0.2 mol/LH2C2O4的试管中褪色更快 | 其他条件不变,H2C2O4浓度越大,化学反应速率越大 |
B | 比较CH3COOH和HClO的酸性强弱 | 用pH试纸分别测量物质的量浓度相等的CH3COONa比NaClO溶液的pH小 | CH3COOH比HClO的酸性强 |
C | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液 | 生成黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
D | 将10 mL 2 mol·L-1的KI溶液与1 mL 1 mol·L-1 FeCl3溶液混合充分反应后滴加KSCN溶液 | 溶液颜色变红 | KI与FeCl3的反应有可逆性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-16更新
|
225次组卷
|
2卷引用:江西省重点校2022-2023学年高三上学期第三次联考化学试题.
9 . 科学家开发出的新型太阳能铜铟镓二硒(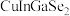 )电池,光电转化率达到25%。某小组以硒化银半导体废料(含
)电池,光电转化率达到25%。某小组以硒化银半导体废料(含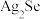 、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
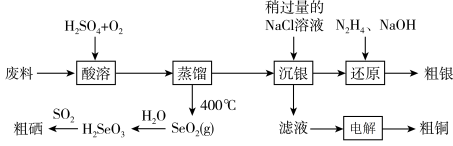
(1)NaOH的电子式为___________ 。
(2)下列事实能说明硫的非金属性比硒的强的是___________ (填标号)。
A.溶解度: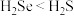
B.沸点: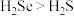
C.酸性: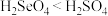
(3)“酸溶”时,能提高反应速率的措施有___________ (答1条即可)。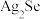 、
、 和
和 反应的化学方程式为
反应的化学方程式为___________ 。
(4)“电解”时,阳极生成的气体为___________ (填化学式),电解结束后,电解液的pH___________ (填“增大”、“减小”或“不变”)。
(5)在上述流程中,H2SeO3转化为Se的过程中,当生成23.7gSe时,理论上有标准状况下___________ LSO2参与反应。
(6)“沉银”时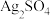 转化成AgCl,,该反应的平衡常数
转化成AgCl,,该反应的平衡常数
___________ 。[已知:常温下,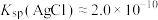 ,
,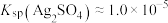 ]
]
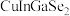 )电池,光电转化率达到25%。某小组以硒化银半导体废料(含
)电池,光电转化率达到25%。某小组以硒化银半导体废料(含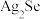 、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
(1)NaOH的电子式为
(2)下列事实能说明硫的非金属性比硒的强的是
A.溶解度:
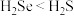
B.沸点:
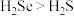
C.酸性:
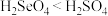
(3)“酸溶”时,能提高反应速率的措施有
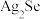 、
、 和
和 反应的化学方程式为
反应的化学方程式为(4)“电解”时,阳极生成的气体为
(5)在上述流程中,H2SeO3转化为Se的过程中,当生成23.7gSe时,理论上有标准状况下
(6)“沉银”时
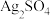 转化成AgCl,,该反应的平衡常数
转化成AgCl,,该反应的平衡常数
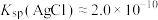 ,
,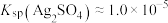 ]
]
您最近一年使用:0次
10 . NiSO4•6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:

已知:各离子开始沉淀及完全沉淀时的pH如表所示:
(1)向滤液Ⅰ中加入FeS固体是为了生成更难溶于水的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为___________ ,当c(Cu2+)≤1.0×10-5mol•L-1时,可认为Cu2+已沉淀完全,此时溶液中S2-的浓度不小于___________ 。(已知:Ksp(CuS)=6.3×10-36)
(2)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加H2O2的目的是___________ 。
②调节滤液Ⅱ的pH,pH应控制在范围___________ 。
③检验滤液Ⅲ中杂质金属离子是否除尽的试剂是___________ 。
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是___________ 。

已知:各离子开始沉淀及完全沉淀时的pH如表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.3 | 9.7 |
| Fe3+ | 2.2 | 3.2 |
| Ni2+ | 6.4 | 8.4 |
(2)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加H2O2的目的是
②调节滤液Ⅱ的pH,pH应控制在范围
③检验滤液Ⅲ中杂质金属离子是否除尽的试剂是
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
您最近一年使用:0次
2022-09-26更新
|
251次组卷
|
2卷引用:江西省丰城市第九中学2021-2022学年高二上学期期末考试化学试题



