名校
解题方法
1 . 碲(Te)广泛用于太阳能、电子、医药等领域,对碲的综合回收利用尤为重要。工业上,从含碲化亚铜的废渣(主要成分Cu2Te,还有少量的Ag、Cu)中提取碲的流程如图:

回答下列问题:
(1)写出碲元素在元素周期表中的位置____ 。
(2)“酸浸”过程中生成TeOSO4的离子方程式为____ 。
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl?通过计算说明____ 。
(4)电解除铜时,铜、碲沉淀的关系如表。
①电解初始阶段阴极的电极反应式是____ 。
②最佳电解时间为30min,原因是____ 。
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从5.0g/L下降到0.2g/L,写出TeOSO4生成Te的化学方程式____ ,其中Te元素的回收率为____ (忽略溶液体积变化,结果用百分数表示,保留二位有效数字)。
(6)整个过程中可循环利用的物质为____ (填化学式)。

回答下列问题:
(1)写出碲元素在元素周期表中的位置
(2)“酸浸”过程中生成TeOSO4的离子方程式为
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgCl)=1.8×10-10。向含Ag2SO4滤渣中加入浓盐酸,Ag2SO4能否充分转化为AgCl?通过计算说明
(4)电解除铜时,铜、碲沉淀的关系如表。
| 电解时间(min) | 铜沉淀率 | 碲沉淀率 |
| 10 | 25% | 0.1% |
| 20 | 40% | 0.2% |
| 30 | 62% | 0.4% |
| 40 | 65% | 2.0% |
②最佳电解时间为30min,原因是
(5)向“滤液II”中通入SO2反应一段时间后,Te(IV)的浓度从5.0g/L下降到0.2g/L,写出TeOSO4生成Te的化学方程式
(6)整个过程中可循环利用的物质为
您最近一年使用:0次
2022-05-05更新
|
667次组卷
|
3卷引用:江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题
江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题(已下线)微专题28 有关工艺流程和实验探究方程式的书写-备战2023年高考化学一轮复习考点微专题陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题
名校
2 . 下列有关实验操作的解释或结论正确的是
| 实验操作 | 解释或结论 | |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2 固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B | 加热石蜡油,将产生的气体通入酸性高锰酸钾,溶液褪色 | 证明反应一定生成了乙烯 |
| C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| D | 用氢氧化钾与浓硫酸测定中和反应的反应热 | 测得的结果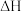 偏大 偏大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 以碳酸锰铜矿(主要成分为MnCO3、CuCO3,还含有Fe2O3、FeO等杂质)为原料制备硫酸锰的一种工艺流程如下:
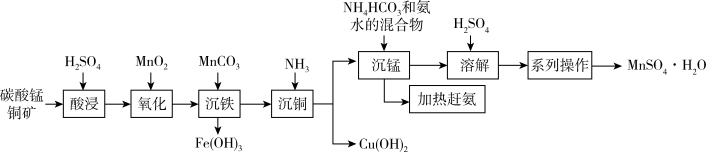
(1)“氧化”时,反应的离子方程式为_______ 。可用一种试剂检验氧化后的溶液中是否含有Fe2+,该试剂为_______ (写化学式)。
(2)加入MnCO3调节pH=3.3时可以将Fe3+转化为Fe(OH)3而除去,该反应的离子方程式为_______ 。
(3)“沉铜"时,若滤液中c(Mn2+)=0.21mol·L-1,向其中缓慢通入氨气,为了使铜离子完全沉淀而又避免生成Mn(OH)2,应控制pH的范围为_______ 。[已知:常温下,Ksp[Cu(OH)2]=1×10-20,Ksp[Mn(OH)2]=2.1×10-13,离子浓度小于或等于10-5mol/L可视为沉淀完全]
(4)本工艺中可循环使用的物质是_______ 。
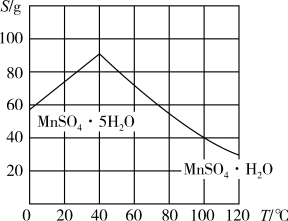
(5)结合图象,分析获得(MnSO4·H2O)晶体的“系列操作”步骤为:_______ 、_______ ,酒精洗涤,低温干燥。

(1)“氧化”时,反应的离子方程式为
(2)加入MnCO3调节pH=3.3时可以将Fe3+转化为Fe(OH)3而除去,该反应的离子方程式为
(3)“沉铜"时,若滤液中c(Mn2+)=0.21mol·L-1,向其中缓慢通入氨气,为了使铜离子完全沉淀而又避免生成Mn(OH)2,应控制pH的范围为
(4)本工艺中可循环使用的物质是
(5)结合图象,分析获得(MnSO4·H2O)晶体的“系列操作”步骤为:

您最近一年使用:0次
2022-04-13更新
|
677次组卷
|
6卷引用:江西省九江市2022届第二次高考模拟统一考试理综化学试题
江西省九江市2022届第二次高考模拟统一考试理综化学试题江西省安义中学2022-2023学年高三上学期中考试化学试题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
4 . 常温下,几种难溶物的溶度积常数如下表所示。下列说法错误的是
| 化合物 |  |  |  |  |  |  |
 | 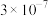 | 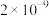 |  | 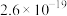 | 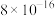 | 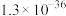 |
A.常温下,溶解度: |
B.向含同浓度的 和 和 混合溶液中滴加稀 混合溶液中滴加稀 溶液, 溶液, 先沉淀 先沉淀 |
C.向 悬浊液中加入 悬浊液中加入 溶液,无明显现象 溶液,无明显现象 |
D.反应 的平衡常数很小,反应几乎不进行 的平衡常数很小,反应几乎不进行 |
您最近一年使用:0次
名校
解题方法
5 . 氧化钴(Co2O3)在工业、电子、电讯等领域都有着广阔的应用前景。以铜钴矿石[主要成分为CoO(OH),CoCO3、Cu2(OH)2CO3和 SiO2,还有少量Fe、Mg、Ca的氧化物]为原料制备氧化钴(Co2O3)的工艺流程如图所示:

已知:常温下:Ksp(FeS)=6.3×10-18 Ksp(CuS)=6.3×10-36 Ksp(CaF2)=4.0×10-11 Ksp(MgF2)=9.0×10-11。
回答下列问题:
(1)写出“浸泡”过程中CoO(OH)与Na2SO3反应的离子方程式_______ 。
(2)“除铜”过程中,加入FeS固体得到更难溶的CuS,写出“除铜”过程的离子方程式_______ 。
(3)检验过程Ⅰ所得滤液中铁元素的离子已被完全沉淀的实验操作及现象:取少量待测液于试管中,_______ 。
(4)常温下,在过程Ⅱ中加入足量的NaF溶液可除去Ca2+、Mg2+,当两者沉淀完全时F-的浓度至少为_______ mol·L-1(溶液中离子浓度小于1×10-5 mol·L-1视为该离子沉淀完全)。
(5)过程Ⅲ中加入Na2CO3得到滤渣后又加入盐酸溶解,其目的是_______ 。

已知:常温下:Ksp(FeS)=6.3×10-18 Ksp(CuS)=6.3×10-36 Ksp(CaF2)=4.0×10-11 Ksp(MgF2)=9.0×10-11。
回答下列问题:
(1)写出“浸泡”过程中CoO(OH)与Na2SO3反应的离子方程式
(2)“除铜”过程中,加入FeS固体得到更难溶的CuS,写出“除铜”过程的离子方程式
(3)检验过程Ⅰ所得滤液中铁元素的离子已被完全沉淀的实验操作及现象:取少量待测液于试管中,
(4)常温下,在过程Ⅱ中加入足量的NaF溶液可除去Ca2+、Mg2+,当两者沉淀完全时F-的浓度至少为
(5)过程Ⅲ中加入Na2CO3得到滤渣后又加入盐酸溶解,其目的是
您最近一年使用:0次
名校
解题方法
6 . 下列实验操作和现象正确,且能得到对应结论的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向 0.01mol/LKMnO4酸性溶液中滴加0.1mol/LH2C2O4溶液,充分振荡 | 溶液褪色 | H2C2O4体现氧化性 |
| B | 向滴有酚酞的Na2CO3溶液中加入BaCl2固体 | 溶液颜色逐渐褪去 | Na2CO3溶液中的水解平衡发生了移动 |
| C | 镀锡铁出现刮痕后浸入饱和食盐水中,一段时间后滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀 | 铁作原电池正极 |
| D | 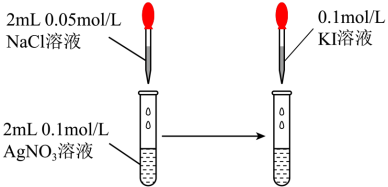 | 先产生白色沉淀,后变为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
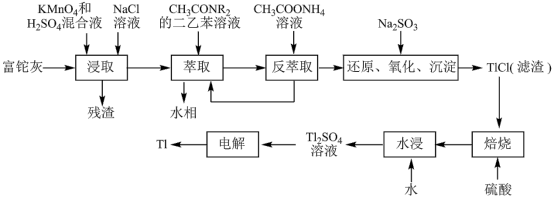
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)在实验室中,“萃取”过程使用的玻璃仪器有_______ ,用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)在实验室中,“萃取”过程使用的玻璃仪器有
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为

您最近一年使用:0次
2022-04-10更新
|
765次组卷
|
2卷引用:江西省八所重点中学2022届高三联考理科综合化学试题
8 . 氨是重要的基础化工原料,工业上常用于制备氨水、亚硝酸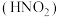 、连二次硝酸
、连二次硝酸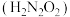 、尿素
、尿素 等多种含氮的化工产品。
等多种含氮的化工产品。
(1)已知: 时,连二次硝酸
时,连二次硝酸 的电离常数为
的电离常数为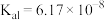 、
、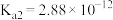 ;往
;往 溶液中滴加氢氧化钠溶液至
溶液中滴加氢氧化钠溶液至 ,
, 、
、 、离子浓度由大到小的顺序为
、离子浓度由大到小的顺序为___________ 。
(2)常温下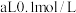 的
的 和
和 的
的 混合,混合后溶液呈中性,
混合,混合后溶液呈中性, 的电离常数为
的电离常数为___________ (用含a、b的式子表示)
(3)向浓度均为 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中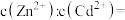
___________ 。[已知: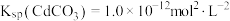 ,
,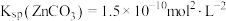 ]
]
可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。
(4)羟基磷灰石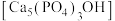 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: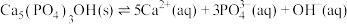 。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:___________
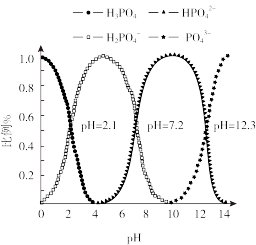
(5)常温下,向磷酸溶液中滴加 溶液,含磷微粒的分布比例与
溶液,含磷微粒的分布比例与 的关系如图所示。
的关系如图所示。 溶液显酸性,下列有关分析正确的是___________。
溶液显酸性,下列有关分析正确的是___________。
(6)联氨(又称联肼, 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:____________ 平衡常数值为___________ (已知: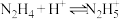 的
的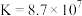 ;
;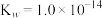 )。
)。
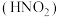 、连二次硝酸
、连二次硝酸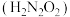 、尿素
、尿素 等多种含氮的化工产品。
等多种含氮的化工产品。(1)已知:
 时,连二次硝酸
时,连二次硝酸 的电离常数为
的电离常数为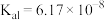 、
、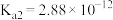 ;往
;往 溶液中滴加氢氧化钠溶液至
溶液中滴加氢氧化钠溶液至 ,
, 、
、 、离子浓度由大到小的顺序为
、离子浓度由大到小的顺序为(2)常温下
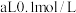 的
的 和
和 的
的 混合,混合后溶液呈中性,
混合,混合后溶液呈中性, 的电离常数为
的电离常数为(3)向浓度均为
 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中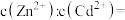
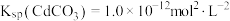 ,
,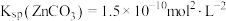 ]
]可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为
 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。(4)羟基磷灰石
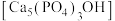 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: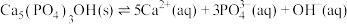 。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:(5)常温下,向磷酸溶液中滴加
 溶液,含磷微粒的分布比例与
溶液,含磷微粒的分布比例与 的关系如图所示。
的关系如图所示。 溶液显酸性,下列有关分析正确的是___________。
溶液显酸性,下列有关分析正确的是___________。
A.溶液中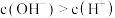 |
B. 的电离程度大于其水解程度 的电离程度大于其水解程度 |
C. c(Na+)+ c(H+)=c(H2PO )+2c(HPO )+2c(HPO )+3c(PO )+3c(PO )+c(OH—) )+c(OH—) |
| D.溶液中水的电离程度比纯水大 |
(6)联氨(又称联肼,
 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为: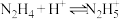 的
的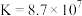 ;
;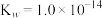 )。
)。
您最近一年使用:0次
9 . 常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是

| A.曲线Ⅱ表示MnS的沉淀溶解平衡曲线 |
| B.升高温度,曲线Ⅱ上的c点可沿虚线平移至e点 |
C.常温下,反应MnS(s)+Fe2+(aq) FeS(s)+Mn2+(aq)的平衡常数K≈4×104 FeS(s)+Mn2+(aq)的平衡常数K≈4×104 |
| D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿Ⅰ线向a点方向移动 |
您最近一年使用:0次
2022-03-29更新
|
701次组卷
|
7卷引用:江西省宜春市铜鼓中学2021-2022学年高二下学期开学考化学试题
10 . 碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(主要含有SrCO3及少量MgCO3、CaCO3、BaCO3等)制备高纯碳酸锶的工艺流程如图所示。
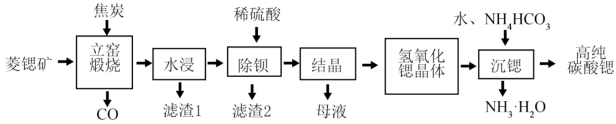
已知:①不溶性碳酸盐高温下分解,生成金属氧化物和CO2,可溶性碳酸盐高温不分解。
②298K时,Ksp[SrCO3]=5.6×10-10、Ksp[CaCO3]=3.36×10-9
③Sr(OH)2在水中的溶解度数据如表:
回答下列问题:
(1)SrCO3中Sr的化合价____ 。
(2)向“立窑煅烧”中投料前,将菱锶矿、焦炭混合粉碎的目的是____ (任写两点)。
(3)“水浸”中用____ (填“冷水”、“热水”),“滤渣1”中含有焦炭、MgO和____ (填化学式)。
(4)“立窑煅烧”中SrCO3与焦炭反应的化学方程式为____ 。
(5)“沉锶”中反应的化学方程式为____ 。
(6)计算298K时,反应CaCO3(s)+Sr2+(aq) SrCO3(s)+Ca2+(aq)平衡常数的数值是
SrCO3(s)+Ca2+(aq)平衡常数的数值是____ 。

已知:①不溶性碳酸盐高温下分解,生成金属氧化物和CO2,可溶性碳酸盐高温不分解。
②298K时,Ksp[SrCO3]=5.6×10-10、Ksp[CaCO3]=3.36×10-9
③Sr(OH)2在水中的溶解度数据如表:
| 温度/℃ | 10 | 60 | 90 | 100 |
| 溶解度/(g/100g) | 1.25 | 8.42 | 44.5 | 91.2 |
回答下列问题:
(1)SrCO3中Sr的化合价
(2)向“立窑煅烧”中投料前,将菱锶矿、焦炭混合粉碎的目的是
(3)“水浸”中用
(4)“立窑煅烧”中SrCO3与焦炭反应的化学方程式为
(5)“沉锶”中反应的化学方程式为
(6)计算298K时,反应CaCO3(s)+Sr2+(aq)
 SrCO3(s)+Ca2+(aq)平衡常数的数值是
SrCO3(s)+Ca2+(aq)平衡常数的数值是
您最近一年使用:0次



