1 . 下列操作、现象和结论都正确的是
| 选项 | 操作与现象 | 结论 |
| A | 在Cu和稀硫酸中滴加 溶液,铜继续溶解 溶液,铜继续溶解 |  作该反应的催化剂 作该反应的催化剂 |
| B | 电解含 、 、 的硝酸盐溶液,优先析出红色固体 的硝酸盐溶液,优先析出红色固体 | 氧化性: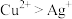 |
| C | 在 浊液中滴加 浊液中滴加 溶液生成粉红色沉淀 溶液生成粉红色沉淀 | 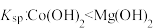 |
| D | 测定浓度相同的 、NaCN溶液pH,后者较大 、NaCN溶液pH,后者较大 | 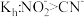 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 下述实验操作不能达到实验目的的是
| 编号 | 实验目的 | 实验操作及现象 |
| A | 检验溶液中是否存在 | 向待测液中先加稀盐酸酸化,再加氯化钡,产生白色沉淀 |
| B | 验证 的还原性 的还原性 |  溶液中加入酸性 溶液中加入酸性 溶液, 溶液, 溶液褪色 溶液褪色 |
| C | 比较碳酸和硅酸的酸性强弱 | 在 中加浓盐酸并将反应后所得气体直接通入 中加浓盐酸并将反应后所得气体直接通入 溶液中,溶液变浑浊 溶液中,溶液变浑浊 |
| D | 比较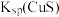 与 与 的大小 的大小 | 将 气体通入浓度均为 气体通入浓度均为 的 的 和 和 混合溶液中,先出现CuS黑色沉淀 混合溶液中,先出现CuS黑色沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-09-06更新
|
637次组卷
|
3卷引用:江西省抚州市黎川县第一中学2021-2022学年上学期高三第三次同步考试化学试题
解题方法
3 . 三氯化铬( )为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
)为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
(1)某化学小组用 和
和 在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有
在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有 ,其沸点为76.8℃。
,其沸点为76.8℃。________ 。
(2)装置D中还会生成光气( ),D中反应的化学方程式为
),D中反应的化学方程式为________ 。
(3)该实验装置有设计不合理的地方,请写出改进方法:________ 。(写一点即可)
(4)为进一步探究 的性质,某同学取试管若干支,分别加入10滴0.1
的性质,某同学取试管若干支,分别加入10滴0.1
 溶液,并用4滴2
溶液,并用4滴2
 酸化,再分别加入不同滴数的0.1
酸化,再分别加入不同滴数的0.1
 溶液,并在不同的温度下进行实验,反应现象记录于表中。
溶液,并在不同的温度下进行实验,反应现象记录于表中。
①浓度对反应的影响: 与
与 在常温下反应,观察不到
在常温下反应,观察不到 离子的橙色,甲同学认为其中一个原因是
离子的橙色,甲同学认为其中一个原因是 离子的橙色被
离子的橙色被 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是_______ 。所以必须将反应液加热至沸腾4~5min后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
② 与
与 的用量对反应的影响对表中数据进行分析,在上述反应条件下,欲将
的用量对反应的影响对表中数据进行分析,在上述反应条件下,欲将 氧化为
氧化为 ,
, 与
与 最佳用量比为
最佳用量比为______ 。这与由反应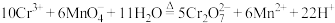 所推断得到的用量比不符,你推测的原因是
所推断得到的用量比不符,你推测的原因是________ 。
(5)Cr(Ⅲ)的存在形态的物质的量分数随溶液pH的分布如图所示。请补充完整由 溶液制备纯净的
溶液制备纯净的 的实验方案:取适量
的实验方案:取适量 溶液,
溶液,_______ ;充分反应后过滤,用蒸馏水洗涤沉淀,低温烘干沉淀,得到 晶体。
晶体。
 )为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
)为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。(1)某化学小组用
 和
和 在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有
在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有 ,其沸点为76.8℃。
,其沸点为76.8℃。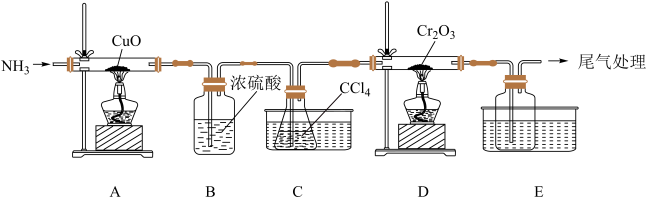
(2)装置D中还会生成光气(
 ),D中反应的化学方程式为
),D中反应的化学方程式为(3)该实验装置有设计不合理的地方,请写出改进方法:
(4)为进一步探究
 的性质,某同学取试管若干支,分别加入10滴0.1
的性质,某同学取试管若干支,分别加入10滴0.1
 溶液,并用4滴2
溶液,并用4滴2
 酸化,再分别加入不同滴数的0.1
酸化,再分别加入不同滴数的0.1
 溶液,并在不同的温度下进行实验,反应现象记录于表中。
溶液,并在不同的温度下进行实验,反应现象记录于表中。 的用量(滴数) 的用量(滴数) | 在不同温度下的反应现象 | |
| 25℃ | 90~100℃ | |
| 1 | 紫红色 | 蓝绿色溶液 |
| 2~3 | 紫红色 | 黄绿色溶液,且随 滴数增加,黄色成分增多 滴数增加,黄色成分增多 |
| 10 | 紫红色 | 澄清的橙黄色溶液 |
| 11~23 | 紫红色 | 橙黄色溶液,有棕褐色沉淀,且随 滴数增加,沉淀增多 滴数增加,沉淀增多 |
| 24~25 | 紫红色 | 紫红色溶液,有较多的棕褐色沉淀 |
 与
与 在常温下反应,观察不到
在常温下反应,观察不到 离子的橙色,甲同学认为其中一个原因是
离子的橙色,甲同学认为其中一个原因是 离子的橙色被
离子的橙色被 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是②
 与
与 的用量对反应的影响对表中数据进行分析,在上述反应条件下,欲将
的用量对反应的影响对表中数据进行分析,在上述反应条件下,欲将 氧化为
氧化为 ,
, 与
与 最佳用量比为
最佳用量比为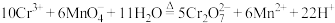 所推断得到的用量比不符,你推测的原因是
所推断得到的用量比不符,你推测的原因是(5)Cr(Ⅲ)的存在形态的物质的量分数随溶液pH的分布如图所示。请补充完整由
 溶液制备纯净的
溶液制备纯净的 的实验方案:取适量
的实验方案:取适量 溶液,
溶液, 晶体。
晶体。
您最近一年使用:0次
名校
解题方法
4 . 下列实验操作和现象正确,且能得到对应结论的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向 0.01mol/LKMnO4酸性溶液中滴加0.1mol/LH2C2O4溶液,充分振荡 | 溶液褪色 | H2C2O4体现氧化性 |
| B | 向滴有酚酞的Na2CO3溶液中加入BaCl2固体 | 溶液颜色逐渐褪去 | Na2CO3溶液中的水解平衡发生了移动 |
| C | 镀锡铁出现刮痕后浸入饱和食盐水中,一段时间后滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀 | 铁作原电池正极 |
| D | 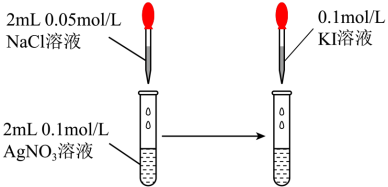 | 先产生白色沉淀,后变为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 回收利用废旧铅蓄电池可缓解铅资源短缺,同时减少污染。从废旧铅蓄电池的铅膏中回收铅的生产流程如下图(部分产物已略去)。
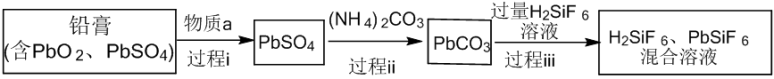
已知: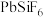 和
和 均为能溶于水的强电解质。下列说法正确的是
均为能溶于水的强电解质。下列说法正确的是

已知:
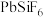 和
和 均为能溶于水的强电解质。下列说法正确的是
均为能溶于水的强电解质。下列说法正确的是| A.物质a表现氧化性 |
B. 易溶于水 易溶于水 |
C.过程iii发生反应的离子方程式为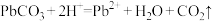 |
| D.过程i、过程ii、过程iii中均有气体生成 |
您最近一年使用:0次
2021-10-11更新
|
310次组卷
|
6卷引用:江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题
解题方法
6 . 某小组利用含铅废料(主要含PbO、PbSO4和PbO2)制备化工产品三盐(PbSO4·3PbO·H2O)的工艺流程如图:
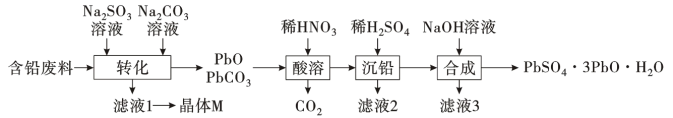
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13,Pb(OH)2具有两性,PbO2有强氧化性。请回答下列问题:
(1)结晶水合物M(M=322g/mol)的化学式为___ 。
(2)“转化”中,加入Na2SO3溶液的离子反应方程式___ 。
(3)“转化”中,加入Na2CO3目的是___ 。
(4)下列试剂可以替代Na2SO3溶液___ (填写字母)。
A.H2O2溶液 B.Na2SO4溶液 C.高锰酸钾溶液 D.Fe2(SO4)3溶液
(5)该流程中可以循环利用的物质是___ (填写物质名称)。
(6)“酸溶”时,反应温度为40℃,其主要原因是___ 。
(7)合成三盐的化学方程式为___ ,解释“合成”需控制溶液的pH不能大于10的原因___ 。

已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13,Pb(OH)2具有两性,PbO2有强氧化性。请回答下列问题:
(1)结晶水合物M(M=322g/mol)的化学式为
(2)“转化”中,加入Na2SO3溶液的离子反应方程式
(3)“转化”中,加入Na2CO3目的是
(4)下列试剂可以替代Na2SO3溶液
A.H2O2溶液 B.Na2SO4溶液 C.高锰酸钾溶液 D.Fe2(SO4)3溶液
(5)该流程中可以循环利用的物质是
(6)“酸溶”时,反应温度为40℃,其主要原因是
(7)合成三盐的化学方程式为
您最近一年使用:0次
2021-05-17更新
|
329次组卷
|
2卷引用:江西省重点中学协作体2021届高三5月第二次联考理综化学试题
名校
7 . 以下10种实验操作方法以及结论错误的有几种:
①比较水和乙醇羟基的活泼性强弱,用金属钠分别与水和乙醇反应。
②欲证明CH2=CHCHO中含有碳碳双键,滴入酸性KMnO4溶液,看紫红色是否褪去。
③欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸、氢氧化钠、酸碱指示剂。
④将0.1mol/L的NaOH溶液与0.5mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是否为还原性糖
⑤向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)﹤Ksp(BaSO4)。
⑥检验溴乙烷中的溴元素,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液。
⑦用燃烧的方法鉴别乙醇、四氯化碳、苯。
⑧用足量的NaOH溶液与矿物油和地沟油加热,可鉴别出地沟油。
⑨油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油分离。
⑩将铜丝在酒精灯外焰上加热变黑后再移至内焰,铜丝恢复原来的红色
①比较水和乙醇羟基的活泼性强弱,用金属钠分别与水和乙醇反应。
②欲证明CH2=CHCHO中含有碳碳双键,滴入酸性KMnO4溶液,看紫红色是否褪去。
③欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸、氢氧化钠、酸碱指示剂。
④将0.1mol/L的NaOH溶液与0.5mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是否为还原性糖
⑤向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)﹤Ksp(BaSO4)。
⑥检验溴乙烷中的溴元素,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液。
⑦用燃烧的方法鉴别乙醇、四氯化碳、苯。
⑧用足量的NaOH溶液与矿物油和地沟油加热,可鉴别出地沟油。
⑨油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油分离。
⑩将铜丝在酒精灯外焰上加热变黑后再移至内焰,铜丝恢复原来的红色
| A.3 | B.4 | C.5 | D.6 |
您最近一年使用:0次
2019-05-31更新
|
546次组卷
|
2卷引用:【校级联考】江西省临川二中、临川二中实验学校2018-2019学年高二下学期第三次联考化学试题
18-19高三上·江西南昌·阶段练习
解题方法
8 . 下列实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有漂白粉溶液的试管中加浓硫酸 | 产生黄绿色气体 | 浓硫酸具有氧化性 |
| B | 向SO2水溶液中滴入几滴BaCl2溶液,振荡 | 出现白色沉淀 | 此沉淀是BaSO4 |
| C | 使装有NO2气体的密闭容器减小体积 | 气体颜色先变深、而后变浅 | 气体颜色变浅原因是:2NO2⇋N2O4 |
| D | 先向2mL 0.1mol/L Na2S溶液中滴入几滴0.1mol/L ZnSO4溶液,再加入几滴0.1mol/L CuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 根据如表实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现 | 结论 |
A | 常温下,将FeCl3溶液加入Mg(OH)2悬浊液中,沉淀由白色变为红褐色 | 常温下,Ksp[Fe(OH)3]> Ksp[Mg(OH)2] |
B | 向某溶液中滴加稀硝酸酸化的BaCl2溶液,溶液中产生白色沉淀 | 原溶液中一定含有SO42﹣ |
C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
D | 向含酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-11-27更新
|
370次组卷
|
2卷引用:江西省赣州市赣县中学北校区2019-2020学年高二上学期12月月考化学试题
名校
10 . (1)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3,为了得到纯净的MgCl2·2H2O晶体,应加入___________ (填化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_______ mol·L-1。
②常温下,若将0.01 mol·L-1 MgCl2溶液与___________ mol·L-1 NaOH溶液等体积混合时有沉淀生成。
(2)已知肼(N2H4)是一种清洁高效的火箭燃料,0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。该反应的热化学方程式:___________ 。
(3)燃料电池是一种高效低污染的新型电池,肼(N2H4)-空气燃料电池是一种碱性燃料电池,其工作原理如图所示:

①写出电池中通入电池中通入N2H4的一极的电极的反应:___________ 。
②电池工作时,正极附近的pH___________ (填“增大”或者“不变”或者“减小”)。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3,为了得到纯净的MgCl2·2H2O晶体,应加入
②常温下,若将0.01 mol·L-1 MgCl2溶液与
(2)已知肼(N2H4)是一种清洁高效的火箭燃料,0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。该反应的热化学方程式:
(3)燃料电池是一种高效低污染的新型电池,肼(N2H4)-空气燃料电池是一种碱性燃料电池,其工作原理如图所示:

①写出电池中通入电池中通入N2H4的一极的电极的反应:
②电池工作时,正极附近的pH
您最近一年使用:0次
2021-01-09更新
|
133次组卷
|
2卷引用:江西省吉安县立中学2020-2021学年高二上学期期中考试化学试题



