解题方法
1 . 七水硫酸镁(MgSO4·7H2O)可用于印染加重剂,制造瓷器、颜料和防火材料。在医药上用作泻剂,在微生物工业作培养基成分等。可利用化工厂生产硼砂的废渣——硼镁泥制取七水硫酸镁(MgSO4·7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、Na2B4O7、SiO2、Fe2O3、CaO、Al2O3、MnO等)。
硼镁泥制取七水硫酸镁的工艺流程图如下:

表l:部分阳离子开好成淀和完全沉淀时溶液的pH
据此试回答下列问题:
(1)写出生成H3BO3的离子方程式______________ 。
(2)NaClO具有强氧化性,能直接将溶液中Fe2+和Mn2+分别氧化成______ (填化学式)。
(3)能否直接控制pH除去Mn2+______ ,理由__________ 。
(4)若检验时溶液呈红色,说明滤液B中还含有_______ 未除尽(填离子符号),应补加_______ 再煮沸趁热过滤(填化学式)。
(5)沉淀D的化学式_______________ 。
硼镁泥制取七水硫酸镁的工艺流程图如下:

表l:部分阳离子开好成淀和完全沉淀时溶液的pH
| Fe3+ | Fe2+ | Mn2+ | Mg2+ | Al3+ | |
| 开始沉淀的pH | 1.9 | 7.9 | 8.6 | 9.6 | 3.1 |
| 完全沉淀的pH | 3.2 | 9.0 | 10.l | 11 | 5.4 |
(1)写出生成H3BO3的离子方程式
(2)NaClO具有强氧化性,能直接将溶液中Fe2+和Mn2+分别氧化成
(3)能否直接控制pH除去Mn2+
(4)若检验时溶液呈红色,说明滤液B中还含有
(5)沉淀D的化学式
您最近一年使用:0次
2 . 【选修2:化学与技术】
地球的海水问题约有1.4×1018t,是人类最大的资源库。
(1)如下图1利用海水得到淡水的方法是____________ ;
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图2所示.a是电源的_________ 极;Ⅰ口排出的是__________ (填“淡水”或“浓水”).
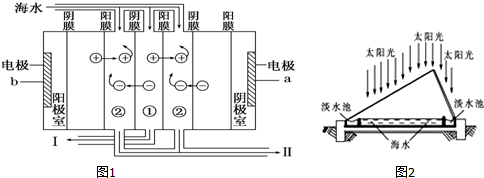
(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和 ),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是
),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是_____________ ;
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大.不少国家正在探索海水提铀的方法.现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素.其反应原理为______________ (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为_________________ ;
(5)离子交换树脂法是制备纯水(去离子水)的主要方法.某阳离子交换树酯的局部结构可写成(如图).该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经_____ 反应得到的.自来水与该离子交换树脂交换作用后显_________ (填“酸性”、“碱性”或“中性”).

(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大.如果硬度过大,饮用后对人体健康与日常生活有一定影响.暂时硬水的硬度是由__________ (填阴离子符号)引起的,经___________ (填操作名称)后可被去掉.永久硬水的硬度可由离子交换法去掉。
地球的海水问题约有1.4×1018t,是人类最大的资源库。
(1)如下图1利用海水得到淡水的方法是
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图2所示.a是电源的

(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和
 ),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是
),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大.不少国家正在探索海水提铀的方法.现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素.其反应原理为
(5)离子交换树脂法是制备纯水(去离子水)的主要方法.某阳离子交换树酯的局部结构可写成(如图).该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经

(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大.如果硬度过大,饮用后对人体健康与日常生活有一定影响.暂时硬水的硬度是由
您最近一年使用:0次
3 . 根据实验操作、现象得到的结论正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向某无色溶液中滴加稀硫酸 | 产生的气体能使品红溶液褪色,加热后溶液又恢复红色 | 原溶液中必含 或 或 |
| B | 将甲醇和过量酸性高锰酸钾溶液混合 | 紫红色褪去或变浅 | 甲醇被氧化成甲酸 |
| C | 向双氧水中滴加FeCl2溶液 | 起始没有气泡,一段时间后产生大量气泡 | 可能是Fe3+催化了H2O2的分解 |
| D | 向2mL0.lmol·L-1的AgNO3溶液中滴加3滴相同浓度的NaCl溶液,然后再滴加3滴相同浓度的KI溶液 | 先出现白色沉淀,然后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
4 . 下列实验操作能达到相应实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 向酸性高锰酸钾溶液中滴加乙二醇,紫红色褪去 | 验证乙二醇最终被氧化成乙二酸 |
| B | 某温度下向等体积的饱和AgCl、AgI溶液中分别滴加足量 溶液,所得沉淀物质的量:n(AgCl)>n(AgI) 溶液,所得沉淀物质的量:n(AgCl)>n(AgI) | 验证该温度下:Ksp(AgCl)>Ksp(AgI) |
| C | 将50mL0.55mol/L的NaOH溶液缓慢倒入盛有50mL0.50mol/L的HCl溶液的烧杯中 | 测定中和热 |
| D | 苯和溴水中加入铁粉,将产生的气体先通入 ,再通入 ,再通入 溶液 溶液 | 探究苯和溴的反应是取代反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 锌是一种应用广泛的金属。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为______ 。
(2)滤渣1的主要成分除SiO2外还有______ 。
(3)氧化除杂工序中通入氧气的作用是______ ,ZnO的作用是______ 。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为______ 。能否省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+______ 。
(5)改逬的锌冶炼工艺,采用了“氧压酸浸”(即酸性条件下充入高压的氧气)的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,“氧压酸浸”中发生的主要反应的离子方程式为______ 。

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为
(2)滤渣1的主要成分除SiO2外还有
(3)氧化除杂工序中通入氧气的作用是
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为
(5)改逬的锌冶炼工艺,采用了“氧压酸浸”(即酸性条件下充入高压的氧气)的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,“氧压酸浸”中发生的主要反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 下列实验现象与结论不一致的是
| 实验操作(或设计) | 实验现象 | 结论 | |
| A | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | 酸性:HB > HA |
| B | 以镁、铝、氢氧化钠溶液构成原电池 | 镁表面有气泡 | 镁作原电池的负极 |
| C | 相同温度下,等质量的大理石与等体积等浓度的盐酸反应 | 粉状大理石产生气泡更快 | 反应速率: 粉状大理石>块状大理石 |
| D | 向盛有10滴0.1 mol·L-1AgNO3溶液的试管中滴加0.1 mol·L-1NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol·L-1NaI溶液 | 先有白色沉淀,后转成黄色沉淀 | Ksp(AgCl )> Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2015-08-27更新
|
349次组卷
|
4卷引用:2016届江西省赣中南五校高三下学期第二次段考化学试卷
2011·江苏南通·一模
名校
解题方法
7 . 以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如表。
表1.几种砷酸盐的Ksp
表2.工厂污染物排放浓度及允许排放标准
回答下列问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=________ mol·L-1。
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:
Ksp[Ca3(AsO4)2]=________ ,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4 mol·L-1,c(AsO43-)最大是______ mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3为弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4为弱酸),写出该反应的离子方程式:_______________________ 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为__________ ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为_______________________ 。
表1.几种砷酸盐的Ksp
| 难溶物 | Ksp | |
| Ca3(AsO4)2 | 6.8×10-19 | |
| AlAsO4 | 1.6×10-16 | |
| FeAsO4 | 5.7×10-21 | |
表2.工厂污染物排放浓度及允许排放标准
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g·L-1 | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
回答下列问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:
Ksp[Ca3(AsO4)2]=
(3)工厂排放出的酸性废水中的三价砷(H3AsO3为弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4为弱酸),写出该反应的离子方程式:
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为
您最近一年使用:0次
2019-12-03更新
|
183次组卷
|
7卷引用:江西赣州市2022~2023学年高二上学期期末考试化学试题
江西赣州市2022~2023学年高二上学期期末考试化学试题(已下线)2011届江苏省南通市高三第一次调研测试化学试卷(已下线)2012届江苏省阜宁、大丰、栟茶高级中学高三第二次调研联考化学试卷(已下线)2013届江苏省泗阳致远中学高三实验班第一次模拟考试化学试卷(已下线)专题8.4 难溶电解质的溶解平衡(练)-《2020年高考一轮复习讲练测》安徽省太和第一中学2020-2021学年高二上学期期中考试化学(普通班)试题河南省中原名校2021-2022学年高二上学期期末联考化学试题
2013·江苏·一模
解题方法
8 . 利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
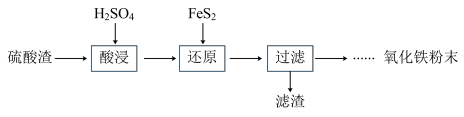
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②____________ 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_____________________________________________________________ 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++
Sn2++4Cl-+2HgCl2= +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++ +14H+=6Fe3++2Cr3++7H2O
+14H+=6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量___________ (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量_______________ 。
(4)①可选用_____________ (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是__________ (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:______________________________ ;
b.沉淀:_______________________________ ;
c.分离,洗涤;
d.烘干,研磨。

(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为
 ,该反应的离子方程式为
,该反应的离子方程式为(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++

Sn2++4Cl-+2HgCl2=
 +Hg2Cl2↓
+Hg2Cl2↓6Fe2++
 +14H+=6Fe3++2Cr3++7H2O
+14H+=6Fe3++2Cr3++7H2O①若SnCl2不足量,则测定的Fe3+量
②若不加HgCl2,则测定的Fe3+量
(4)①可选用
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:
b.沉淀:
c.分离,洗涤;
d.烘干,研磨。
您最近一年使用:0次
2016-12-09更新
|
460次组卷
|
7卷引用:2015届江西省景德镇市高三下学期第三次质检考试理综化学试卷
2015届江西省景德镇市高三下学期第三次质检考试理综化学试卷(已下线)2013届江苏省苏锡常镇徐连六市高三3月教学情况调研(一)化学试卷(已下线)2013-2014河南省洛阳市高三下学期统考二练理综化学试卷2015届宁夏回族自治区银川一中高三一模理综化学试卷2017届河南省郑州市二砂寄宿学校高三第一次月考理综化学试卷2017届江苏省无锡市三校联合体高三上第一次月考化学试卷内蒙古赤峰市红山区2021-2022学年高二上学期期末联考化学试题
名校
9 . 根据下列实验操作及现象,一定能推出相应结论的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某盐与盐酸反应产生的气体通入澄清石灰水中 | 澄清石灰水先变浑浊,一段时间后变澄清 | 该盐为碳酸盐 |
| B | 向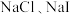 的混合稀溶液中滴入少量稀 的混合稀溶液中滴入少量稀 溶液 溶液 | 有黄色沉淀生成 | 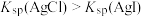 |
| C | 将氧气通入氢硫酸溶液中 | 溶液变浑浊 | 非金属性: |
| D | 将 加入 加入 溶液中 溶液中 | 有无色气泡产生 |  具有氧化性 具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



