名校
解题方法
1 . 室温时,下列各溶液的叙述中正确的是
A.CO2通入KOH溶液,当c(H+)水电离=10-7 mol/L时存在:c(K+)=c( )+c( )+c(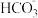 ) ) |
| B.将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀 |
| C.0.1 mol/L的氨水的pH=a,0.01 mol/L的氨水的pH=b,则a-1>b |
D.NaHSO3溶液中存在:c(Na+)>c(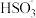 )>c(H+)>c( )>c(H+)>c( )>c(OH-) )>c(OH-) |
您最近一年使用:0次
2021-02-05更新
|
262次组卷
|
2卷引用:江西师范大学附属中学2020-2021学年高二上学期期末考试化学试题
2 . 根据下列实验操作及现象,能得出正确的结论的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A. | 向1mL2mol·L-1NaOH溶中加入2滴0.1mol·L-1MgCl2溶液,再滴加2滴0.1mol·L-1FeCl3溶液 | 先生成白色沉淀,后生成红褐色沉淀 | 证明在相同温度下,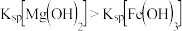 |
B. | 室温下,分别测饱和的 和 和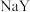 溶液的pH 溶液的pH |  和 和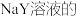 pH分别为8和9 pH分别为8和9 | 酸性: |
C. | 向2份等体积等浓度的稀硫酸中分别加入少量等物质的量的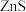 和 和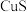 固体 固体 | 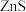 溶解而 溶解而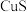 不溶解 不溶解 | 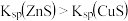 |
D. | 10mL,pH=4的HA溶液加水稀释至100mL | 稀释后溶液的pH=4.5 | HA为弱酸,该实验可 能是用pH试纸测的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-02-03更新
|
697次组卷
|
5卷引用:江西省南昌市第二中学2020-2021学年高二上学期期末考试化学试题
名校
3 . 下列实验能达到预期目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 将FeCl3饱和溶液滴加到NaOH溶液中 | 制得Fe(OH)3胶体 |
| B | 室温下,向1mL0.1mol·L-1AgNO3溶液中加入几滴0.1mol·L-1NaCl溶液出现白色沉淀,再滴加几滴0.1mol·L-1NaI溶液,出现黄色沉淀 | 证明相同温度下:Ksp(AgCl)>Ksp(AgI) |
| C | 常温下,测得相同浓度溶液的pH:NaA>NaB | 证明常温下的水解程度:A-<B- |
| D | 等体积pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多 | 证明HA是弱酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-31更新
|
255次组卷
|
5卷引用:江西省赣州市2020-2021学年高二上学期期末考试化学试题
4 . 下列化学用语对事实的表述错误的是
| A.Na2S做沉淀剂可处理含Hg2+的工业污水:Hg2++S2-=HgS↓ |
| B.乙烯的燃烧热是1411.3 kJ·mol-1,则乙烯燃烧的热化学方程式为:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH=-1411.3kJ·mol-1 |
| C.P(s,白磷)=P(s,红磷) ΔH=-17.6kJ·mol-1由此推知,红磷比白磷更稳定 |
| D.闪锌矿(ZnS)经CuSO4溶液作用转化为铜蓝(Cus):ZnS(s)+Cu2+(aq)⇌CuS(s)+Zn2+(aq) |
您最近一年使用:0次
5 . I.通过计算回答下列有关沉淀溶解平衡的问题。
向50mL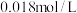 的
的 溶液中加入50mL
溶液中加入50mL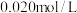 的
的 溶液,生成沉淀。已知该温度下
溶液,生成沉淀。已知该温度下 的
的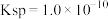 ,忽略溶液混合的体积变化,已知
,忽略溶液混合的体积变化,已知 ,请回答:
,请回答:
(1)两溶液充分混合后溶液的
_______ 。
(2)完全沉淀后,溶液中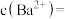
_______ 。
Ⅱ.亚氯酸钠( )常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
)常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol/L 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液的平均值为VmL。(已知:杂质不参与反应,
标准溶液的平均值为VmL。(已知:杂质不参与反应,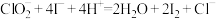 、
、 )
)
(1)达到滴定终点时的现象为_______ 。
(2)下列滴定过程中测量结果偏高的是( )
A.滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失
B.滴定管用蒸馏水洗净后没有用标准液润洗
C.滴定前仰视滴定管刻度,滴定后俯视滴定管刻度
D.锥形瓶用蒸馏水洗净后未干燥
(3)该样品中 的质量分数为
的质量分数为_______ (用含m、c、V的代数式表示)。
向50mL
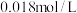 的
的 溶液中加入50mL
溶液中加入50mL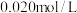 的
的 溶液,生成沉淀。已知该温度下
溶液,生成沉淀。已知该温度下 的
的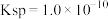 ,忽略溶液混合的体积变化,已知
,忽略溶液混合的体积变化,已知 ,请回答:
,请回答:(1)两溶液充分混合后溶液的

(2)完全沉淀后,溶液中
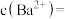
Ⅱ.亚氯酸钠(
 )常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
)常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol/L
 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液的平均值为VmL。(已知:杂质不参与反应,
标准溶液的平均值为VmL。(已知:杂质不参与反应,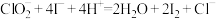 、
、 )
)(1)达到滴定终点时的现象为
(2)下列滴定过程中测量结果偏高的是
A.滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失
B.滴定管用蒸馏水洗净后没有用标准液润洗
C.滴定前仰视滴定管刻度,滴定后俯视滴定管刻度
D.锥形瓶用蒸馏水洗净后未干燥
(3)该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
6 . 下列说法中,正确的是
| A.难溶电解质达到沉淀溶解平衡时,保持温度不变增加难溶电解质的量,平衡向溶解方向移动 |
| B.难溶电解质都是弱电解质 |
C.在白色ZnS沉淀上滴加 溶液,沉淀变黑,说明CuS比ZnS更难溶于水 溶液,沉淀变黑,说明CuS比ZnS更难溶于水 |
| D.AgCl在水中的溶解度与在饱和NaCl溶液中的溶解度相同 |
您最近一年使用:0次
2021-01-28更新
|
808次组卷
|
8卷引用:江西省吉安市2020-2021学年高二上学期期末教学质量检测化学试题
江西省吉安市2020-2021学年高二上学期期末教学质量检测化学试题(已下线)作业10 沉淀溶解平衡-2021年高二化学暑假作业(人教版2019)课前-3.4.2 沉淀溶解平衡的应用-课前、课中、课后(人教版2019选择性必修1)(已下线)3.4.1 难溶电解质的沉淀溶解平衡(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)新疆昌吉州行知学校2021-2022学年高二上学期期末考试化学试题3.4.2沉淀溶解平衡原理的应用 课后吉林省普通高中友好学校联合体2023-2024学年高二上学期期中联考化学试题3.4.1难溶电解质的沉淀溶解平衡课后作业—基础篇
解题方法
7 . 回答下列问题:
(1)对同一个反应,化学平衡常数K的大小能说明_______ ,K越大,_______ 越大;弱酸、弱碱的电离平衡常数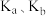 能够反映
能够反映_______ ;难溶电解质的溶度积常数 的大小反映了
的大小反映了_______ ,升高温度时,
_______ (填“增大”、“减小”或“无法判断”)。
(2)向 溶液中加入镁粉,有气泡产生,请用离子方程式和必要文字解释其现象:
溶液中加入镁粉,有气泡产生,请用离子方程式和必要文字解释其现象:_______ 。
(3)常温时,向浓度均为 的
的 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液,先生成的沉淀的颜色为
溶液,先生成的沉淀的颜色为_______ ,生成该沉淀的离子方程式为_______ 。{已知常温时,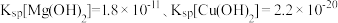 ﹜
﹜
(4)常温时,向浓度为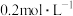 的
的 溶液中滴加同浓度的
溶液中滴加同浓度的 溶液,当恰好沉淀完全时,溶液的
溶液,当恰好沉淀完全时,溶液的
_______ 。(忽略溶液混合引起的体积变化)
(1)对同一个反应,化学平衡常数K的大小能说明
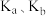 能够反映
能够反映 的大小反映了
的大小反映了
(2)向
 溶液中加入镁粉,有气泡产生,请用离子方程式和必要文字解释其现象:
溶液中加入镁粉,有气泡产生,请用离子方程式和必要文字解释其现象:(3)常温时,向浓度均为
 的
的 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液,先生成的沉淀的颜色为
溶液,先生成的沉淀的颜色为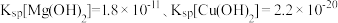 ﹜
﹜(4)常温时,向浓度为
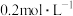 的
的 溶液中滴加同浓度的
溶液中滴加同浓度的 溶液,当恰好沉淀完全时,溶液的
溶液,当恰好沉淀完全时,溶液的
您最近一年使用:0次
2021-01-27更新
|
49次组卷
|
2卷引用:江西省抚州市2020-2021学年高二上学期学生学业水平测试化学试题
8 . 已知一定温度下: ,下列叙述正确的是
,下列叙述正确的是
 ,下列叙述正确的是
,下列叙述正确的是A.AgCl在饱和NaCl溶液中的 比在纯水中的小 比在纯水中的小 |
B.AgCl悬浊液中: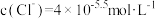 |
C.将 溶液滴入等体积 溶液滴入等体积 的KCl溶液中,最终无沉淀析出 的KCl溶液中,最终无沉淀析出 |
D.向AgCl悬浊液中加入NaBr溶液白色沉淀转化为淡黄色,说明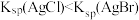 |
您最近一年使用:0次
2021-01-25更新
|
323次组卷
|
15卷引用:江西省赣州市崇义县崇义中学2020-2021学年高二下学期开学考化学试题
江西省赣州市崇义县崇义中学2020-2021学年高二下学期开学考化学试题山西省太原市2020-2021学年高二上学期期末化学(理)试题吉林省吉化第一高级中学校2020-2021学年高二上学期期末考试化学试题安徽省安庆市怀宁县第二中学2021届高三上学期第五次月考化学试题2016-2017学年四川省简阳市高二上学期期末化学试卷2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷【校级联考】安徽省宿州市十三所重点中学2018-2019学年高二(理科)第一学期期末质量检测化学试题【全国百强校】安徽省黄山市屯溪第一中学2018-2019学年高二下学期入学摸底考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期期末考试化学试题安徽省合肥市庐江县2019-2020学年高二上学期期末检测化学试题安徽省安庆市怀宁县第二中学2019届高三上学期第五次月考化学试题黑龙省哈尔滨市宾县第二中学2020-2021学年高二上学期第二次月考化学试题内蒙古自治区奈曼旗第一中学2020-2021学年高二上学期期中考试化学试题河北省任丘市第一中学2020-2021学年高二上学期第二次阶段考试化学试题吉林省吉化第一高级中学校2020-2021学年高二上学期11月月考化学试题
名校
9 . 下列事实描述正确,且不能用勒夏特列原理解释的是
| A.FeS难溶于水,但能溶于稀盐酸中 |
B.闪锌矿(ZnS)经 溶液作用转变为铜蓝 溶液作用转变为铜蓝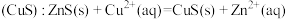 |
C.配制 溶液时,可加入少量还原铁粉 溶液时,可加入少量还原铁粉 |
D.向浓度均为 的 的 、 、 混合溶液中滴加少量稀NaOH溶液,一定出现白色沉淀 混合溶液中滴加少量稀NaOH溶液,一定出现白色沉淀 |
您最近一年使用:0次
2021-01-25更新
|
182次组卷
|
4卷引用:江西省井冈山大学附属中学2021-2022学年高二上学期开学考试化学(理科)试题
名校
解题方法
10 . 下列解释事实的方程式正确的是
| A.钢铁发生吸氧腐蚀时,铁做负极被氧化:Fe-3e-=Fe3+ |
B.Na2CO3溶液显碱性:CO +2H2O +2H2O H2CO3+2OH- H2CO3+2OH- |
C.AgCl悬浊液中存在溶解平衡:AgCl Ag++Cl- Ag++Cl- |
| D.向Mg(OH)2悬浊液中滴加FeCl3溶液,生成Fe(OH)3:3Mg(OH)2+2Fe3+=2Fe(OH)3↓+3Mg2+ |
您最近一年使用:0次



