名校
1 . 根据下列各图曲线表征的信息,得出的结论不正确的是
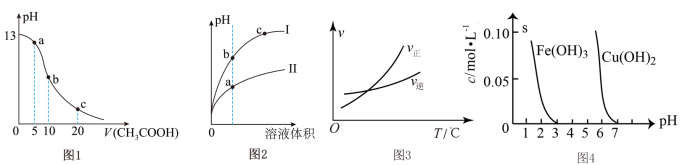

| A.图1表示常温下向体积为10 mL 0.1 mol·L−1NaOH溶液中逐滴加入0.1 mol·L−1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH−) |
| B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
C.图3可判断可逆反应A(g)+3B(g)  2C(g)的∆H>0 2C(g)的∆H>0 |
| D.由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 |
您最近一年使用:0次
解题方法
2 . 下列实验操作能达到相应实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 向酸性高锰酸钾溶液中滴加乙二醇,紫红色褪去 | 验证乙二醇最终被氧化成乙二酸 |
| B | 某温度下向等体积的饱和AgCl、AgI溶液中分别滴加足量 溶液,所得沉淀物质的量:n(AgCl)>n(AgI) 溶液,所得沉淀物质的量:n(AgCl)>n(AgI) | 验证该温度下:Ksp(AgCl)>Ksp(AgI) |
| C | 将50mL0.55mol/L的NaOH溶液缓慢倒入盛有50mL0.50mol/L的HCl溶液的烧杯中 | 测定中和热 |
| D | 苯和溴水中加入铁粉,将产生的气体先通入 ,再通入 ,再通入 溶液 溶液 | 探究苯和溴的反应是取代反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 已知25℃时, 的平衡常数
的平衡常数 ,
, ,下列叙述中正确的是
,下列叙述中正确的是
 的平衡常数
的平衡常数 ,
,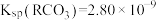 ,下列叙述中正确的是
,下列叙述中正确的是A.25℃时,RSO4的Ksp的为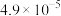 |
B.将浓度均为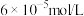 的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀 的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀 |
C.向c( )=c( )=c( )的混合液中滴加RCl2溶液,首先析出RSO4沉淀 )的混合液中滴加RCl2溶液,首先析出RSO4沉淀 |
| D.相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp |
您最近一年使用:0次
2021-11-16更新
|
1011次组卷
|
16卷引用:江西省赣州市赣县第三中学2021-2022学年高二上学期12月月考化学试卷
江西省赣州市赣县第三中学2021-2022学年高二上学期12月月考化学试卷江西省新余市第一中学2019-2020学年高二上学期第二次段考试化学试题辽宁省辽东南协作体2021-2022学年高二上学期期中考试化学试题河北省唐山市第一中学2021-2022学年高二上学期12月月考化学试题(已下线)3.4.2 沉淀溶解平衡的应用(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)【全国百强校】湖南省长沙市长郡中学2018届高三高考押题卷(二)理综化学试题(已下线)《考前20天终极攻略》-5月23日 溶液中的离子平衡辽宁省普兰店市第一中学2018-2019学年高二(理)上学期期中考试化学试题(已下线)专题8.4 难溶电解质的溶解平衡(练)-《2020年高考一轮复习讲练测》高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时1 溶解平衡及其应用(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)3.4 难溶电解质的溶解平衡(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)3.4.1 沉淀溶解平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)作业(二十) 沉淀溶解平衡与溶度积湖南省长沙市第一中学2023-2024学年高二下学期入学考试化学试题
名校
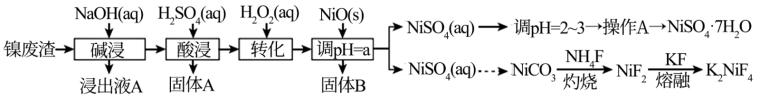
4 . “翠矾”(NiSO4·7H2O)在印染工业作媒染剂,生产酞菁艳蓝络合剂;氟镍化钾(K2NiF4)是结构化学研究的热点物质。以镍废渣(主要成分为Ni,含少量Fe、Al、Fe3O4、Al2O3和不溶性杂质等)为原料合成“翠矾”和氟镍化钾的流程如下:
几种金属离子的氢氧化物沉淀pH如表:
请回答下列问题:
(1)“碱浸”过程中,为提高浸出率,可采取的措施是___________ (写一种即可)。
(2)“转化”过程中加入H2O2的目的是___________ (用离子方程式表示),经实验测定该过程温度高于40℃,转化率急速降低的原因可能是______________________ 。
(3)调节pH=a,其中a的取值范围是___________ 。
(4)写出“灼烧”NiCO3和NH4F的混合物时的化学反应方程式:___________ ,为避免污染环境,选择下列装置吸收尾气,最宜选择___________ (填选项)。
A.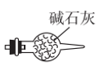 B.
B.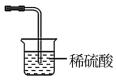
C.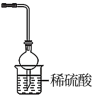 D.
D.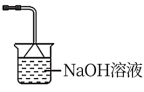

几种金属离子的氢氧化物沉淀pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 5.2 |
| Fe2+ | 7.6 | 9.7 |
| Ni2+ | 7.1 | 9.2 |
(1)“碱浸”过程中,为提高浸出率,可采取的措施是
(2)“转化”过程中加入H2O2的目的是
(3)调节pH=a,其中a的取值范围是
(4)写出“灼烧”NiCO3和NH4F的混合物时的化学反应方程式:
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
2021-11-05更新
|
97次组卷
|
3卷引用:江西省赣州市赣县第三中学2021-2022学年高三上学期10月月考化学试题
名校
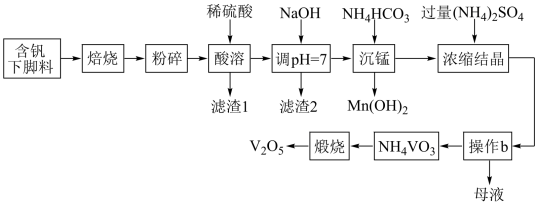
5 . V2O5是硫酸生产中的催化剂,某种含钒工业下脚料主要成分是V2O3,其中含铝、硅、铜、锰等氧化物及油脂等杂质,一种以该下脚料为原料提取V2O5的工艺流程如下:
已知:i.V2O5+2H+=2VO +H2O;VO
+H2O;VO +H2O⇌VO
+H2O⇌VO +2H+。
+2H+。
ii.常温时,有关氢氧化物的溶度积常数如下表:
回答下列问题:
(1)“焙烧”可以除去油脂,还有一个作用是_______ 。
(2)将焙烧冷却后的固体残留物进行“粉碎”,其目的是_______ 。
(3)“滤渣1”的主要成分是_______ (写化学式),“调pH=7”,析出沉淀后,滤液中c(Cu2+):c(Al3+)=_______ 。
(4)“沉锰”反应的离子方程式是_______ 。
(5)“浓缩结晶”时,需要加入过量(NH4)2SO4,其原因是_______ 。
(6)利用制得的V2O5可通过电解的方法制备金属钒,电解装置如图:
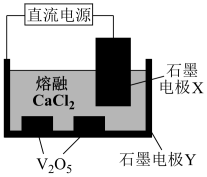
石墨电极Y接直流电源_______ (填“正极”或“负极”),阴极反应式是_______ 。

已知:i.V2O5+2H+=2VO
 +H2O;VO
+H2O;VO +H2O⇌VO
+H2O⇌VO +2H+。
+2H+。ii.常温时,有关氢氧化物的溶度积常数如下表:
| 氢氧化物 | Mn(OH)2 | Cu(OH)2 | Al(OH)3 |
| Ksp | 4.00×10-14 | 2.20×10-20 | 1.90×10-33 |
回答下列问题:
(1)“焙烧”可以除去油脂,还有一个作用是
(2)将焙烧冷却后的固体残留物进行“粉碎”,其目的是
(3)“滤渣1”的主要成分是
(4)“沉锰”反应的离子方程式是
(5)“浓缩结晶”时,需要加入过量(NH4)2SO4,其原因是
(6)利用制得的V2O5可通过电解的方法制备金属钒,电解装置如图:

石墨电极Y接直流电源
您最近一年使用:0次
2018高三上·全国·专题练习
名校
6 . 下表是Fe2+、Fe3+、Zn2+被OH-完全沉淀时溶液的pH。某硫酸锌酸性溶液中含有少量Fe2+、Fe3+杂质,为制得纯净的ZnSO4,应加入的试剂是
| 金属离子 | Fe2+ | Fe3+ | Zn2+ |
| 完全沉淀时的pH | 7.7 | 4.5 | 6.5 |
| A.H2O2、ZnO | B.氨水 |
| C.KMnO4、ZnCO3 | D.NaOH溶液 |
您最近一年使用:0次
2021-10-28更新
|
1061次组卷
|
28卷引用:江西省鹰潭市第一中学2021-2022学年高二上学期创新班10月月考化学试题
江西省鹰潭市第一中学2021-2022学年高二上学期创新班10月月考化学试题选择性必修1 专题3素养检测(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时42 盐类的水解影响因素及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题(已下线)第5讲 沉淀溶解平衡-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)河北省邯郸市永年区第二中学2021-2022学年高二12月月考化学试题黑龙江省哈尔滨市宾县第一中学校2021-2022学年高二上学期第二次月考化学试题辽宁省沈阳市第十中学2021-2022学年高二上学期第一次月考化学试题(已下线)2018年10月12日 《每日一题》一轮复习-盐类水解的应用陕西省西安中学2019-2020学年高二上学期期末考试化学试题(已下线)第02讲 物质的分离和提纯(精练)——2021年高考化学一轮复习讲练测鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡(已下线)第27讲 盐类水解(精讲)——2021年高考化学一轮复习讲练测黑龙江省哈尔滨市宾县第一中学2020-2021学年高二上学期第三次月考化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题黑龙江省黑河市五校(嫩江市第一中学,嫩江市职业高中,黑河七中,伊拉哈中学,海江中学)2021-2022学年高二上学期期末联考化学试题(已下线)第23讲 盐类水解 (练)-2023年高考化学一轮复习讲练测(新教材新高考)宁夏贺兰县景博中学2022-2023学年高二上学期第二次月考化学试题北京市清华大学附属中学2022-2023学年高二上学期期末化学试题辽宁省营口市大石桥市第三高级中学等2校2022-2023学年高二上学期期末考试化学试题上海市嘉定区第二中学2022-2023学年高二下学期第一次质量检测化学试题(已下线)第13讲 盐类的水解-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)辽宁省营口市2022-2023学年高二上学期期末考试化学试题广东省江门市2023-2024学年高二上学期1月期末考试化学试题北京市第九中学2023-2024学年高二下学期2月开学考化学试题黑龙江省海林市朝鲜族中学2023-2024学年高二上学期第三次考试(期末)化学试卷
名校
解题方法
7 . 按要求填写对应的方程式。
(1)泡沫灭火器的反应的离子方程式:___________
(2)铅蓄电池放电时正极的电极方程式:___________
(3)向AgCl悬浊液中滴加Na2S溶液的的离子方程式:___________
(4)电解精炼铜时阴极的电极方程式:___________
(1)泡沫灭火器的反应的离子方程式:
(2)铅蓄电池放电时正极的电极方程式:
(3)向AgCl悬浊液中滴加Na2S溶液的的离子方程式:
(4)电解精炼铜时阴极的电极方程式:
您最近一年使用:0次
8 . 氢氧化锌的性质和氢氧化铝相似,25℃时,测得溶液中Zn2+、[Zn(OH)4]2-物质的量浓度的对数与溶液pH关系如图所示(已知Ksp[Mg(OH)2]=1.1×10-11,Ksp[Cu(OH)2]=2.2×10-20)。下列说法正确的是


| A.25℃时,Ksp[Zn(OH)2]的数量级为10-17 |
| B.分离Mg2+和Zn2+,要控制pH在8~11之间 |
| C.可以用硫酸锌和氢氧化钠溶液反应制备氢氧化锌 |
| D.加入CuO可以除去硫酸铜溶液中的Zn2+ |
您最近一年使用:0次
2021高三·山东·专题练习
名校
解题方法
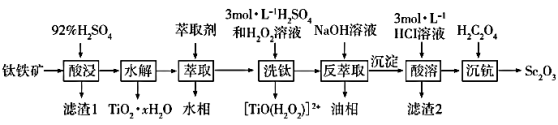
9 . 氧化钪(Sc2O3)是一种稀土氧化物,广泛地应用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为TiO2、FeO、Fe2O3,还含有Mg、Si、Sc等元素,从钛铁矿中提取Sc2O3的流程如图:
已知:①当离子浓度减小至10-5 mol·L-1时可认为沉淀完全。
②室温下TiO2+完全沉淀的pH为1.05
③Ksp[Fe(OH)3]=4.0×10-38,Ksp[Sc(OH)3]=1.25×10-33,lg2=0.3。
回答下列问题:
(1)“酸浸”时,要适当升高温度或将钛铁矿粉碎等措施,其目的是___________ 。
(2)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是
___________ 。
(3)“洗钛”时H2O2的作用之一是与TiO2+反应生成[TiO(H2O2)]2+,该离子为橘黄色的稳定离子,Ti的化合价为___________ ,H2O2还起到的作用是___________ 。
(4)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01 mol·L-1,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的范围是___________ 。
(5)加草酸“沉钪”的离子方程式为___________ ,获得Sc2O3的实验操作方法是___________ 。

已知:①当离子浓度减小至10-5 mol·L-1时可认为沉淀完全。
②室温下TiO2+完全沉淀的pH为1.05
③Ksp[Fe(OH)3]=4.0×10-38,Ksp[Sc(OH)3]=1.25×10-33,lg2=0.3。
回答下列问题:
(1)“酸浸”时,要适当升高温度或将钛铁矿粉碎等措施,其目的是
(2)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是

(3)“洗钛”时H2O2的作用之一是与TiO2+反应生成[TiO(H2O2)]2+,该离子为橘黄色的稳定离子,Ti的化合价为
(4)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01 mol·L-1,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的范围是
(5)加草酸“沉钪”的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . 对电镀污泥(含Cu,Ca,Ni,Fe的氢氧化物)进行无害化和资源化处理,从其中回收金属、并制备硫酸镍的工艺流程如下图所示:
已知:氯酸不稳定,易发生歧化反应,可生成 气体。
气体。
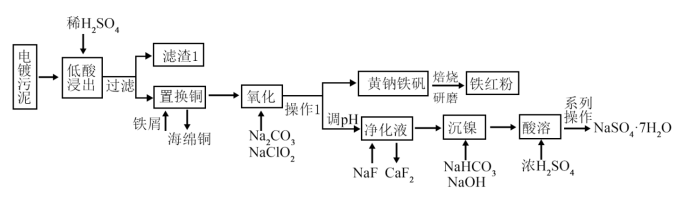
(1)“低酸浸出”工序提高浸出率的措施为___________ (只写一条即可),实验室配制500mL 1.84mol/L该低酸溶液应量取质量分数为98%,密度为 的浓硫酸
的浓硫酸___________ mL。
(2)“氧化”工序中被氧化的元素为___________ (填元素符号),“氧化”工序中加入试剂 调pH的原因为
调pH的原因为___________ (结合离子方程式解释原因),写出氧化工序生成黄钠铁矾 的离子方程式
的离子方程式___________ 。
(3)控制净化液的pH不能过低,否则会导致 沉淀不完全,原因为
沉淀不完全,原因为___________ [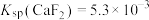 ,
,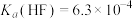 ]。
]。
(4)酸溶后的“系列操作”为___________ ,过滤、洗涤、干燥,该结晶工序得到的废液可以返回___________ 工序循环利用。
已知:氯酸不稳定,易发生歧化反应,可生成
 气体。
气体。
(1)“低酸浸出”工序提高浸出率的措施为
 的浓硫酸
的浓硫酸(2)“氧化”工序中被氧化的元素为
 调pH的原因为
调pH的原因为 的离子方程式
的离子方程式(3)控制净化液的pH不能过低,否则会导致
 沉淀不完全,原因为
沉淀不完全,原因为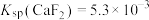 ,
,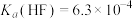 ]。
]。(4)酸溶后的“系列操作”为
您最近一年使用:0次
2021-10-17更新
|
41次组卷
|
2卷引用:江西省抚州市临川区第十中学2022届高三月考化学试卷



