名校
解题方法
1 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: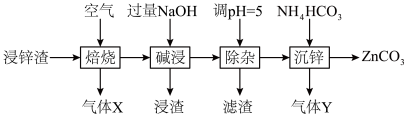
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):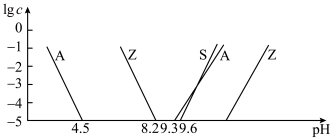
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
2024-04-21更新
|
215次组卷
|
2卷引用:2024届四川省射洪中学校高三下学期二模理综试题-高中化学
解题方法
2 . 工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示: 其余为
其余为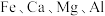 等元素。
等元素。
②部分阳离子沉淀时溶液的 :
:
③“焙烧”过程中主要反应为 。
。
(1)结合图1、2、3,分析“焙烧”过程中最佳的焙烧温度、焙烧时间、 分别为
分别为___________ 、___________ 、___________ 。 ,作用是
,作用是___________ ,再调节溶液 的范围为
的范围为___________ ,将 和
和 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入 将
将 变为氟化物沉淀除去。
变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为___________ 。
(4)上述流程中可循环使用的物质是___________ (填化学式)。
(5)现用滴定法测定产品中锰的含量。实验步骤:称取 试样,向其中加入稍过量的磷酸和硝酸,加热使产品中
试样,向其中加入稍过量的磷酸和硝酸,加热使产品中 完全转化为
完全转化为 (其中
(其中 转化为
转化为 );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应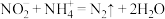 以除去
以除去 ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用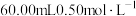 硫酸亚铁铵标准溶液进行滴定,发生的反应为
硫酸亚铁铵标准溶液进行滴定,发生的反应为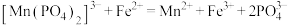 ;用
;用 酸性
酸性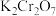 溶液恰好除去过量的
溶液恰好除去过量的 。
。
①酸性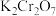 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为___________ 。
②试样中锰的质量分数为___________ 。
 其余为
其余为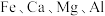 等元素。
等元素。②部分阳离子沉淀时溶液的
 :
:| 离子 |  |  |  |  |  |
开始沉淀的 | 4.1 | 2.2 | 10.6 | 8.1 | 9.1 |
沉淀完全的 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
 。
。(1)结合图1、2、3,分析“焙烧”过程中最佳的焙烧温度、焙烧时间、
 分别为
分别为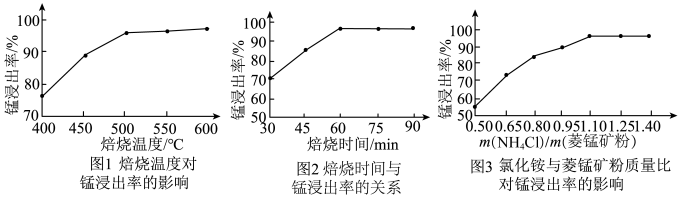
 ,作用是
,作用是 的范围为
的范围为 和
和 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入 将
将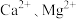 变为氟化物沉淀除去。
变为氟化物沉淀除去。(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为
(4)上述流程中可循环使用的物质是
(5)现用滴定法测定产品中锰的含量。实验步骤:称取
 试样,向其中加入稍过量的磷酸和硝酸,加热使产品中
试样,向其中加入稍过量的磷酸和硝酸,加热使产品中 完全转化为
完全转化为 (其中
(其中 转化为
转化为 );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应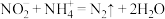 以除去
以除去 ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用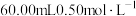 硫酸亚铁铵标准溶液进行滴定,发生的反应为
硫酸亚铁铵标准溶液进行滴定,发生的反应为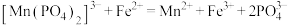 ;用
;用 酸性
酸性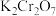 溶液恰好除去过量的
溶液恰好除去过量的 。
。①酸性
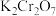 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为②试样中锰的质量分数为
您最近一年使用:0次
2024-04-15更新
|
85次组卷
|
2卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
解题方法
3 . 火法炼铜中产生的白烟尘常含ZnO、 、CuO、CdO、
、CuO、CdO、 、PdO等,其中Cu、Zn、Pb、Cd等是潜在的金属资源,As有潜在环境威胁,可综合利用变废为宝,流程如下:
、PdO等,其中Cu、Zn、Pb、Cd等是潜在的金属资源,As有潜在环境威胁,可综合利用变废为宝,流程如下:

(1)溶解度:

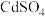 (填“>”“<”或“=”)。在浸出液中,砷元素主要以
(填“>”“<”或“=”)。在浸出液中,砷元素主要以 的形式存在,写出“酸浸”生成
的形式存在,写出“酸浸”生成 的化学方程式
的化学方程式(2)表1和表2是在其他条件一定时,铁铜摩尔置换比[
 ]、温度分别对铜的置换率和品位(矿石中所含某种金属或有用成分的多少)的影响,浸出液置换铜的最佳
]、温度分别对铜的置换率和品位(矿石中所含某种金属或有用成分的多少)的影响,浸出液置换铜的最佳 比值是
比值是表1  对铜置换率和品味的影响
对铜置换率和品味的影响
| 置换率/% | Cu品位/% |
1.2 | 74.87 | 51.22 |
1.4 | 92.17 | 72.82 |
1.6 | 99.92 | 72.08 |
表2温度对铜置换率和品味的影响
温度/℃ | 置换率/% | Cu品位/% |
30 | 99.92 | 72.08 |
60 | 99.93 | 70.34 |
80 | 99.86 | 69.98 |
(3)随着pH增大,沉砷率将
(4)金属活动性顺序为Zn>Cd>Cu,“电解”主要回收到的金属中,首先析出的是
您最近一年使用:0次
4 . 常温下,向 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液, 与
与 的关系如图所示。知:
的关系如图所示。知: 代表
代表 或
或 ;
; ;当被沉淀的离子的物质的量浓度小于
;当被沉淀的离子的物质的量浓度小于 时,认为该离子已沉淀完全。下列叙述错误的是
时,认为该离子已沉淀完全。下列叙述错误的是
 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液, 与
与 的关系如图所示。知:
的关系如图所示。知: 代表
代表 或
或 ;
; ;当被沉淀的离子的物质的量浓度小于
;当被沉淀的离子的物质的量浓度小于 时,认为该离子已沉淀完全。下列叙述错误的是
时,认为该离子已沉淀完全。下列叙述错误的是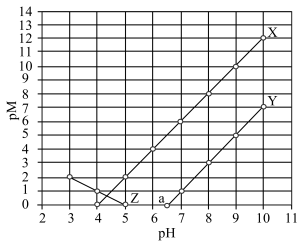
A.X、Z分别代表 与 与 的关系 的关系 |
B.常温下,弱酸 的电离常数 的电离常数 |
C.图中 点对应溶液的 点对应溶液的 为6.5,此时溶液中 为6.5,此时溶液中 |
D.向浓度均为 的 的 和 和 的混合溶液中逐滴加入 的混合溶液中逐滴加入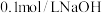 溶液,能通过沉淀的方式将两种离子分离 溶液,能通过沉淀的方式将两种离子分离 |
您最近一年使用:0次
名校
解题方法
5 . 氧化钴(Co2O3)常用作超耐热合金和磁性材料及化学工业的催化剂。一种以钴矿渣(含有Co、Fe、Ca、Mg、Mn、Ni等元素的化合物及 )制备
)制备 的工艺流程如下。
的工艺流程如下。

已知:①钴矿渣浸出后溶液中金属元素以+2价离子形式存在。
② 、
、 可溶于水。
可溶于水。
回答下列问题:
(1)“浸出”时,为了加快浸出速率,可采取的措施有___________ (任写两点);滤渣1的主要成分为___________ (填化学式)。
(2)“除铁”过程中, 参与反应的离子方程式为
参与反应的离子方程式为___________ 。
(3)“萃取”“反萃取”步骤的目的是___________ ;“煅烧”时主要反应的化学方程式为___________ 。
(4)以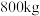 钴矿渣(Co的质量分数为12.5%)为原料提取出
钴矿渣(Co的质量分数为12.5%)为原料提取出 ,在提取过程中钴的损失率为
,在提取过程中钴的损失率为___________ (计算结果保留三位有效数字)。
 )制备
)制备 的工艺流程如下。
的工艺流程如下。
已知:①钴矿渣浸出后溶液中金属元素以+2价离子形式存在。
②
 、
、 可溶于水。
可溶于水。回答下列问题:
(1)“浸出”时,为了加快浸出速率,可采取的措施有
(2)“除铁”过程中,
 参与反应的离子方程式为
参与反应的离子方程式为(3)“萃取”“反萃取”步骤的目的是
(4)以
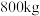 钴矿渣(Co的质量分数为12.5%)为原料提取出
钴矿渣(Co的质量分数为12.5%)为原料提取出 ,在提取过程中钴的损失率为
,在提取过程中钴的损失率为
您最近一年使用:0次
解题方法
6 . 七水合硫酸镁(MgSO4•7H2O)在印染、造纸等领域应用广泛。以化工废弃物盐泥(主要成分为MgCO3•CaCO3,含少量NaCl与含铁化合物)为原料可制取七水合硫酸镁,回答下列问题:
(1)称取干燥盐泥6.90g于100mL烧杯中,加入蒸馏水,缓慢滴加3.0mol•L-1H2SO4溶液,不断搅拌,得到酸解浆液,主要反应的化学方程式为________ ;配制3.0mol•L-1H2SO4溶液时,用到的实验仪器除烧杯、玻璃棒、量筒外,还必须使用的仪器有________ (填标号)。
A. B.
B.  C.
C.  D.
D.
(2)加热酸解浆液,在搅拌下补加盐泥,调节浆液的pH接近6,继续加热煮沸,趁热过滤,滤渣的主要成分是________ 、________ ,继续加热煮沸的目的是________ 。
(3)要证明铁元素已除尽,实验操作及现象是:________ 。
(4)向(2)所得滤液中加入6mol•L-1NaOH溶液至沉淀完全,过滤,该操作的目的是________ ,将滤渣完全溶于3.0mol•L-1H2SO4溶液,经如下实验操作:加热蒸发、________ 、过滤、洗涤、干燥,得到七水合硫酸镁。
(5)实验中制得七水合硫酸镁产品的质量为3.69g,则盐泥中MgCO3•CaCO3的含量为________ %,将产品加热至77℃,测得固体失重率为43.9%,该温度下固体的化学式为________ 。
(1)称取干燥盐泥6.90g于100mL烧杯中,加入蒸馏水,缓慢滴加3.0mol•L-1H2SO4溶液,不断搅拌,得到酸解浆液,主要反应的化学方程式为
A.
 B.
B.  C.
C.  D.
D.
(2)加热酸解浆液,在搅拌下补加盐泥,调节浆液的pH接近6,继续加热煮沸,趁热过滤,滤渣的主要成分是
(3)要证明铁元素已除尽,实验操作及现象是:
(4)向(2)所得滤液中加入6mol•L-1NaOH溶液至沉淀完全,过滤,该操作的目的是
(5)实验中制得七水合硫酸镁产品的质量为3.69g,则盐泥中MgCO3•CaCO3的含量为
您最近一年使用:0次
名校
解题方法
7 . 铟(In)是一种稀散金属,常与其他金属矿石伴生,回收氧化锌烟尘(主要成分是ZnO,还含少量PbO、FeS、FeSiO3、 In2O3、 In2S3等)中的金属铟的工艺流程如下:
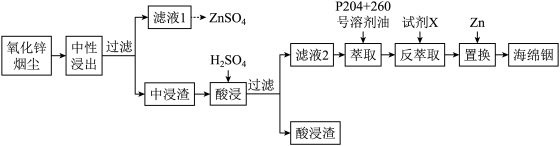
已知:室温下,金属离子开始沉淀和完全沉淀的pH如表所示。
回答下列问题:
(1)In2O3中In的化合价是_______________________ 。
(2)“中性浸出”的过程为:先加入稀硫酸和适量氧化剂MnO2氧化酸浸氧化锌烟尘,反应结束前半个小时加入CaO调整pH=5.0~5.2。
①FeSiO3与稀H2SO4反应的化学方程式为____________________________________________ 。
②氧化酸浸过程中,In2S3中的硫元素被MnO2氧化为 ,该反应的离子方程式为
,该反应的离子方程式为____________________ 。
③氧化剂用量对中性浸出效果的影响如图所示。最佳氧化剂用量为_________________ 。
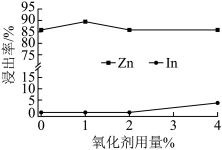
④“中浸渣”的主要成分为In(OH)3、________________ 。 (写化学式)
(3)萃取时,发生反应In3+ +3H2A2 In(HA2)3 +3H+,H2A2代表有机萃取剂。
In(HA2)3 +3H+,H2A2代表有机萃取剂。
①反萃取时,宜选用的试剂X为_____________________ (写化学式)
②实验室进行萃取和反萃取时,均需要使用的玻璃仪器有_________________________ 。
(4)“置换”后的滤液可返回________________________ (填“滤液 1”或“滤液2”)中利用。
(5)“置换”时锌粉的利用率为90%,若想获得6.9 kg海绵铟,需要使用锌粉___ _kg (结果保留1位小数)

已知:室温下,金属离子开始沉淀和完全沉淀的pH如表所示。
金属离子 | Fe3+ | Fe2+ | In3+ |
开始沉淀pH(离子浓度为0.1mol·L-1时) | 1.3 | 6 | 3 |
完全沉淀pH | 2.7 | 8 | 4.3 |
(1)In2O3中In的化合价是
(2)“中性浸出”的过程为:先加入稀硫酸和适量氧化剂MnO2氧化酸浸氧化锌烟尘,反应结束前半个小时加入CaO调整pH=5.0~5.2。
①FeSiO3与稀H2SO4反应的化学方程式为
②氧化酸浸过程中,In2S3中的硫元素被MnO2氧化为
 ,该反应的离子方程式为
,该反应的离子方程式为③氧化剂用量对中性浸出效果的影响如图所示。最佳氧化剂用量为

④“中浸渣”的主要成分为In(OH)3、
(3)萃取时,发生反应In3+ +3H2A2
 In(HA2)3 +3H+,H2A2代表有机萃取剂。
In(HA2)3 +3H+,H2A2代表有机萃取剂。①反萃取时,宜选用的试剂X为
②实验室进行萃取和反萃取时,均需要使用的玻璃仪器有
(4)“置换”后的滤液可返回
(5)“置换”时锌粉的利用率为90%,若想获得6.9 kg海绵铟,需要使用锌粉
您最近一年使用:0次
名校
8 . 已知常温下水溶液中 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中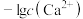 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
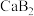 溶液,下列说法错误的是
溶液,下列说法错误的是

 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中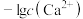 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
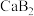 溶液,下列说法错误的是
溶液,下列说法错误的是
| A.曲线d表示δ(HB) |
B. 的水解平衡常数 的水解平衡常数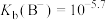 |
| C.滴定过程中溶液会变浑浊 |
D.滴定过程中始终存在: |
您最近一年使用:0次
2023-04-10更新
|
1860次组卷
|
12卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题
四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题河北省石家庄市部分学校2023届高中毕业年级教学质量检测(二)(一模)化学试题河北省邢台市2022-2023学年高三下学期4月第一次模拟考试化学试题(已下线)专题15 水溶液中的离子平衡山东省东营市第一中学2023届高三下学期二模化学试题东北育才学校高中部2023届高三下学期适应性考试化学试题重庆市七校2023-2024学年高三上学期开学考试化学试题湖南省长郡中学2024届高三上学期月考卷(一)化学试题湖南省长沙市长郡中学2024届高三上学期9月月考化学试题江西省宜丰中学创新部2023-2024学年高二上学期第一次(10月)月考化学试题(已下线)化学(九省联考考后提升卷,河南卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)热点18 电解质溶液图像分析
9 . 常温下, 在水中的沉淀溶解平衡曲线如图所示。已知:
在水中的沉淀溶解平衡曲线如图所示。已知: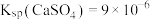 ,下列说法正确的是
,下列说法正确的是

 在水中的沉淀溶解平衡曲线如图所示。已知:
在水中的沉淀溶解平衡曲线如图所示。已知: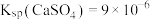 ,下列说法正确的是
,下列说法正确的是
A.在任何溶液中,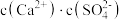 均相等 均相等 |
| B.d点溶液通过蒸发可以变到c点 |
C.b点对应的 大于a点对应的 大于a点对应的 |
D.b点将有沉淀生成,平衡后溶液中 一定小于 一定小于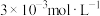 |
您最近一年使用:0次
2023-04-05更新
|
553次组卷
|
6卷引用:四川省德阳市广汉中学2022-2023学年高二下学期第一次月考化学试题
四川省德阳市广汉中学2022-2023学年高二下学期第一次月考化学试题四川省内江市第六中学2022-2023学年高二下学期期中考试化学试题2017届湖南省株洲市高三上教学质检一化学试卷(已下线)专题五 沉淀溶解平衡图象(练)(已下线)T13-溶液中的离子平衡云南省保山市高(完)中C、D类学校2022-2023学年高二下学期6月份联考化学试题
名校
解题方法
10 . 下列实验中,对现象的解释不正确 的是
| 选项 | A | B | C | D |
| 装置及操作 |  向右轻轻推动活塞压缩体积 | 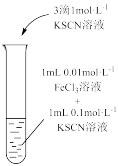 | 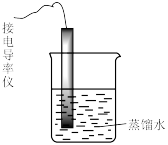 分别测定20℃和80℃蒸馏水的电导率 | 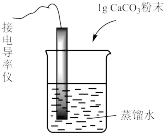 |
| 现象 | 气体红棕色先变深再变浅 | 溶液血红色加深 | 80℃蒸馏水的电导率大于20℃的 | 加入 粉末后电导率增大 粉末后电导率增大 |
| 解释 | 压强增大, 平衡先逆向移动,再正向移动 平衡先逆向移动,再正向移动 | 增大反应物浓度,  平衡正向移动 平衡正向移动 | 温度升高,水的电离平衡正向移动 |  在水中存在 在水中存在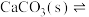  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-06更新
|
932次组卷
|
13卷引用:四川省德阳市什邡中学2023-2024学年高二上学期11月期中考试化学试题
四川省德阳市什邡中学2023-2024学年高二上学期11月期中考试化学试题北京海淀区2022-2023学年高二上学期期末考试化学试题北京一零一中学2022-2023高二上学期期末考试化学试题北京市首都师范大学附属中学2022-2023学年高二上学期期末考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二下学期3月月考化学试题河南省濮阳市第一高级中学2022-2023学年高二下学期期中质量检测化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第十三中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京市第五十中学2023-2024学年高二上学期12月月考化学试题天津市部分区2023-2024学年高二上学期期末练习化学试题北京交通大学附属中学第二分校2023-2024学年高二上学期12月月考化学试题



