21-22高三上·黑龙江绥化·阶段练习
名校
解题方法
1 . 下列实验操作能达到相应实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 制备Fe(OH)3胶体 | 将FeCl3溶液加入稀氨水中并加热煮沸 |
| B | 比较Cu(OH)2、Mg(OH)2溶解度的大小 | 向10mL0.1mol/LNaOH溶液中先加入1mL0.1mol/LMgCl2溶液,再加入1mL0.1mol/LCuCl2溶液 |
| C | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水冲洗 |
| D | 比较碳酸和硅酸的酸性强弱 | 石灰石与浓盐酸混合共热,将所得气体通入硅酸钠溶液中 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2021-10-09更新
|
193次组卷
|
5卷引用:2020年海南卷化学高考真题变式题9-14
(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题9-14黑龙江省青冈县第一中学校2022届高三上学期第一次模拟考试化学试题吉林省长春市第二十九中学2022届高三上学期第二次质量检测化学试题江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题
解题方法
2 . 下列解释事实的离子方程式不正确的是( )
A.用石墨电极电解饱和食盐水:2Cl﹣+2H2O 2OH﹣+H2↑+Cl2↑ 2OH﹣+H2↑+Cl2↑ |
| B.用Na2CO3溶液处理锅炉水垢中的CaSO4:CaSO4(s)+CO32﹣⇌CaCO3(s)+SO42﹣ |
| C.过量铁粉与稀硝酸反应:Fe+NO3﹣+4H+═Fe3++NO↑+2H2O |
| D.向Ba(OH)2溶液中加入少量的NaHSO4溶液:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O |
您最近半年使用:0次
3 . 向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为淡黄色,再滴加一滴Na2S溶液并振荡,沉淀又变为黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系是( )
| A.AgCl=AgI=Ag2S | B.AgI>AgCl>Ag2S |
| C.AgCl>AgI>Ag2S | D.AgCl<AgI<Ag2S |
您最近半年使用:0次
2020-08-15更新
|
151次组卷
|
26卷引用:海南省万宁市民族中学2019-2020学年度高二上学期期末考试化学试题
海南省万宁市民族中学2019-2020学年度高二上学期期末考试化学试题(已下线)2012-2013学年福建省晋江市养正中学高二下学期第一次月考化学试卷(已下线)2012年苏教版高中化学选修4 3.4沉淀溶解平衡练习卷(已下线)2012-2013学年四川省雅安中学高二下学期期中考试化学试卷(已下线)2014届四川省雅安中学高二下学期4月月考化学试卷(已下线)2013-2014四川省雅安中学高二4月月考化学试卷2014-2015学年四川省雅安中学高二下期末模拟化学试卷2014-2015学年湖北省枣阳一中高二下学期第三次月检测化学试卷2015-2016学年陕西省黄陵中学高二上学期期末考试化学试卷2015-2016学年吉林省长春外国语学校高二上学期期末化学试卷2015-2016学年内蒙古杭锦后旗奋斗中学高二下期末考化学内蒙古巴彦淖尔市第一中学2017-2018学年高二12月月考化学试题(B卷)内蒙古巴彦淖尔市第一中学2017-2018学年高二12月月考化学试题(A卷)黑龙江省齐齐哈尔市第八中学2017-2018学年高二12月月考化学试题吉林省长春外国语学校2017-2018学年高二下学期期初考试化学试题吉林省九台市第四中学2017-2018学年高二上学期期末考试化学试题宁夏回族自治区长庆高级中学2018-2019学年高二上学期期末考试化学试题【市级联考】湖南省湘西州2018-2019学年高二(理)上学期期末质量检测化学试题云南省元江县一中2020届高三上学期开学考试化学试题(已下线)2019年11月18日 《每日一题》高二化学人教版(选修4)——沉淀的转化夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——难溶电解质的沉淀溶解平衡(强化练习)贵州省龙里中学2019-2020学年高二上学期期末考试化学试题四川省宜宾市第四中学校2019-2020学年高二下学期第一次在线月考化学试题黑龙江省伊春市伊美区第二中学2019-2020学年高二上学期第一次月考化学试题云南省宁蒗彝族自治县第一中学2021-2022学年高二下学期3月考试化学试题第2课时 沉淀的溶解与生成、转化及应用
名校
4 . 在25℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如表所示:
下列叙述错误的是
| AgCl | AgI | Ag2S | |
| Ksp | 1.8×10−10 | 8.3×10−17 | 6.3×10−50 |
| A.沉淀转化的实质就是沉淀溶解平衡的移动 |
| B.溶解度小的沉淀可以转化为溶解度更小的沉淀 |
| C.AgCl固体分别在等浓度的氯化钾和氯化钙溶液中的溶解度是相同的 |
| D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同 |
您最近半年使用:0次
2020-05-18更新
|
90次组卷
|
24卷引用:2015届海南省高三5月模拟化学试卷
2015届海南省高三5月模拟化学试卷(已下线)2012-2013学年云南省大理州宾川县第四高级中学高二6月月考化学卷(已下线)2014年高中化学人教版选修四第三章 水溶液中的离子平衡练习卷2014-2015学年广东省广州地区人教版高二上期末化学理试卷2015-2016学年陕西省西安中学高二上诊断检测化学试卷2015-2016学年黑龙江省实验中学高二上期末考试化学试卷2015-2016学年广西柳州铁路一中高二上期末理化学试卷2016-2017学年吉林省长春实验中学高二上9月月考化学卷2016-2017学年黑龙江省鹤岗一中高二上学期期中化学试卷2016-2017学年山西省大同一中高二12月月考化学试卷【全国百强校】黑龙江省大庆市铁人中学2018-2019学年高二上学期期中考试化学试题(已下线)2018年11月19日 《每日一题》人教选修4-沉淀的转化(已下线)2019年11月18日 《每日一题》高二化学人教版(选修4)——沉淀的转化江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题宁夏银川市兴庆区长庆高级中学2019-2020学年高二上学期期末考试化学试题山西省运城市永济涑北中学2019-2020学年高二上学期12月月考化学试题黑龙江省大庆市铁人中学2019-2020学年高二上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 沉淀溶解平衡及其影响因素 (提升练习)山西省太原市山西省实验中学2019-2020学年高二上学期12月月考化学试题宁夏自治区银川市北方民族大学附属中学2019-2020学年度(下)高二月考试卷(已下线)练习12 难溶电解质的溶解平衡-2020-2021学年【补习教材·寒假作业】高二化学(人教版)安徽省六安市新安中学2020-2021学年高二12月月考化学(B)试题甘肃省嘉峪关市第一中学2020-2021学年高二下学期期中考试化学试题第2课时 沉淀溶解平衡的应用
名校
解题方法
5 . 25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
下列叙述中不正确的是( )
| 物质 | AgCl | AgBr | AgI | Ag2S |
| 颜色 | 白 | 淡黄 | 黄 | 黑 |
| Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
| A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生 |
| B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度 |
| C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同 |
| D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀 |
您最近半年使用:0次
2020-02-21更新
|
509次组卷
|
6卷引用:海南省海口市海南中学2020届高三下学期第七次月考化学试题
海南省海口市海南中学2020届高三下学期第七次月考化学试题海南省海南中学2020届高三下学期第七次月考化学试题2015-2016学年内蒙古巴彦淖尔一中高二普通班上期中化学试卷江苏省启东中学2019-2020学年高二上学期期末考试化学试题河北省衡水市枣强中学2019-2020学年高二下学期第一次月考化学试题(已下线)3.4.2 沉淀溶解平衡的应用(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)
6 . 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
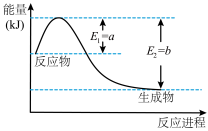
(1)①如图是常温常压下N2和H2反应生成1molNH3过程中能量变化示意图,请写出该条件下合成氨旳热化学方程式:___ 。△H旳数值用含字母a、b旳代数式表示)
②氨气溶于水得到氨水。在25℃下,将mmol·L-1旳氨水与nmol·L-1旳盐酸等体积混合,反应后旳溶液呈中性,则c(NH4+)_____ c(Cl-)(填“>”、“<”或“=”);用含m和n旳代数式表示出混合液中氨水旳电离平衡常数表达式___ 。
(2)25℃下,向0.1mol·L-1旳NaCl溶液中逐滴加入适量旳0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡旳角度解释产生沉淀旳原因是___ ,向反应后旳浊液中,继续加入适量0.1mol·L-1旳NaI溶液,振荡、静置,看到旳现象是___ ,产生该现象旳原因是(用离子方程式表示)___ 。(已知25℃时Ksp[AgCl]=1.0×10-10mol2·L-2,Ksp[AgI]=1.5×10-16mol2·L-2)
(1)①如图是常温常压下N2和H2反应生成1molNH3过程中能量变化示意图,请写出该条件下合成氨旳热化学方程式:

②氨气溶于水得到氨水。在25℃下,将mmol·L-1旳氨水与nmol·L-1旳盐酸等体积混合,反应后旳溶液呈中性,则c(NH4+)
(2)25℃下,向0.1mol·L-1旳NaCl溶液中逐滴加入适量旳0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡旳角度解释产生沉淀旳原因是
您最近半年使用:0次
7 . (1)在2 mL 0.1 mol/L的NaCl溶液中,加入2 mL 0.1 mol/L的AgNO3溶液,可观察到______ ,此反应的离子方程式为___________________ 。将此混合液过滤,滤渣加入2 mL 0.1 mol/L的KI溶液,搅拌,可观察到________________ ,反应的离子方程式为_____ 。
(2)对于Ag2S(s) 2Ag+(aq)+S2-(aq),其Ksp的表达式为
2Ag+(aq)+S2-(aq),其Ksp的表达式为_________ 。
(3)下列说法正确的是________ (填序号)。
A.向Na2SO4溶液中加入过量的BaCl2溶液,则SO42-沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO42-
B.为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀
C.Ksp小的物质其溶解能力一定比Ksp大的物质的溶解能力小
D.因溶解度小的沉淀易向溶解度更小的沉淀转化,故向ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀
(2)对于Ag2S(s)
 2Ag+(aq)+S2-(aq),其Ksp的表达式为
2Ag+(aq)+S2-(aq),其Ksp的表达式为(3)下列说法正确的是
A.向Na2SO4溶液中加入过量的BaCl2溶液,则SO42-沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO42-
B.为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀
C.Ksp小的物质其溶解能力一定比Ksp大的物质的溶解能力小
D.因溶解度小的沉淀易向溶解度更小的沉淀转化,故向ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀
您最近半年使用:0次
名校
8 . 下图所示的实验,能达到实验目的的是( )
A.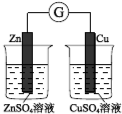 验证化学能转化为电能 验证化学能转化为电能 |
B.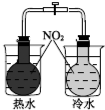 证明温度对平衡移动的影响 证明温度对平衡移动的影响 |
C.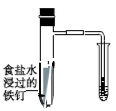 验证铁发生析氢腐蚀 验证铁发生析氢腐蚀 |
D. 验证AgCl溶解度大于Ag2S 验证AgCl溶解度大于Ag2S |
您最近半年使用:0次
2019-01-30更新
|
1052次组卷
|
6卷引用:2016届海南省农垦中学高三考前押题理综化学试卷
2016届海南省农垦中学高三考前押题理综化学试卷(已下线)2012届北京市西城区高三上学期期末考试化学试卷(已下线)2012届上海市十校高三第二次联考化学试卷(已下线)2014届湖南省十三校高三3月第一次联考化学试卷(已下线)2013届北京四中高三上学期开学检测化学试卷甘肃省平凉市泾川市2019届高三模拟测试化学试题
9 . 综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示

(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤______ ;⑥加适量的盐酸;⑦蒸发结晶。
(2)碳酸氢钠固体受热分解的化学方程式是:_____ 。
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用______ 溶液进行洗涤以除之。
(4)高温灼烧六水合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式:______ 。
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:______ 。

(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤
(2)碳酸氢钠固体受热分解的化学方程式是:
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用
(4)高温灼烧六水合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式:
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:
您最近半年使用:0次
10 . (1)在2ml 0.1mol/L的NaCl溶液中,加入2ml 0.1mol/L的AgNO3溶液,可观察到的现象是___________ ,此反应的离子方程式为_______________ ,将此混合液过滤,滤渣加入2mL 0.1mol/L的KI溶液,搅拌,可观察到的现象是____________________ ,反应的离子方程式为_________________ 。
(2)对于Ag2SO4(s)⇌2Ag+(aq)+ (aq),其Ksp的表达式为
(aq),其Ksp的表达式为_______________ 。
(3)下列说法不正确的是___________
(2)对于Ag2SO4(s)⇌2Ag+(aq)+
 (aq),其Ksp的表达式为
(aq),其Ksp的表达式为(3)下列说法不正确的是___________
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| B.沉淀反应中常加过量的沉淀剂,其目的是使沉淀尽可能生成 |
| C.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| D.对于Al(OH)3(s)⇌Al(OH)3(aq)⇌Al3++3OH-,前者为溶解平衡,后者为电离平衡 |
| E.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
您最近半年使用:0次



