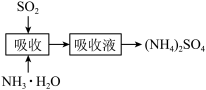
1 . 工业上常用氨水吸收SO2,实现尾气资源化利用。模拟工业过程如图所示。室温下,用0.1mol/L氨水溶液吸收SO2,若通入SO2所引起的溶液体积变化和NH3及H2O挥发可忽略,溶液中含硫物种的浓度 。H2SO3的电离平衡常数分别为
。H2SO3的电离平衡常数分别为 ,
, 。下列说法一定正确的是
。下列说法一定正确的是
 。H2SO3的电离平衡常数分别为
。H2SO3的电离平衡常数分别为 ,
, 。下列说法一定正确的是
。下列说法一定正确的是
A.吸收液pH=7时,溶液中 |
B.吸收液pH=5时测得 ,溶液中 ,溶液中 |
C.向吸收液中滴加 溶液生成白色沉淀,上层清液中 溶液生成白色沉淀,上层清液中 |
D.向吸收液中滴加 溶液,可能发生反应的离子方程式为: 溶液,可能发生反应的离子方程式为: |
您最近一年使用:0次
解题方法
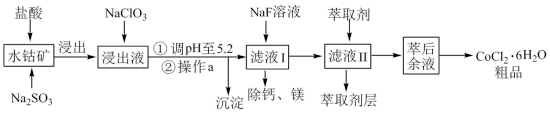
2 . 钴(Co)及其化合物在工业上有广泛应用。利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取CoCl2•6H2O粗品的工艺流程图如下:
已知:①浸出液含有的阳离子主要有 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的 如下表:
如下表:
请回答下列问题:
(1)上述工艺流程图中操作a的名称为___________ 。
(2)Co的价电子排布式________________ 。
(3)写出“浸出”时Co2O3发生反应的离子方程式:___________ 。
(4)加入 的作用是
的作用是___________ 。
(5)萃取剂对金属离子的萃取率与 关系如图。使用萃取剂最适宜的
关系如图。使用萃取剂最适宜的
______ (填字母)。

已知:①浸出液含有的阳离子主要有
 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的
 如下表:
如下表:| 沉淀物 |  |  |  |  |  |
开始沉淀时的 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀时的 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)上述工艺流程图中操作a的名称为
(2)Co的价电子排布式
(3)写出“浸出”时Co2O3发生反应的离子方程式:
(4)加入
 的作用是
的作用是(5)萃取剂对金属离子的萃取率与
 关系如图。使用萃取剂最适宜的
关系如图。使用萃取剂最适宜的
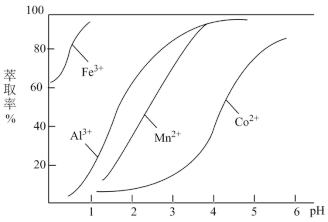
A.接近2.0 B.接近3.0 C.接近5.0
您最近一年使用:0次
3 . 某温度下,向20mL0.15mol/LNH4Cl溶液中滴加0.15mol/L的AgNO3溶液,该实验使用(NH4)2CrO4作指示剂。滴加过程中,溶液中-1gc(Cl-)与AgNO3溶液体积(V)的关系如图所示。已知Ksp(AgCl)>Ksp(AgBr),Ksp(Ag2CrO4)=10-12,Ag2CrO4为砖红色沉淀。下列说法错误的是

| A.相同温度下,Ksp(Ag2CrO4)一定大于Ksp(AgCl) |
| B.由图可知当恰好达到滴定终点时,Cl-恰好完全沉淀 |
C.a点时,溶液中c( )≥0.01mol/L )≥0.01mol/L |
| D.若用0.075mol/L的AgNO3溶液,则a点移至b点;将NH4Cl溶液改为等浓度的NH4Br溶液,则a点移至c点 |
您最近一年使用:0次
名校
解题方法
4 . T℃时, 和
和 的沉淀溶解平衡曲线如图所示。已知:
的沉淀溶解平衡曲线如图所示。已知: ,
, 或
或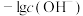 。下列说法正确的是
。下列说法正确的是

 和
和 的沉淀溶解平衡曲线如图所示。已知:
的沉淀溶解平衡曲线如图所示。已知: ,
, 或
或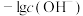 。下列说法正确的是
。下列说法正确的是
A.T℃时, |
B.Y点对应的 溶液是不饱和溶液 溶液是不饱和溶液 |
C.Z点对应的溶液中,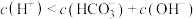 |
D.向 悬浊液中通入 悬浊液中通入 气体(忽略溶液体积的变化),溶液中 气体(忽略溶液体积的变化),溶液中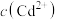 保持不变 保持不变 |
您最近一年使用:0次
5 . 酸性矿山废水中锌、铁、锰元素的分离及回收流程如图:

已知:①酸性矿山废水成分如表:
②
③
(1)“研磨”的目的是___________ 。
(2)“沉锌”过程中, 先转化为
先转化为 和
和 ,所得
,所得
___________ 。
(3)“沉锌”过程中,完全沉淀时[c(Zn2+)≤10-5mol/L],测得溶液 为4,则
为4,则
___________  。
。
(4)“氧化”过程发生反应的离子方程式为___________ 。
(5)“沉铁”过程中,加入 调节
调节 ,废水
,废水 对铁、锰元素去除率的影响如图所示,为提高铁、锰元素的分离效果,废水
对铁、锰元素去除率的影响如图所示,为提高铁、锰元素的分离效果,废水 控制
控制___________ 。

(6)“沉锰”后,溶液中 ,锰元素去除率为
,锰元素去除率为___________ %。 (保留1位小数,忽略体积变化)。

已知:①酸性矿山废水成分如表:
| pH | 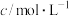 | ||
 |  |  | |
| 1.0 |  |  | 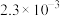 |

③

(1)“研磨”的目的是
(2)“沉锌”过程中,
 先转化为
先转化为 和
和 ,所得
,所得
(3)“沉锌”过程中,完全沉淀时[c(Zn2+)≤10-5mol/L],测得溶液
 为4,则
为4,则
 。
。(4)“氧化”过程发生反应的离子方程式为
(5)“沉铁”过程中,加入
 调节
调节 ,废水
,废水 对铁、锰元素去除率的影响如图所示,为提高铁、锰元素的分离效果,废水
对铁、锰元素去除率的影响如图所示,为提高铁、锰元素的分离效果,废水 控制
控制
(6)“沉锰”后,溶液中
 ,锰元素去除率为
,锰元素去除率为
您最近一年使用:0次
名校
6 . 碳酸锰可作为陶瓷、涂料和清漆的原料,氧化铜是玻璃、搪瓷、陶瓷等工业的着色剂。一种利用铜矿(主要成分是CuS,含杂质FeS、 )、软锰矿(主要成分是
)、软锰矿(主要成分是 ,含杂质
,含杂质 、
、 )联合制备
)联合制备 、CuO的工艺流程如下(软锰矿相对铜矿稍过量):
、CuO的工艺流程如下(软锰矿相对铜矿稍过量):

常温下,有关金属离子形成氢氧化物沉淀的pH见下表:
回答下列问题:
(1)“滤渣a”中含硫单质,还含有_______ (填化学式)。
(2)已知 的氧化性比+3价铁的强,写出“酸浸”时FeS参与反应的离子方程式:
的氧化性比+3价铁的强,写出“酸浸”时FeS参与反应的离子方程式:_______ 。软锰矿稍过量的主要目的是_______ 。
(3)除铁铝操作控制溶液的pH最小为_______ ,常需要加热煮沸的目的是_______ 。
(4)“沉锰”中生成 的离子方程式为
的离子方程式为_______ 。
(5)实验室对 沉淀进行洗涤的操作是
沉淀进行洗涤的操作是_______ 。
(6)“蒸氨”所得气体为混合物,则其成分是_______ (填化学式)。
 )、软锰矿(主要成分是
)、软锰矿(主要成分是 ,含杂质
,含杂质 、
、 )联合制备
)联合制备 、CuO的工艺流程如下(软锰矿相对铜矿稍过量):
、CuO的工艺流程如下(软锰矿相对铜矿稍过量):
常温下,有关金属离子形成氢氧化物沉淀的pH见下表:
| 金属离子 |  |  |  |  |  |
| 开始沉淀时的pH | 7.0 | 2.2 | 3.5 | 5.6 | 8.0 |
沉淀完全时( )的pH )的pH | 9.0 | 3.2 | 4.7 | 6.7 | 10.0 |
(1)“滤渣a”中含硫单质,还含有
(2)已知
 的氧化性比+3价铁的强,写出“酸浸”时FeS参与反应的离子方程式:
的氧化性比+3价铁的强,写出“酸浸”时FeS参与反应的离子方程式:(3)除铁铝操作控制溶液的pH最小为
(4)“沉锰”中生成
 的离子方程式为
的离子方程式为(5)实验室对
 沉淀进行洗涤的操作是
沉淀进行洗涤的操作是(6)“蒸氨”所得气体为混合物,则其成分是
您最近一年使用:0次
名校
解题方法
7 . 镍催化剂的主要成分为Ni,还含有一定量Al、Fe及氧化铁、少量其他不溶性物质,回收废镍催化剂制备硫酸镍晶体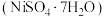 的工艺流程如下:
的工艺流程如下:
(1)提高“碱浸”速率的措施是_______ (任写两点即可)。
(2)为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。该反应的化学反应方程式是_______ 。
(3)“氧化”步骤中加入 的目的是
的目的是_______ (用离子方程式表示)。
(4)“调pH”时,最适宜的pH范围是_______ 。
(5)若工艺流程改为先“调pH”后“氧化”,“滤液③”中可能含有的杂质离子为_______ 。
(6)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
从 溶液获得稳定的
溶液获得稳定的 晶体的操作依次
晶体的操作依次_______ 。
(7)硫酸镍在强碱溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。该反应的离子方程式是
。该反应的离子方程式是_______ 。
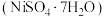 的工艺流程如下:
的工艺流程如下:
| 金属离子 |  |  |  |  |
开始沉淀时 的pH 的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时 的pH 的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)提高“碱浸”速率的措施是
(2)为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。该反应的化学反应方程式是
(3)“氧化”步骤中加入
 的目的是
的目的是(4)“调pH”时,最适宜的pH范围是
(5)若工艺流程改为先“调pH”后“氧化”,“滤液③”中可能含有的杂质离子为
(6)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 |  |  | 多种结晶水合物 |  |
 溶液获得稳定的
溶液获得稳定的 晶体的操作依次
晶体的操作依次(7)硫酸镍在强碱溶液中用
 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。该反应的离子方程式是
。该反应的离子方程式是
您最近一年使用:0次
2024-01-06更新
|
72次组卷
|
3卷引用:河北省唐山市开滦第一中学2023-2024学年高三上学期 期中考试化学试卷
名校
解题方法
8 . 常温下,向AgCl悬浊液中滴加浓氨水, 与
与 的关系如图{其中X代表
的关系如图{其中X代表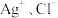 、
、 或
或 }。已知:
}。已知:
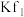 和
和
 。下列说法正确的是
。下列说法正确的是
 与
与 的关系如图{其中X代表
的关系如图{其中X代表 、
、 或
或 }。已知:
}。已知:
 和
和
 。下列说法正确的是
。下列说法正确的是
A.曲线Ⅲ表示 随 随 浓度变化曲线 浓度变化曲线 |
B.AgCl的溶度积常数 |
C.平衡常数 |
D. 时,溶液中 时,溶液中 |
您最近一年使用:0次
9 . 下列实验方案设计、现象和结论都正确的是
选项 | 方案操作 | 现象 | 结论 |
A | 向NaCl和KI混合溶液中滴加 溶液 溶液 | 先产生黄色沉淀,后产生白色沉淀 | 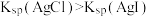 |
B | 室温下,用pH试纸分别测量0.1mol/L NaCN溶液和NaClO溶液的pH | 测得NaCN溶液pH大于NaClO | 说明 结合 结合 的能力更强 的能力更强 |
C | 向 溶液中滴加少量 溶液中滴加少量 溶液 溶液 | 产生白色沉淀 |  与 与 发生了相互促进的水解反应 发生了相互促进的水解反应 |
D | 取2mL 0.5mol/L  溶液并加热 溶液并加热 | 溶液变为黄绿色 |  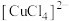 为吸热反应 为吸热反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 常温下,向10.0mL浓度均为0.1mol/L的 和
和 混合溶液中加入NaOH固体,溶液中金属元素有不同的存在形式,它们的物质的量浓度与NaOH物质的量关系如图所示,测得a、b两点溶液的pH分别为3.0,4.3.
混合溶液中加入NaOH固体,溶液中金属元素有不同的存在形式,它们的物质的量浓度与NaOH物质的量关系如图所示,测得a、b两点溶液的pH分别为3.0,4.3.

已知:①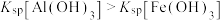 ;
;
②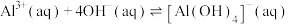 ,298K,
,298K, 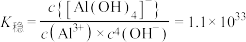 。
。
下列叙述正确的是
 和
和 混合溶液中加入NaOH固体,溶液中金属元素有不同的存在形式,它们的物质的量浓度与NaOH物质的量关系如图所示,测得a、b两点溶液的pH分别为3.0,4.3.
混合溶液中加入NaOH固体,溶液中金属元素有不同的存在形式,它们的物质的量浓度与NaOH物质的量关系如图所示,测得a、b两点溶液的pH分别为3.0,4.3.
已知:①
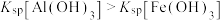 ;
;②
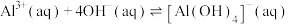 ,298K,
,298K, 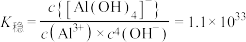 。
。下列叙述正确的是
A.曲线Ⅱ代表 |
B.常温下,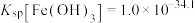 |
C.c点铁铝元素主要存在形式为 和 和 |
D.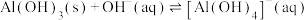 的平衡常数K为 的平衡常数K为 数量级 数量级 |
您最近一年使用:0次



