名校
解题方法
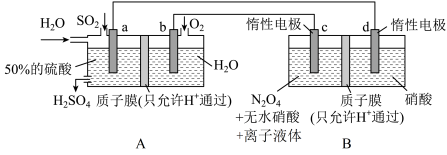
1 . 硝化剂可在化学反应中向有机化合物中引入硝基、硝酸酯基 是一种绿色硝化剂。有人设想利用工业废气
是一种绿色硝化剂。有人设想利用工业废气 ,依据电化学原理制备
,依据电化学原理制备 和
和 。装置图如下,下列说法
。装置图如下,下列说法不正确 的是
 是一种绿色硝化剂。有人设想利用工业废气
是一种绿色硝化剂。有人设想利用工业废气 ,依据电化学原理制备
,依据电化学原理制备 和
和 。装置图如下,下列说法
。装置图如下,下列说法
A.装置 可将电能转化为化学能 可将电能转化为化学能 |
B.装置 中H从a极区迁移到b极区 中H从a极区迁移到b极区 |
C.c电极表面生成 ,电极反应式为: ,电极反应式为: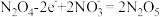 |
D.反应过程中 装置d区 装置d区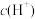 保持不变 保持不变 |
您最近一年使用:0次
2023-10-13更新
|
410次组卷
|
2卷引用:湖北省重点高中智学联盟2023-2024学年高三上学期10月联考化学试题
2 . 回答下列问题
(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = 2H2O。已知该反应为放热反应,如图能正确表示该反应中能量变化的是_______ 。(填“A”或“B”)

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如表:
则生成1mol水可以放出热量 _______ kJ
(2)以下反应:①木炭与水制备水煤气②氯酸钾分解③炸药爆炸④酸与碱的中和反应⑤生石灰与水作用制熟石灰⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的有:_______ (填序号)。
(3)分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:

①以下叙述中,正确的是_______ (填字母)。
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大 D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu F.乙溶液中 向铜片方向移动
向铜片方向移动
②乙中能量转化的主要形式为_______ 。
③在乙实验中,如果把稀硫酸换成硫酸铜溶液,铜电极的电极反应式是_______ ,当电路中转移0.25 mol电子时,消耗负极材料的质量为_______ g。
(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = 2H2O。已知该反应为放热反应,如图能正确表示该反应中能量变化的是

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如表:
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
(2)以下反应:①木炭与水制备水煤气②氯酸钾分解③炸药爆炸④酸与碱的中和反应⑤生石灰与水作用制熟石灰⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的有:
(3)分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:

①以下叙述中,正确的是
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大 D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu F.乙溶液中
 向铜片方向移动
向铜片方向移动②乙中能量转化的主要形式为
③在乙实验中,如果把稀硫酸换成硫酸铜溶液,铜电极的电极反应式是
您最近一年使用:0次
名校
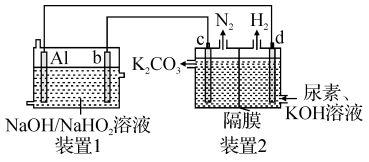
3 . 目前研究比较热门的Al—H2O2电池,其电池总反应为2Al+3HO =2Al
=2Al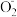 +OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
+OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
 =2Al
=2Al +OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
+OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
| A.Al为负极,c为阴极 |
| B.装置1中OH-移向电极b |
C.电极c的电极反应式为CO(NH2)2-6e-+8OH-=CO +N2+6H2O +N2+6H2O |
| D.通电一段时间后,若Al电极的质量减轻5.4g,则d电极产生H26.72L |
您最近一年使用:0次
2021-09-11更新
|
866次组卷
|
4卷引用:湖北省新高考联考协作体2021-2022学年高三上学期起点考试化学试题
湖北省新高考联考协作体2021-2022学年高三上学期起点考试化学试题湖北省阳新高中2021-2022学年高二上学期9月月考化学试题湖北省枣阳市第一中学2022-2023学年高三上学期9月月考化学试题(已下线)专题08 电化学之电解池-【微专题·大素养】备战2022年高考化学讲透提分要点
名校
解题方法
4 . 如图所示,是原电池的装置图。请回答:
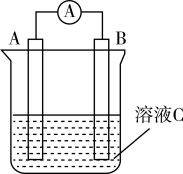
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极可使用___________ ,A上发生的电极反应式为______________________________ ;
(2)若C为CuCl2溶液,Zn是负极,Cu极发生____ 反应,电极反应为_____________ 。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
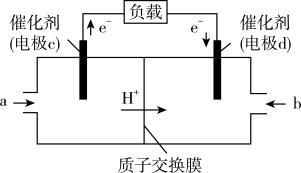
电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为____ 极,电极反应方程式为______ 。若线路中转移2mol电子,则消耗的O2在标准状况下的体积为____ L。

(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极可使用
(2)若C为CuCl2溶液,Zn是负极,Cu极发生
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为
您最近一年使用:0次
2020-05-04更新
|
220次组卷
|
2卷引用:湖北省华中师范大学潜江附属中学2019-2020学年高一5月月考化学试题



