解题方法
1 . 如图是原电池电解池的组合装置图。
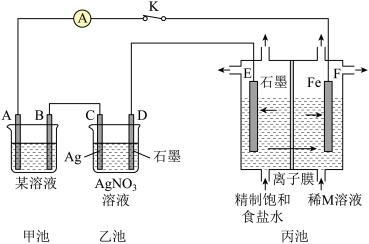
请回答:
(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为Fe,B为碳棒。则:
①甲池为_______ (填“原电池”或“电解池”);B电极上发生的现象为_______ 。
②乙池中的银电极上的电极反应式为_______ 。
③闭合K一段时间后,稀M溶液的浓度会增加,则M溶液中的溶质是_______ (填化学式);丙池中的离子膜为_______ (填“阳离子交换膜”或“阴离子交换膜”)
(2)若将甲池的某溶液改为FeCl3,电极材料A为Cu、B为碳棒,则甲池的总反应的离子方程式为_______ 。

请回答:
(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为Fe,B为碳棒。则:
①甲池为
②乙池中的银电极上的电极反应式为
③闭合K一段时间后,稀M溶液的浓度会增加,则M溶液中的溶质是
(2)若将甲池的某溶液改为FeCl3,电极材料A为Cu、B为碳棒,则甲池的总反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀。下列说法错误的是
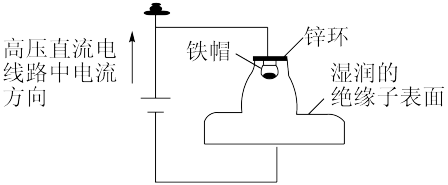

A.断电时,锌环上的电极反应为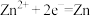 |
| B.断电时,仍能防止铁帽被腐蚀 |
| C.通电时,锌环是阳极,发生氧化反应 |
| D.通电时,该装置为外加电流的阴极保护法 |
您最近一年使用:0次
3 . 用锌棒、石墨和CuCl2溶液组成的原电池,锌棒为___________ 极,其上发生___________ 反应(填“氧化”或“还原”),该电极反应式为___________ ;石墨棒为___________ 极,其上观察到的现象为___________ 。该装置在工作过程中,电子从___________ 经过___________ (填“导线”或“溶液”)流向___________ 。该原电池总反应的离子方程式为___________ 。
您最近一年使用:0次
4 . (1)合成氨工业是煤化工产业链中非常重要的一步。已知有一组数据:破坏1molN2中的 键需要吸收
键需要吸收 能量;破坏
能量;破坏 中的
中的 键需要吸收
键需要吸收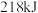 能量;形成
能量;形成 中的
中的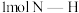 键能释放
键能释放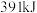 能量。图表示合成氨工业过程中能量的变化,请将图中①②的能量变化的数值填在横线上。
能量。图表示合成氨工业过程中能量的变化,请将图中①②的能量变化的数值填在横线上。
①________________  ,②
,②____________________  。
。

(2)用A、B、C、D四种金属按如表所示的装置进行实验。
根据实验现象回答下列问题:
①装置甲中负极的电极反应式为__________________ 。
②装置乙中正极的电极反应式为________________ 。
③装置丙中溶液的pH________ (填“变大”“变小”或“不变”)。
④四种金属的活动性由强到弱的顺序是________ 。
(3)一定温度下,在体积为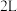 的恒容密闭容器中充入
的恒容密闭容器中充入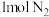 和
和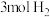 ,发生反应
,发生反应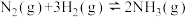 ,测得
,测得 的物质的量随时间的变化如图所示。
的物质的量随时间的变化如图所示。
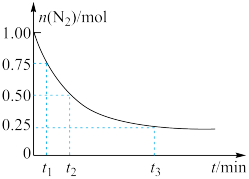
从开始反应到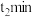 ,用
,用 表示的化学反应速率为
表示的化学反应速率为_________ 。
 键需要吸收
键需要吸收 能量;破坏
能量;破坏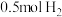 中的
中的 键需要吸收
键需要吸收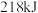 能量;形成
能量;形成 中的
中的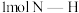 键能释放
键能释放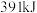 能量。图表示合成氨工业过程中能量的变化,请将图中①②的能量变化的数值填在横线上。
能量。图表示合成氨工业过程中能量的变化,请将图中①②的能量变化的数值填在横线上。①
 ,②
,② 。
。
(2)用A、B、C、D四种金属按如表所示的装置进行实验。
| 装置 |  甲 |  乙 |  丙 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置甲中负极的电极反应式为
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属的活动性由强到弱的顺序是
(3)一定温度下,在体积为
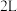 的恒容密闭容器中充入
的恒容密闭容器中充入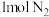 和
和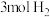 ,发生反应
,发生反应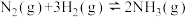 ,测得
,测得 的物质的量随时间的变化如图所示。
的物质的量随时间的变化如图所示。
从开始反应到
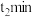 ,用
,用 表示的化学反应速率为
表示的化学反应速率为
您最近一年使用:0次
2020-09-24更新
|
627次组卷
|
3卷引用:陕西省咸阳市武功县普集高级中学2020-2021学年高一下学期第三次月考化学试题
名校
5 . 按要求回答问题:
(1)由SiO2制备高纯度硅的工业流程如图所示:
①写出SiO2转化为Si(粗)的化学方程式:____________________________________________ 。
②可以循环使用的物质为_________________________ 。
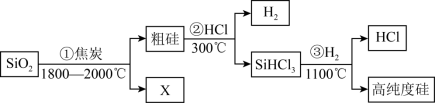
(2)为了有效实现NO和NO2的相互转化,设计如图实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。
①打开止水夹,推动针筒活塞,使氧气进入烧瓶,首先观察到烧瓶中的现象是____________ ,产生此现象的化学方程式为______________________________________________ 。
②关上止水夹,轻轻摇动烧瓶,写出发生的化学方程式________________________________ 。
(3)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向________ 极移动(填“正”或“负”)。
②若有 1 mol e- 流过导线,则理论上负极质量减少________ g。
③若将稀硫酸换成浓硝酸,正极电极方程式为:______________________ 。
(1)由SiO2制备高纯度硅的工业流程如图所示:

①写出SiO2转化为Si(粗)的化学方程式:
②可以循环使用的物质为
(2)为了有效实现NO和NO2的相互转化,设计如图实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。

①打开止水夹,推动针筒活塞,使氧气进入烧瓶,首先观察到烧瓶中的现象是
②关上止水夹,轻轻摇动烧瓶,写出发生的化学方程式
(3)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向
②若有 1 mol e- 流过导线,则理论上负极质量减少
③若将稀硫酸换成浓硝酸,正极电极方程式为:
您最近一年使用:0次
2023-05-18更新
|
318次组卷
|
2卷引用:陕西延安中学2022-2023学年高一下学期期中考试化学试题
名校
6 . 浓差电池是一种利用电解质溶液浓度差产生电势差而形成的电池,理论上当电解质溶液的浓度相等时停止放电。图1为浓差电池,图2为电渗析法制备磷酸二氢钠,用浓差电池为电源完成电渗析法制备磷酸二氢钠。下列说法错误的是
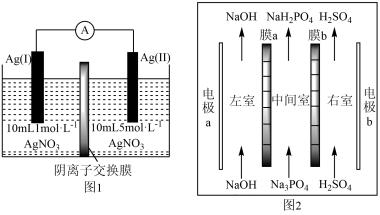

| A.电极a应与Ag(I)相连 |
| B.电渗析装置中膜a为阳离子交换膜 |
C.电渗析过程中左、右室中NaOH和 的浓度均增大 的浓度均增大 |
D.电池从开始到停止放电,理论上可制备2.4g |
您最近一年使用:0次
2024-01-13更新
|
628次组卷
|
4卷引用:陕西省渭南市2023-2024学年高三上学期教学质量检测化学试卷
陕西省渭南市2023-2024学年高三上学期教学质量检测化学试卷 陕西省渭南市2023-2024学年高三教学质量检测(Ⅰ)化学试题 四川省成都市第七中学2023-2024学年高三上学期期末考试理科综合试卷-高中化学(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
解题方法
7 . 如图所示,是原电池的装置图。请回答:
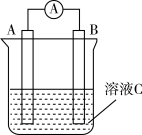
(1)若溶液C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为___________ ; 在反应中溶液中的阴离子移向___________ (填“A”或“B”),反应进行一段时间后溶液C的pH___________ (填“升高”“降低”或“基本不变”)
(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为___________ , B极电极反应式为___________ 。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
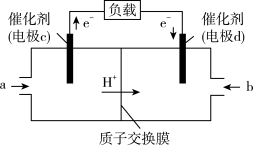
电池总反应为2CH3OH+3O2=2CO2+4H2O,则电极c是___________ (填“正极”或“负极”),若线路中转移2 mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为___________ L。

(1)若溶液C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为
(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则电极c是
您最近一年使用:0次
解题方法
8 . 化学反应在发生物质变化的同时伴随有能量的变化,是人类获取能量的重要途径。
Ⅰ.氢能是理想的能源之一。回答下列问题:
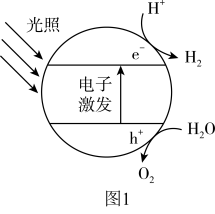
(1)利用太阳能催化光解水是制备 的方法之一,其原理如图1所示,光解水中能量的转化形式为光能转化为
的方法之一,其原理如图1所示,光解水中能量的转化形式为光能转化为_______ 。
(2)在高温时,水蒸气与灼热的炭反应也能制得 。该反应的能量变化如图2所示。
。该反应的能量变化如图2所示。
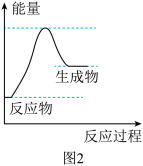
①该反应为_______ (填“吸热”或“放热”)反应。下列有关该反应的说法正确的是_______ (填字母)。
a.反应物的总能量高于产物的总能量
b.该反应过程中化学能全部转化为热能
c.该反应属于氧化还原反应
d.反应过程中,化学键的断裂与形成是化学反应中能量变化的主要原因
② 、
、 、C都是常用的燃料。
、C都是常用的燃料。 、
、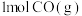 、
、 完全燃烧生成
完全燃烧生成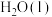 或
或 时,放出的热量分别为
时,放出的热量分别为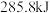 、
、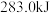 、
、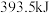 。相同质量的这三种燃料完全燃烧时放出的热量由大到小的顺序为
。相同质量的这三种燃料完全燃烧时放出的热量由大到小的顺序为_______ (用化学式表示)。
Ⅱ.原电池是将化学能转化为电能的一种装置。
常温下,将除去表面氧化膜的铝片、铜片插入浓 中组成原电池,装置如图甲所示,测得原电池的电流强度
中组成原电池,装置如图甲所示,测得原电池的电流强度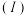 随时间
随时间 的变化如图乙所示,反应过程中有红棕色气体产生。后,外电路中电子的流动方向发生改变。
的变化如图乙所示,反应过程中有红棕色气体产生。后,外电路中电子的流动方向发生改变。

(3)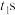 后,原电池的铜片是
后,原电池的铜片是_______ (填“正”或“负”)极,其电极反应式为_______ ,溶液中的 向
向_______ (填“正”或“负”)极移动。
Ⅰ.氢能是理想的能源之一。回答下列问题:
(1)利用太阳能催化光解水是制备
 的方法之一,其原理如图1所示,光解水中能量的转化形式为光能转化为
的方法之一,其原理如图1所示,光解水中能量的转化形式为光能转化为
(2)在高温时,水蒸气与灼热的炭反应也能制得
 。该反应的能量变化如图2所示。
。该反应的能量变化如图2所示。
①该反应为
a.反应物的总能量高于产物的总能量
b.该反应过程中化学能全部转化为热能
c.该反应属于氧化还原反应
d.反应过程中,化学键的断裂与形成是化学反应中能量变化的主要原因
②
 、
、 、C都是常用的燃料。
、C都是常用的燃料。 、
、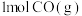 、
、 完全燃烧生成
完全燃烧生成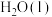 或
或 时,放出的热量分别为
时,放出的热量分别为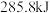 、
、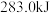 、
、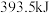 。相同质量的这三种燃料完全燃烧时放出的热量由大到小的顺序为
。相同质量的这三种燃料完全燃烧时放出的热量由大到小的顺序为Ⅱ.原电池是将化学能转化为电能的一种装置。
常温下,将除去表面氧化膜的铝片、铜片插入浓
 中组成原电池,装置如图甲所示,测得原电池的电流强度
中组成原电池,装置如图甲所示,测得原电池的电流强度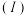 随时间
随时间 的变化如图乙所示,反应过程中有红棕色气体产生。后,外电路中电子的流动方向发生改变。
的变化如图乙所示,反应过程中有红棕色气体产生。后,外电路中电子的流动方向发生改变。
(3)
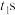 后,原电池的铜片是
后,原电池的铜片是 向
向
您最近一年使用:0次
名校
解题方法
9 . X、Y、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,在周期表的短周期主族元素中,X的原子半径最小,X与R的最外层电子数相等;Y的内层电子数是最外层电子数的一半;U的最高化合价和最低化合价的代数和为6;Z和Q形成原子个数之比为1:2的气态化合物的颜色是红棕色;R和Q可形成原子个数之比为1:1和2:1的两种化合物;R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应。
请回答下列问题:
(1)T元素在周期表中的位置是_______ 。
(2)X、Y、Q三种元素的原子半径由小到大的顺序为_______ (填元素符号)。
(3)T、U两元素最高价氧化物对应的水化物反应的离子方程式为_______ 。
(4)下列可以判断R和T的金属性强弱的是
(5)某同学用X、R两元素的单质反应生成固体物质RX,RX属于离子化合物,且能与化合物X2Q反应生成的单质。
①RX的电子式为_______ ;RX与X2Q反应的化学方程式为_______ 。
②该用电子式表示RX的形成过程:_______ 。
(6)R2Q2的化学式是_______ ,所含有的化学键类型为_______ ,它与水反应的离子方程式为_______ 。
(7)Z元素对应的最高价氧化物对应的水化物的化学式是_______ ,X与Z元素形成的化合物Z2X4的电子式是_______ ,化合物类型是_______ 。(填“离子化合物”或“共价化合物”)
(8)纳米级Cu2O由于具有优良的催化性能而受到关注,采用Z2X4燃料电池作为制备电源,其装置如图,燃料电池中,A电极是_______ (填“正”或“负”)极,A极发生的电极反应为_______ 。

请回答下列问题:
(1)T元素在周期表中的位置是
(2)X、Y、Q三种元素的原子半径由小到大的顺序为
(3)T、U两元素最高价氧化物对应的水化物反应的离子方程式为
(4)下列可以判断R和T的金属性强弱的是
| A.单质的熔点:R比T低 |
| B.单质与酸反应时,失电子数:R比T少 |
| C.单质与水反应:R比T剧烈 |
| D.最高价氧化物对应水化物的碱性:R比T强 |
①RX的电子式为
②该用电子式表示RX的形成过程:
(6)R2Q2的化学式是
(7)Z元素对应的最高价氧化物对应的水化物的化学式是
(8)纳米级Cu2O由于具有优良的催化性能而受到关注,采用Z2X4燃料电池作为制备电源,其装置如图,燃料电池中,A电极是

您最近一年使用:0次
解题方法
10 . 根据信息填空
(1)用如图所示的装置进行铝热法炼铁实验,写出铝热法炼铁反应的化学方程式:_______ 。
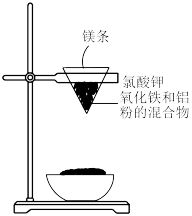
(2)已知:Fe+2FeCl3=3FeCl2,利用这一反应,设计一个原电池,画出示意图,标明电极材料名称,电解质溶液______ 。该原电池中,三价铁离子向_______ (填“正极”或“负极”)移动。负极的电极反应式为_______

(3)古代《药性论》中有关铅丹(Pb3O4)的描述是治惊悸狂走,呕逆,消渴,铅丹(Pb3O4)也可作为防锈用涂料,呈红褐色,又名红丹。
①铅丹可用PbO在空气中加热制备,请写出有关反应的化学方程式_______ 。
②铅丹曾用于铁制品防锈,请举例说明铁制品防锈的其它方法_______ (只填一种方法)。
(1)用如图所示的装置进行铝热法炼铁实验,写出铝热法炼铁反应的化学方程式:

(2)已知:Fe+2FeCl3=3FeCl2,利用这一反应,设计一个原电池,画出示意图,标明电极材料名称,电解质溶液

(3)古代《药性论》中有关铅丹(Pb3O4)的描述是治惊悸狂走,呕逆,消渴,铅丹(Pb3O4)也可作为防锈用涂料,呈红褐色,又名红丹。
①铅丹可用PbO在空气中加热制备,请写出有关反应的化学方程式
②铅丹曾用于铁制品防锈,请举例说明铁制品防锈的其它方法
您最近一年使用:0次



