1 . 电化学知识在生活中应用广泛,但形成原电池和电解池均需要一定的条件。
(1)现有下列装置:

其中,能构成原电池的是______ (填字母代号),能构成电解池的是______ (填字母代号)。
(2)下列化学方程式正确且能设计成原电池的有______(填字母代号)。
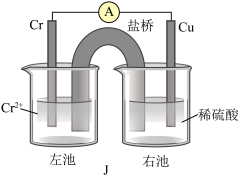
(3)已知Cr比Fe的金属性稍活泼,铜铬构成原电池如装置J所示(盐桥中装的是饱和KCl琼脂溶液)。
则Cr为______ 极(填“正”或“负”),盐桥中 移向
移向______ (填“左池”或“右池”),盛稀硫酸烧杯中的现象为______ 。
(4)甲、乙两同学利用原电池反应检测金属的活动性顺序,设计如下实验装置。
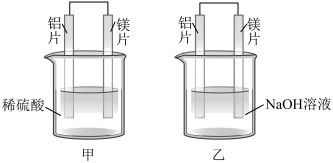
甲装置用______ (填“铝片”或“镁片”)作负极,两同学实验现象的不同之处为______ ,由此得出不能简单根据金属的活动性来判断原电池的正负极的结论,正确的判断方法是______ 。
(1)现有下列装置:

其中,能构成原电池的是
(2)下列化学方程式正确且能设计成原电池的有______(填字母代号)。
A. |
B.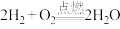 |
C.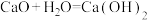 |
D. |
则Cr为
 移向
移向
(4)甲、乙两同学利用原电池反应检测金属的活动性顺序,设计如下实验装置。

甲装置用
您最近一年使用:0次
2 . 下列有关实验操作、现象和所得结论均正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向2mL0.1mol/LNaCl溶液中加入过量的 溶液后,再加1mL0.1mol/LNaI,出现黄色沉淀。 溶液后,再加1mL0.1mol/LNaI,出现黄色沉淀。 | Ksp(AgCl)>Ksp(AgI) |
| B | 将镁片和铝片用导线连接后插入NaOH溶液中,镁片表面产生气泡 | 该装置构成了原电池,铝片做负极。 |
| C | 向某溶液中加入稀NaOH溶液,用湿润的红色石蕊试纸检验,无明显现象 | 溶液中一定无 |
| D | 向 溶液中通入 溶液中通入 和X气体,产生白色沉淀 和X气体,产生白色沉淀 | 气体X一定具有强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 某实验小组为探究CuSO4与Na2SO3反应后的产物,做如下探究实验。
【查阅资料】
①Cu2O为砖红色固体,不溶于水;
②Cu2SO3为黄色固体,不溶于水;
③[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
实验1:①向2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃ 2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol∙L-1的Na2SO3溶液中滴加0.2mol∙L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)S元素在元素周期表中的位置为_______ 。N、O、S三种元素原子的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:_______ 。
(3)经检验,实验2所得溶液中有大量 、
、 生成。该实验中Cu2+表现
生成。该实验中Cu2+表现_______ 性,写出该实验中反应的离子方程式:_______ 。
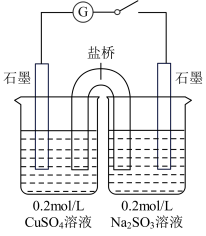
(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做_______ (填“正”或“负”)极,右侧烧杯中发生反应的电极反应式为_______ 。设计实验检验右侧烧杯中生成的阴离子,写出具体操作、现象和结论:_______ 。
【查阅资料】
①Cu2O为砖红色固体,不溶于水;
②Cu2SO3为黄色固体,不溶于水;
③[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
实验1:①向2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃ 2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol∙L-1的Na2SO3溶液中滴加0.2mol∙L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)S元素在元素周期表中的位置为
(2)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:
(3)经检验,实验2所得溶液中有大量
 、
、 生成。该实验中Cu2+表现
生成。该实验中Cu2+表现(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做

您最近一年使用:0次
4 . 能源是现代文明的原动力,电池与我们的生活和生产密切相关。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_______(填字母)。
(2)下图为原电池装置示意图:
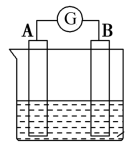
①若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式:_______ ,反应过程中溶液的酸性_______ (填“增强”、“减弱”或“不变”)。一段时间后,当电池中放出1.68 L(标准状况)气体时,电路中有_______ 个电子通过了导线(用NA表示阿伏加德罗常数的值)。
②若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为_______ (填“正极”或“负极”);写出该电极的电极反应式:_______ 。
③燃料电池是一种具有应用前景的绿色电源, 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是_______ (填“正极”或“负极”),若线路中转移2 mol电子,则该燃料电池理论上消耗的 在标准状况下的体积为
在标准状况下的体积为_______ L。

④为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是_______ (填序号)。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_______(填字母)。
A. | B. |
C. | D. |

①若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式:
②若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为
③燃料电池是一种具有应用前景的绿色电源,
 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是 在标准状况下的体积为
在标准状况下的体积为
④为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是
| 方案 | 现象或产物 |
A.将铁片置于 溶液中 溶液中 | 铁片上有亮红色物质析出 |
| B.将铁丝和铜丝分别在氯气燃烧 | 产物分别为 和 和 |
| C.将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| D.将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连 | 铁片溶解,铜片上有气泡产生 |
您最近一年使用:0次
5 . 对如图所示装置实验现象的描述正确的是
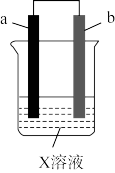

| a电极 | b电极 | X溶液 | 实验现象 | |
| A | 石墨 | 石墨 | CuCl2 | a极质量增加,b极放出无色气体 |
| B | 石墨 | Fe | 乙醇 | a极质量增加,b极放出无色气体 |
| C | Cu | Fe | CuSO4 | a极质量增加,b极质量减少 |
| D | 石墨 | 石墨 | HCl | a、b极都放出无色气体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-12-05更新
|
237次组卷
|
4卷引用:河南省濮阳市范县第一中学2021-2022学年高一下学期期中检测化学试题
6 . 原电池是将化学能转化为电能的装置,某兴趣小组利用数据采集器和传感器等仪器对原电池进行实验探究。
I.能量变化探究
将上表的现象和结论补充完整
(1)_____________
(2)__________ 、__________
II.原电池电压影响因素的测定
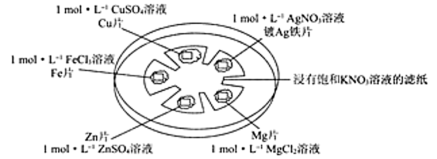
如图所示,在培养皿中进行微型实验,用浸有饱和KNO3溶液的滤纸充当盐桥,在滤纸间隔位置放置金属片,并滴三滴相应溶液,用电压传感器的两个探头分别与不同的金属表面接触形成闭合回路,测定电压。
(3)准确配制一定物质的量浓度的溶液时,操作X应在__________ (填字母)之间。
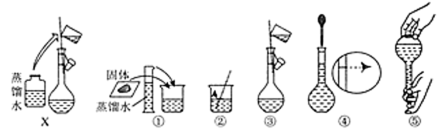
A.②③ B.③④ C.④⑤
(4)以上五种金属的活动性由活泼到不活泼的顺序为_________________ 。
(5)实验条件下,连接不同金属片时所得数据见下表,表中Y极代表__________ (填“正”或“负”)极,预测表中Ag和Zn相连接时,测得电压的数值a可能的范围为____________ ;Fe和Mg相连接时,Z极的电极反应式为__________ ,Y极的电极反应式为____________ 。
I.能量变化探究
| 实验操作 | 数据及图象 | 现象与结论 |
| 将60mL1mol/LCuSO4溶液置于100mL烧杯中,向其中加入1g镁粉 | 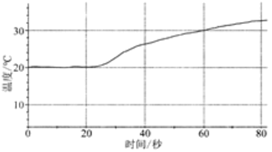 | (1)反应过程中,化学能直接转化为 能; |
| 将60mL1mol/LCuSO4溶液置于100mL烧杯中,平行插入铜片和镁片,与电流传感器形成闭合回路 | 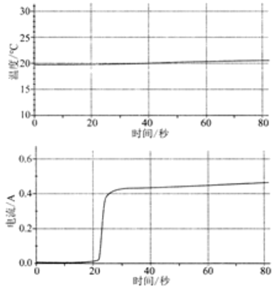 | (2)体系温度变化很小,原因是 ;反应过程中,镁片和铜片的质量变化分别为: ; |
(1)
(2)
II.原电池电压影响因素的测定
如图所示,在培养皿中进行微型实验,用浸有饱和KNO3溶液的滤纸充当盐桥,在滤纸间隔位置放置金属片,并滴三滴相应溶液,用电压传感器的两个探头分别与不同的金属表面接触形成闭合回路,测定电压。

(3)准确配制一定物质的量浓度的溶液时,操作X应在

A.②③ B.③④ C.④⑤
(4)以上五种金属的活动性由活泼到不活泼的顺序为
(5)实验条件下,连接不同金属片时所得数据见下表,表中Y极代表
| Y极 | Z极 | 测得电压/V |
| Ag | Fe | 1.009 |
| Ag | Zn | a |
| Ag | Mg | 2.114 |
| Fe | Zn | 0.473 |
| Fe | Mg | 1.111 |
| Zn | Mg | 0.636 |
您最近一年使用:0次
名校
解题方法
7 . “水”电池是一种利用淡水与海水之间含盐量差别进行发电的电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,如图以“水”电池为电源电解酸性FeCl2溶液,X电极附近溶液先变黄,下列有关分析不正确的是( )
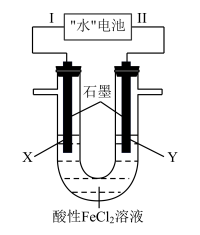

| A.该装置只涉及两种能量之间的转化 |
| B.在线路中安装电压调节装置,可通过现象判断Fe2+和Cl-的还原性强弱 |
| C.“水”电池内Na+不断向正极移动 |
| D.Ⅱ为负极,其电极反应式为Ag+Cl--e-=AgCl |
您最近一年使用:0次
2020-07-08更新
|
72次组卷
|
3卷引用:河南省许昌市第三高级中学2019-2020学年高一下学期期末考试化学试题
名校
解题方法
8 . 根据题中提供的信息,请回答下列问题:
(1)学习原电池原理后,小江同学根据反应 设计了一个原电池并得到老师的肯定,则小江同学选用的负极材料是
设计了一个原电池并得到老师的肯定,则小江同学选用的负极材料是______ ,正极材料可能是______ (填一种)。
(2)小河同学设计了如图所示的原电池,利用不同的电解质溶液进行实验。______ 。
②当以NaOH溶液作为电解质溶液时,电流表指针也发生了偏转,若负极失去1mol电子,理论上负极的质量变化为______ g。
(3)燃料电池是一种高效化学电池,以稀硫酸为电解质溶液的氢氧燃料电池的工作原理如图所示,a和b都是Pt电极(惰性电极)。______ 。
②该电池工作时,电解质溶液中 的移动方向是
的移动方向是______ 。(填“a向b”或“b向a”,下同),外电路中电子的流动方向是______ 。
③若将a极通入的气体换为 ,同时将电解质溶液换为NaOH溶液,则a极的电极反应式为
,同时将电解质溶液换为NaOH溶液,则a极的电极反应式为______ 。当a极有1mol 发生反应时,理论上b极参加反应的氧气在标准状况下的体积为
发生反应时,理论上b极参加反应的氧气在标准状况下的体积为______ L。
(4)小海同学在做氢气的制备实验时,用锌粒和稀硫酸为原料,结果发现反应速率较慢。其他同学给出以下建议,其中能加快制备 的反应速率的有______(填字母)。
的反应速率的有______(填字母)。
(1)学习原电池原理后,小江同学根据反应
 设计了一个原电池并得到老师的肯定,则小江同学选用的负极材料是
设计了一个原电池并得到老师的肯定,则小江同学选用的负极材料是(2)小河同学设计了如图所示的原电池,利用不同的电解质溶液进行实验。

②当以NaOH溶液作为电解质溶液时,电流表指针也发生了偏转,若负极失去1mol电子,理论上负极的质量变化为
(3)燃料电池是一种高效化学电池,以稀硫酸为电解质溶液的氢氧燃料电池的工作原理如图所示,a和b都是Pt电极(惰性电极)。

②该电池工作时,电解质溶液中
 的移动方向是
的移动方向是③若将a极通入的气体换为
 ,同时将电解质溶液换为NaOH溶液,则a极的电极反应式为
,同时将电解质溶液换为NaOH溶液,则a极的电极反应式为 发生反应时,理论上b极参加反应的氧气在标准状况下的体积为
发生反应时,理论上b极参加反应的氧气在标准状况下的体积为(4)小海同学在做氢气的制备实验时,用锌粒和稀硫酸为原料,结果发现反应速率较慢。其他同学给出以下建议,其中能加快制备
 的反应速率的有______(填字母)。
的反应速率的有______(填字母)。| A.将稀硫酸换成质量分数为98%的浓硫酸 | B.向反应液中滴入几滴硫酸铜溶液 |
| C.改换合适的装置并适当加热 | D.将锌粒换成质量相等的锌粉 |
您最近一年使用:0次
名校
解题方法
9 . 乙炔制乙烯是煤化工路线的重要途径之一,如图是利用电化学装置制备 的工作原理示意图,下列说法正确的是
的工作原理示意图,下列说法正确的是
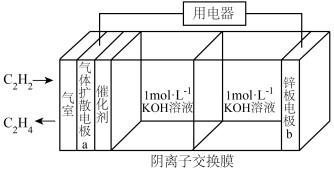
 的工作原理示意图,下列说法正确的是
的工作原理示意图,下列说法正确的是
| A.电极电势:a极<b极 |
| B.电子移动方向:电极b→用电器→电极a→KOH溶液→电极b |
C.电极a上的电极反应式为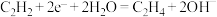 |
| D.放电一段时间后,正极室溶液pH不会发生变化 |
您最近一年使用:0次
2024-01-31更新
|
104次组卷
|
2卷引用:河南省南阳市桐柏县实验高中2024届高三上学期阶段检测化学试题(12月)
解题方法
10 . 浓差电池是一种利用电解质溶液浓度差产生电势差而形成的电池。理论上当电解质溶液的浓度相等时停止放电。图1为浓差电池,图2为电渗析法制备磷酸二氢钠,用浓差电池作电源完成电渗析法制备磷酸二氢钠。下列说法错误的是
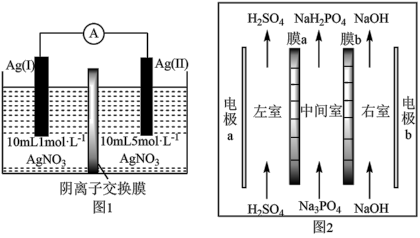

| A.电极a应与Ag(II)相连 |
| B.电渗析装置中膜a为阳离子交换膜 |
| C.电池从开始到停止放电,理论上可制备2.4gNaH2PO4 |
| D.电渗析过程中左、右室中H2SO4和NaOH的浓度均增大 |
您最近一年使用:0次



