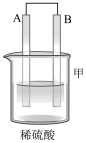
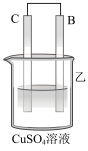
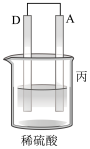
1 . 用如图所示装置进行相应实验,能达到实验目的的是
| 选项 | A | B | C | D |
| 装置 | 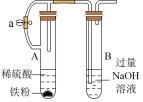 |  | 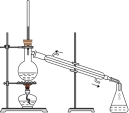 | 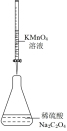 |
| 目的 | 制取 沉淀 沉淀 | 将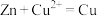 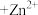 设计成原电池装置 设计成原电池装置 | 分离苯和硝基苯 | 测定 溶液的物质的量浓度 溶液的物质的量浓度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-18更新
|
1279次组卷
|
4卷引用:湖北省2022届高三5月联考化学试题
湖北省2022届高三5月联考化学试题(已下线)专题11 化学实验基础-三年(2020-2022)高考真题分项汇编青海省西宁市城西区青海师范大学附属实验中学2022-2023学年高二上学期12月月考化学试题 吉林省洮南市第一中学2022-2023学年高二上学期期末考试化学试题
解题方法
2 . 在通风橱中进行下列实验:
下列说法不正确的是
| 步骤 | 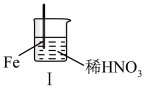 | 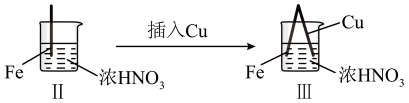 | |
| 现象 | Fe表面产生大量无色气泡,液面上方由无色变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
A.Ⅰ中发生反应的化学方程式: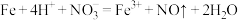 |
| B.将Ⅱ中的铁棒换成铝棒,现象几乎相同 |
| C.对比Ⅰ、Ⅱ中现象,说明物质的浓度不同,其化学性质可能不同 |
D.Ⅲ装置可形成原电池,其中铁为负极,反应式为 |
您最近一年使用:0次
名校
解题方法
3 . 某科学探究小组为探究电化学原理,设计了如图所示的装置进行探究实验。下列对实验中观察到的现象或相关结论的叙述不正确的是
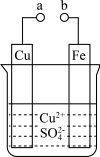
| A.a和b不连接时,铁片上有红色的铜析出,该装置不能形成原电池 |
| B.a和b用导线连接时,铜片为正极 |
C.无论a和b是否连接,反应的本质相同,铁片均会被氧化,溶液中均有 生成 生成 |
D.a和b用导线连接时,溶液中的 应向铁电极移动且能更快地析出铜 应向铁电极移动且能更快地析出铜 |
您最近一年使用:0次
2023-04-18更新
|
250次组卷
|
2卷引用:湖北省武汉市重点中学5G联合体2022-2023学年高一下学期期中考试化学试题
名校
解题方法
4 . 化学反应与能量变化对人类生产、生活有重要的意义。回答下列问题:
(1)用A、B、C、D四种金属按如表所示的装置进行实验。
①装置甲中负极为_______ (填“A”或“B”)。
②装置乙中正极的电极反应式为_______ 。
③装置丙中溶液的pH_______ (填“变大”“变小”或“不变”)。
④四种金属的活动性由强到弱的顺序是_______ 。
(2)北京冬奥会基本实现100%绿电供应和碳中和,利用 和
和 在光催化酶作用下可以高效合成甲醇(
在光催化酶作用下可以高效合成甲醇( )。
)。
①写出甲醇燃烧的化学方程式:_______ ,
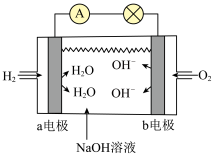
②氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:
a电极是_______ 极,此时b电极发生反应的电极反应式是_______ 。
(1)用A、B、C、D四种金属按如表所示的装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属的活动性由强到弱的顺序是
(2)北京冬奥会基本实现100%绿电供应和碳中和,利用
 和
和 在光催化酶作用下可以高效合成甲醇(
在光催化酶作用下可以高效合成甲醇( )。
)。①写出甲醇燃烧的化学方程式:
②氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:
a电极是

您最近一年使用:0次
2023-04-16更新
|
246次组卷
|
3卷引用:湖北省宜昌市协作体2022-2023学年高一下学期期中考试化学试题
解题方法
5 . 由下列实验操作和现象得出的结论不正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向Co2O3中滴加浓盐酸 | 产生黄绿色气体 | 氧化性:Cl2<Co2O3 |
| B | 在镁、铝为电极,氢氧化钠为电解质的原电池装置 | 镁表面有气泡 | 金属活动性:Al>Mg |
| C | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟 | X可能是浓盐酸 |
| D | 将10mL2mol/L的KI溶液与1mL1mol/LFeCl3溶液混合充分反应后滴加KSCN溶液 | 溶液颜色变红 | KI与FeCl3的反应具有可逆性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-09-24更新
|
173次组卷
|
2卷引用:湖北省龙泉中学、荆州中学、宜昌一中2021届高三9月联考化学试题
6 . 电化学技术的发展是近年来科技的热点。请结合电化学知识回答下列问题:
(1)如图甲所示的电化学装置。盐桥为浸泡了饱和氯化钾溶液的琼脂。反应一段时间,向两烧杯中分别滴加几滴酚酞,___________ (填“m”或“ 烧杯中溶液变红,盐桥中的K+向
烧杯中溶液变红,盐桥中的K+向___________ (填“m”或“n”)烧杯移动。 溶液(a、b电极均为石墨电极),可以制得
溶液(a、b电极均为石墨电极),可以制得 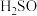 4和NaOH。
4和NaOH。___________ 。
②电解池中同时制备 和NaOH的总反应为
和NaOH的总反应为___________ 。
③d膜为___________ (填“阳”或“阴”)离子交换膜。
④当电解池中产生标准状况下22.4L H2时,理论上正极区CuSO4浓度变为___________ mol/L。
⑤从电池开始工作到停止放电,制备NaOH的质量为204g。若该电化学装置的工作效率= 。则该过程的工作效率为
。则该过程的工作效率为___________ 。
(1)如图甲所示的电化学装置。盐桥为浸泡了饱和氯化钾溶液的琼脂。反应一段时间,向两烧杯中分别滴加几滴酚酞,
 烧杯中溶液变红,盐桥中的K+向
烧杯中溶液变红,盐桥中的K+向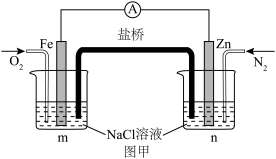
 溶液(a、b电极均为石墨电极),可以制得
溶液(a、b电极均为石墨电极),可以制得 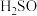 4和NaOH。
4和NaOH。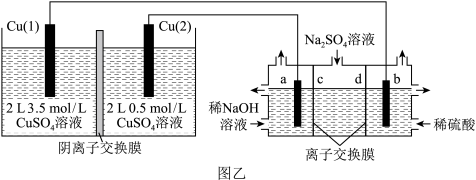
②电解池中同时制备
 和NaOH的总反应为
和NaOH的总反应为③d膜为
④当电解池中产生标准状况下22.4L H2时,理论上正极区CuSO4浓度变为
⑤从电池开始工作到停止放电,制备NaOH的质量为204g。若该电化学装置的工作效率=
 。则该过程的工作效率为
。则该过程的工作效率为
您最近一年使用:0次
名校
解题方法
7 . 某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
①通过实验2和3,可得出原电池的形成条件是______________________________ 。
②通过实验1和3,可得出原电池的形成条件是______________________________ 。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________ 。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________ 。
Cu棒:______________________________ 。
(3)实验3的电流是从________ 棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________ g。
(1)请填写有关实验现象并得出相关结论。
| 编号 | 实验装置 | 实验现象 |
| 1 | 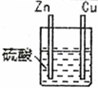 | 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
| 2 | 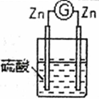 | 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
| 3 | 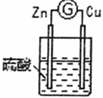 | 铜棒表面的现象是 |
①通过实验2和3,可得出原电池的形成条件是
②通过实验1和3,可得出原电池的形成条件是
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:
Cu棒:
(3)实验3的电流是从
您最近一年使用:0次
2018-07-16更新
|
642次组卷
|
6卷引用:湖北利川市第五中学2019-2020学年高一下学期期末考试化学试题
名校
解题方法
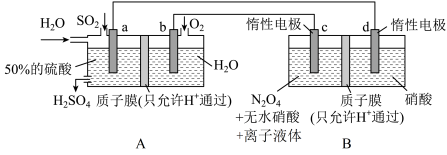
8 . 硝化剂可在化学反应中向有机化合物中引入硝基、硝酸酯基 是一种绿色硝化剂。有人设想利用工业废气
是一种绿色硝化剂。有人设想利用工业废气 ,依据电化学原理制备
,依据电化学原理制备 和
和 。装置图如下,下列说法
。装置图如下,下列说法不正确 的是
 是一种绿色硝化剂。有人设想利用工业废气
是一种绿色硝化剂。有人设想利用工业废气 ,依据电化学原理制备
,依据电化学原理制备 和
和 。装置图如下,下列说法
。装置图如下,下列说法
A.装置 可将电能转化为化学能 可将电能转化为化学能 |
B.装置 中H从a极区迁移到b极区 中H从a极区迁移到b极区 |
C.c电极表面生成 ,电极反应式为: ,电极反应式为: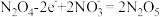 |
D.反应过程中 装置d区 装置d区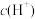 保持不变 保持不变 |
您最近一年使用:0次
2023-10-13更新
|
408次组卷
|
2卷引用:湖北省重点高中智学联盟2023-2024学年高三上学期10月联考化学试题
9 . 锌铜——稀硫酸原电池的装置如图所示,下列叙述错误的是
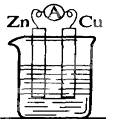

| A.电流从锌片经导线流向铜片 | B.锌是负极,其质量逐渐减小 |
| C.氢离子在铜表面被还原,产生气泡 | D.依据该实验现象可判断锌比铜活泼 |
您最近一年使用:0次
2018-07-04更新
|
114次组卷
|
2卷引用:【全国市级联考】湖北省襄阳市2017-2018学年高一下学期期末调研统一考试化学试题
10 . 盐酸羟胺(化学式为NH3OHCl,其中N为 价)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用如图1所示的方法制备,其电池装置中含Fe的催化电极的电极反应机理如图2所示。下列说法错误的是
价)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用如图1所示的方法制备,其电池装置中含Fe的催化电极的电极反应机理如图2所示。下列说法错误的是
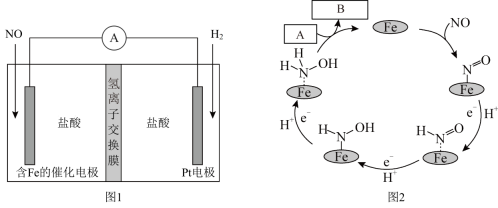
 价)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用如图1所示的方法制备,其电池装置中含Fe的催化电极的电极反应机理如图2所示。下列说法错误的是
价)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用如图1所示的方法制备,其电池装置中含Fe的催化电极的电极反应机理如图2所示。下列说法错误的是
| A.含Fe的催化电极为正极 |
| B.图2中,A为H+,B为NH3OH+ |
| C.电池工作时,每消耗2.24L NO(标准状况下),左室溶液质量增加3.0g |
| D.电池工作时,H+从右室穿过氢离子交换膜向左室迁移 |
您最近一年使用:0次