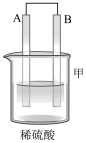
1 . 利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体积已转换为标准状况。下列说法正确的是

| A.a电极的电极材料是铜 |
| B.如果将稀硫酸换为CuSO4溶液,则不能达到实验目的 |
| C.锌与稀硫酸反应时放出的热量对实验测定不产生影响 |
| D.若量筒中收集到aLH2,则电解质溶液中通过了a/11.2mol电子 |
您最近一年使用:0次
2017-06-13更新
|
305次组卷
|
3卷引用:甘肃省天水市第一中学2016-2017学年高一下学期第二次月考(B卷)化学试题
解题方法
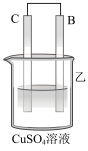
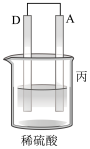
2 . 利用所学电化学反应原理,解决以下问题:
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。
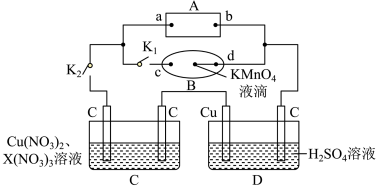
(1)闭合K1,断开K2,通电后,d端显红色,则电源b端为___________ 极,若c、d为惰性电极,检验c端产物的方法为___________ 。滤纸中央KMnO4溶液处发生的现象为___________ 。
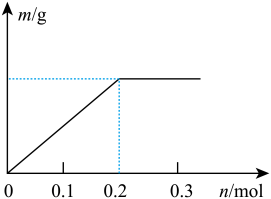
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2, 通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是___________ 。
(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是___________ 。
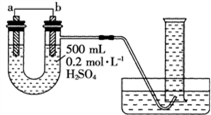
Ⅱ.电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :
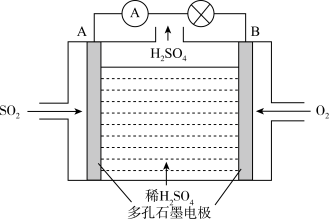
(4)电解质溶液中 离子向
离子向___________ (填“A极”或“B极” )移动。
(5)请写出负极电极反应式___________ 。
(6)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为___________ 。
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。

(1)闭合K1,断开K2,通电后,d端显红色,则电源b端为
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2, 通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是

(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是
Ⅱ.电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :

(4)电解质溶液中
 离子向
离子向(5)请写出负极电极反应式
(6)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为
您最近一年使用:0次
2023-07-25更新
|
89次组卷
|
2卷引用:甘肃省平凉市2022-2023学年高三上学期11月期中化学试题
名校
解题方法
3 . 化学反应与能量变化对人类生产、生活有重要的意义。回答下列问题:
(1)用A、B、C、D四种金属按如表所示的装置进行实验。
①装置甲中负极为_______ (填“A”或“B”)。
②装置乙中正极的电极反应式为_______ 。
③装置丙中溶液的pH_______ (填“变大”“变小”或“不变”)。
④四种金属的活动性由强到弱的顺序是_______ 。
(2)北京冬奥会基本实现100%绿电供应和碳中和,利用 和
和 在光催化酶作用下可以高效合成甲醇(
在光催化酶作用下可以高效合成甲醇( )。
)。
①写出甲醇燃烧的化学方程式:_______ ,
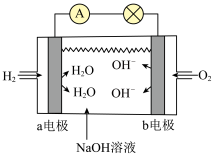
②氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:
a电极是_______ 极,此时b电极发生反应的电极反应式是_______ 。
(1)用A、B、C、D四种金属按如表所示的装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属的活动性由强到弱的顺序是
(2)北京冬奥会基本实现100%绿电供应和碳中和,利用
 和
和 在光催化酶作用下可以高效合成甲醇(
在光催化酶作用下可以高效合成甲醇( )。
)。①写出甲醇燃烧的化学方程式:
②氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:
a电极是

您最近一年使用:0次
2023-04-16更新
|
246次组卷
|
3卷引用:甘肃省武威市天祝一中、民勤一中、古浪一中2022-2023学年高一下学期5月期中考试化学试题
4 . 回答下列问题
I:
(1)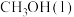 的燃烧热为
的燃烧热为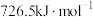 ,则表示液态甲醇燃烧热的热化学方程式为
,则表示液态甲醇燃烧热的热化学方程式为___________ 。
II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(2)利用反应 设计成原电池,该原电池的电解质溶液为
设计成原电池,该原电池的电解质溶液为___________ ,若开始时两电极质量相等,当电路中转移0.2mol电子后,两电极的质量差___________ g。
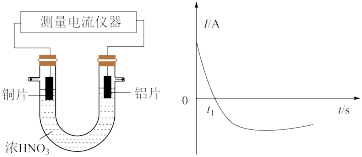
(3)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了下图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中 时刻之前,正极反应式为
时刻之前,正极反应式为___________ , 时刻之后,Cu电极是
时刻之后,Cu电极是___________ (填“正极”或“负极”)。据以上现象,最终得出结论:在原电池中,构成原电池的负极不一定是较活泼的金属材料。
III.现在容积为2L的恒温密闭容器中,充入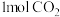 和
和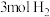 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。
(4)下列说法正确的是___________ 。
A.使用催化剂可以增大反应速率,提高生产效率
B.反应达到平衡后,反应不再进行
C.通过改变反应条件,能改变该反应进行的限度,使 全部转化为
全部转化为
(5)达平衡时, 的转化率为
的转化率为___________ 。
I:
(1)
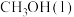 的燃烧热为
的燃烧热为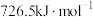 ,则表示液态甲醇燃烧热的热化学方程式为
,则表示液态甲醇燃烧热的热化学方程式为II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

(2)利用反应
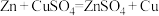 设计成原电池,该原电池的电解质溶液为
设计成原电池,该原电池的电解质溶液为(3)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了下图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中
 时刻之前,正极反应式为
时刻之前,正极反应式为 时刻之后,Cu电极是
时刻之后,Cu电极是III.现在容积为2L的恒温密闭容器中,充入
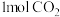 和
和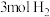 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。| 时间 | 0min | 3min | 6min | 9min | 12min |
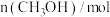 | 0 | 0.50 | 0.65 | 0.75 | 0.75 |
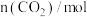 | 1 | 0.50 | 0.35 | A | 0.25 |
A.使用催化剂可以增大反应速率,提高生产效率
B.反应达到平衡后,反应不再进行
C.通过改变反应条件,能改变该反应进行的限度,使
 全部转化为
全部转化为
(5)达平衡时,
 的转化率为
的转化率为
您最近一年使用:0次
解题方法
5 . 如图所示装置:
(1)若烧杯中溶液为稀硫酸,则观察到的现象为________ 。两极反应式为:正极________ ;负极________ 。该装置将________ 能转化为________ 能,原电池中的H+向______ (Mg、Al)极移动。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________ ,带_______ (正、负)电;总反应方程式为________ 。

(1)若烧杯中溶液为稀硫酸,则观察到的现象为
(2)若烧杯中溶液为氢氧化钠溶液,则负极为
您最近一年使用:0次
名校
6 . 为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:
① 向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
② 向上述稀硫酸中插入铜片,没有看到有气泡生成;
③ 将锌片与铜片上端用导线连接,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快
④ 在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,不正确 的是
① 向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
② 向上述稀硫酸中插入铜片,没有看到有气泡生成;
③ 将锌片与铜片上端用导线连接,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快
④ 在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,
| A.实验①、②说明锌能与稀硫酸反应产生氢气,而铜不能 |
| B.实验③说明发生原电池反应时会加快化学反应速率 |
| C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
| D.实验④说明该装置可形成原电池 |
您最近一年使用:0次
解题方法
7 . 环氧乙烷主要用于生产乙二醇及表面活性剂和乙二醇醚溶剂等,被广泛应用于日用化学品、医药和农药等领域。电化学合成环氧乙烷的装置示意图如下所示:
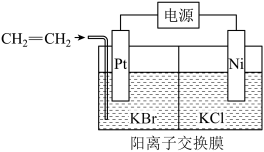
已知:

下列说法不正确的是

已知:


下列说法不正确的是
| A.Pt电极接电源正极 |
B.Pt电极区的反应方程式为: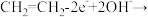  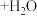 |
| C.制备1mol环氧乙烷,Ni电极区产生标准状况下22.4LH2 |
| D.电解完成后,将阳极区和阴极区溶液混合才可得到环氧乙烷 |
您最近一年使用:0次
23-24高三上·江西南昌·期中
解题方法
8 . 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用向两侧电极分别通入NO和H2,以盐酸为电解质来进行制备,其电池装置(图1)和含Fe的催化电极反应机理(图2)如图。不考虑溶液体积的变化,下列说法正确的是
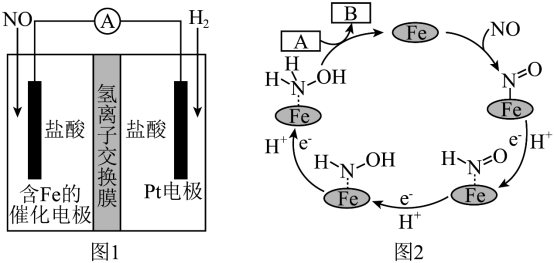

| A.电池工作时,含Fe的催化电极为正极,发生还原反应 |
B.图2中,A为H+和e-,B为 |
| C.电池工作时,每消耗标况下2.24LNO,左室溶液质量增加3.0g |
| D.电池工作一段时间后,正、负极区溶液的pH均下降 |
您最近一年使用:0次