1 . 根据实验目的,下列实验及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 比较金属的活泼性 | Mg、Al做电极,NaOH溶液为离子导体构成原电池,Mg电极附近产生气泡 | Al为正极 |
| B | 探究沉淀的转化 | 向1mL0.01mol•L-1MgCl2溶液中先加入1mL0.05mol•L-1NaOH溶液,再逐滴加入0.1mol•L-1CuSO4溶液,先出现白色沉淀,后又出现蓝色沉淀 | Ksp:Mg(OH)2>Cu(OH)2 |
| C | 探究Mg(OH)2溶于铵盐的原理 | 向Mg(OH)2悬浊液中加入少量NH4Cl固体,溶液变澄清 | NH 水解产生的H+中和Mg(OH)2溶解平衡产生的OH-,使溶解平衡正向移动 水解产生的H+中和Mg(OH)2溶解平衡产生的OH-,使溶解平衡正向移动 |
| D | 比较H2SO3和H2CO3的Ka2 | 测定浓度均为0.1mol•L-1的Na2SO3和Na2CO3溶液的pH值,前者小于后者 | Ka2:H2SO3>H2CO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 科创小组设计下图装置探究铝片做电极材料时的原电池反应并进行实验、记录。
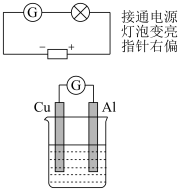
实验1: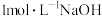
实验2:煮沸冷却后的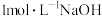
根据上述实验推测,下列说法错误的是

实验1:
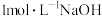
实验2:煮沸冷却后的
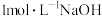
| 编号 | 实验1 | 实验2 |
| 实验现象 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
A.上述两实验中,开始时铜片表面得电子的物质是 |
| B.铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关 |
C.铜片表面产生的气泡为 |
| D.若将铜片换成镁条,则电流计指针先向左偏转后向右偏转,镁条表面有气泡逸出 |
您最近一年使用:0次
名校
解题方法
3 . 某化学兴趣小组欲探究a,b,c,d四种金属的活动性大小顺序,利用实验室现有材料和试剂进行实验,组装了如图所示的装置(电流表指针偏向正极,电解质溶液足量)。请回答下列问题:
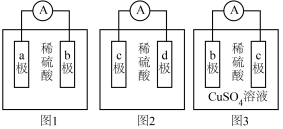
(1)观察到图1装置中的电流表指针偏向b极,说明a极为______ (填“正极”或“负极”),b极上发生的电极反应为______ 。
(2)观察到图2装置中的c极上有气泡生成,可观察到d极上的现象为______ 。
(3)图3装置中的电流表指针偏向c极,若b极为Fe电极,则b极上发生的电极反应为______ ,当该电路中转移0.4mole-时,______ (填“b”或“c”)极质量增重______ g。
(4)通过以上实验装置______ (填“能”或“不能”)比较出四种金属的活动性大小顺序,理由是______ 。

(1)观察到图1装置中的电流表指针偏向b极,说明a极为
(2)观察到图2装置中的c极上有气泡生成,可观察到d极上的现象为
(3)图3装置中的电流表指针偏向c极,若b极为Fe电极,则b极上发生的电极反应为
(4)通过以上实验装置
您最近一年使用:0次
4 . Ⅰ.由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是_______ 。
(2)装置乙中正极的电极反应式是_______ 。
(3)装置丙中溶液的pH变化是_______ 。
(4)四种金属活动性由强到弱的顺序是_______ 。
Ⅱ.今有下列物质:
①甲烷 ②乙烷 ③乙烯 ④苯 ⑤苯乙烯 ⑥分馏汽油
(5)常温下呈气态的是_______ 。
(6)属于芳香烃的是_______ 。
(7)能与溴水反应而使溴水褪色的是_______ ,由于萃取作用而使溴水褪色的是_______ 。
(8)能使酸性高锰酸钾溶液褪色的是_______ 。
| 装置 | 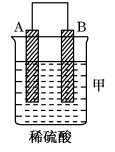 | 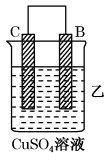 | 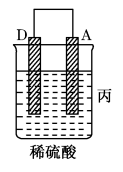 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是
(2)装置乙中正极的电极反应式是
(3)装置丙中溶液的pH变化是
(4)四种金属活动性由强到弱的顺序是
Ⅱ.今有下列物质:
①甲烷 ②乙烷 ③乙烯 ④苯 ⑤苯乙烯 ⑥分馏汽油
(5)常温下呈气态的是
(6)属于芳香烃的是
(7)能与溴水反应而使溴水褪色的是
(8)能使酸性高锰酸钾溶液褪色的是
您最近一年使用:0次
名校
解题方法
5 . 某小组同学实验验证“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(1)实验验证
实验I:将0.0100mol/LAg2SO4溶液与0.0400mo/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入0.0100mol/LFe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:_______ 。
②Ⅱ中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因为_______ 。
综合上述实验,证实“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(2)采用电化学装置进行验证。
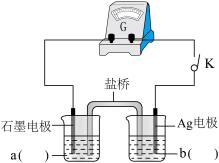
小组同学设计如上图电化学装置进行实验:
i.按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为_______ 溶液;b为_______ 溶液;(写a、b化学式)
ii.再向左侧烧杯中滴加较浓的_______ 溶液,产生的现象为_______ 。表明“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。(1)实验验证
实验I:将0.0100mol/LAg2SO4溶液与0.0400mo/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入0.0100mol/LFe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:
②Ⅱ中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因为
综合上述实验,证实“Ag++Fe2+
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。(2)采用电化学装置进行验证。

小组同学设计如上图电化学装置进行实验:
i.按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为
ii.再向左侧烧杯中滴加较浓的
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
您最近一年使用:0次
2023-08-20更新
|
204次组卷
|
2卷引用:山东省青岛第一中学2023-2024学年高二上学期10月月考化学试题
6 . 化学电源广泛地应用于现代社会的生产和生活。请回答下列问题:
(1)原电池是一种化学能转变为电能的装置,所以原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是___________(填字母)。
(2)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图两个实验,已知两个实验除了是否有导线连接两个金属棒外,其余均相同。

①该同学设计这两个实验的目的是___________ 。
②有关反应一段时间后的实验现象,下列说法正确的是___________ ( 填字母)。
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温。
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比1慢
(3)若将用导线相连在一起,总质量为80.00 g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g,则装置工作时锌片上的电极反应式为___________ ,工作时间内装置所产生氢气的体积为 ___________ L(标准状况)。
(1)原电池是一种化学能转变为电能的装置,所以原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是___________(填字母)。
| A.CaO+H2O=Ca(OH)2 |
B.C+CO2 2CO 2CO |
| C.NaOH+HCl=NaCl+H2O |
| D.2FeCl3+Cu=2FeCl2+CuCl2 |

①该同学设计这两个实验的目的是
②有关反应一段时间后的实验现象,下列说法正确的是
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温。
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比1慢
(3)若将用导线相连在一起,总质量为80.00 g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g,则装置工作时锌片上的电极反应式为
您最近一年使用:0次
2022-05-28更新
|
984次组卷
|
5卷引用:山东省济宁市曲阜孔子高级中学2022-2023学年高一下学期4月月考化学试题
山东省济宁市曲阜孔子高级中学2022-2023学年高一下学期4月月考化学试题山西省运城市2021-2022学年高一下学期5月联考化学试题(已下线)化学(人教版2019B卷)-学易金卷:2022-2023学年高一下学期期中考前必刷卷第六章 化学反应与能量(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第六章 化学反应与能量【单元测试B卷】
名校
解题方法
7 . “水”电池是一种利用淡水与海水之间含盐量差别进行发电的电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,如图以“水”电池为电源电解酸性FeCl2溶液,X电极附近溶液先变黄,下列有关分析不正确的是( )
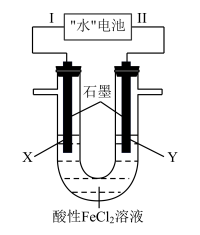

| A.该装置只涉及两种能量之间的转化 |
| B.在线路中安装电压调节装置,可通过现象判断Fe2+和Cl-的还原性强弱 |
| C.“水”电池内Na+不断向正极移动 |
| D.Ⅱ为负极,其电极反应式为Ag+Cl--e-=AgCl |
您最近一年使用:0次
2020-07-08更新
|
72次组卷
|
3卷引用:山东省鄄城县第一中学2022-2023学年高一下学期5月月考化学试题
名校
解题方法
8 . 在下图所示的装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有一滴KMnO4;电源有a、b两极。若在A、B中充满0.01 mol/L 的KOH溶液后倒立于同浓度的KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如下图所示,则:
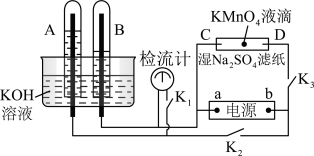
(1)断开K1,闭合K2、K3,通直流电,试管B中产生的气体为_________ (填化学式)。
(2)在Na2SO4溶液浸湿的滤纸条中部的KMnO4处现象为_____________ 。
(3)断开K1,闭合K2、K3,通直流电较长一段时间后,KOH溶液pH变__________ (填“变大”“变小”或“不变”)。
(4)电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,检流计有指数,此时该装置A试管中电极上发生的反应为_____________

(1)断开K1,闭合K2、K3,通直流电,试管B中产生的气体为
(2)在Na2SO4溶液浸湿的滤纸条中部的KMnO4处现象为
(3)断开K1,闭合K2、K3,通直流电较长一段时间后,KOH溶液pH变
(4)电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,检流计有指数,此时该装置A试管中电极上发生的反应为
您最近一年使用:0次
2019-11-20更新
|
157次组卷
|
2卷引用:山东省师范大学附属中学2019-2020学年高二上学期第五次学分认定考试化学试题
名校
解题方法
9 . 全钒液流电池是化学储能领域的一个研究热点,储能容量大、使用寿命长,利用该电池电解处理含 的废水制备硝酸和氨水的原理如图所示,
的废水制备硝酸和氨水的原理如图所示, 电极均为惰性电极。
电极均为惰性电极。
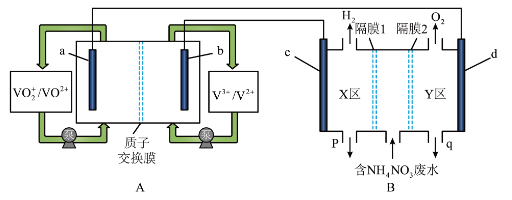
回答下列问题:
(1) 电极为
电极为___________ (填“正极”或“负极”), 电极反应式为
电极反应式为___________ 。
(2)隔膜1为___________ 交换膜(填“阴离子”或“阳离子”),q口流出液含有的溶质为___________ (填化学式),d电极的电极反应式为___________ 。
(3)B装置中产生的气体总量为 (标准状况下)时,通过质子交换膜的
(标准状况下)时,通过质子交换膜的  的物质的量为
的物质的量为___________  。
。
 的废水制备硝酸和氨水的原理如图所示,
的废水制备硝酸和氨水的原理如图所示, 电极均为惰性电极。
电极均为惰性电极。
回答下列问题:
(1)
 电极为
电极为 电极反应式为
电极反应式为(2)隔膜1为
(3)B装置中产生的气体总量为
 (标准状况下)时,通过质子交换膜的
(标准状况下)时,通过质子交换膜的  的物质的量为
的物质的量为 。
。
您最近一年使用:0次
10 . (1)下列装置属于原电池的是___________ ;
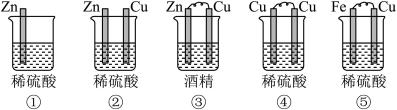
(2)在选出的原电池中,______ 是负极,发生______ (氧化、还原) 反应 ,______ 是正极 ,该极的现象___________________________ ;
(3)在该原电池的内电路中,硫酸根离子移向_________ (正、负)极。
(4)此原电池反应的化学方程式为___________________________ 。

(2)在选出的原电池中,
(3)在该原电池的内电路中,硫酸根离子移向
(4)此原电池反应的化学方程式为
您最近一年使用:0次



