名校
解题方法
1 . (1)为了探究化学反应的热效应,某兴趣小组采用如图1所示装置进行实验:将稀盐酸滴入装入铁粉的试管中,U形管内的现象为_____ ,发生的反应是_____ (填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是_______ (填字母)。
A.盐酸与碳酸氢钠的反应B.CaCO3的分解反应
C.食物的缓慢氧化D.Ba(OH)2•8H2O和NH4Cl的反应
E.H2和Cl2的反应
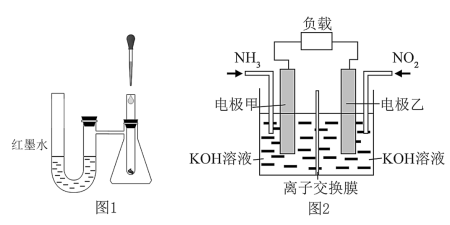
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为_____ 。
A.铝片、铝片B.铜片、铜片C.铝片、铜片D.铜片、铝片
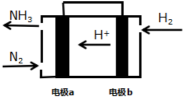
(3)雾霾中含有氮的氧化物,利用反应NO2+NH3→N2+H2O(未配平)制作如图2所示的电池,用以消除氮氧化物的污染。电极甲是_____ 极,电池工作时,OH-定向移向______ 电极(填“甲”或“乙”),写出负极电极反应式:_____ ,若一段时间内测得外电路中有1.2mol电子通过,则负极比正极产生的气体多____ L(标准状况下)。
A.盐酸与碳酸氢钠的反应B.CaCO3的分解反应
C.食物的缓慢氧化D.Ba(OH)2•8H2O和NH4Cl的反应
E.H2和Cl2的反应

(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A.铝片、铝片B.铜片、铜片C.铝片、铜片D.铜片、铝片
(3)雾霾中含有氮的氧化物,利用反应NO2+NH3→N2+H2O(未配平)制作如图2所示的电池,用以消除氮氧化物的污染。电极甲是
您最近一年使用:0次
2 . Ⅰ.一定温度下在某定容容器中发生反应:2A(g)+3B(g)=2C(g),开始时,A的浓度为2mol·L-1,B的浓度为4mol·L-1,2min后,A的浓度减少0.8mol·L-1,则:
(1)v(B)=_______ ,v(C)=_______ 。
(2)在2min末,C的浓度是_______ ,B的浓度是_______ 。
Ⅱ.如图所示的原电池装置中:

(1)_______ (填“铜”或“锌”)作负极。
(2)正极的电极反应式为_______ 。
(3)电子的流向_______ 。
(4)若铜电极上产生了标准状况下11.2L气体,则Zn电极会减轻_______ g。
(1)v(B)=
(2)在2min末,C的浓度是
Ⅱ.如图所示的原电池装置中:

(1)
(2)正极的电极反应式为
(3)电子的流向
(4)若铜电极上产生了标准状况下11.2L气体,则Zn电极会减轻
您最近一年使用:0次
名校
解题方法
3 . 氮的化合物在工业中应用十分广泛。
(1)工业上尿素【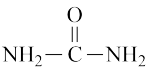 】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=
】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=___
(2)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。
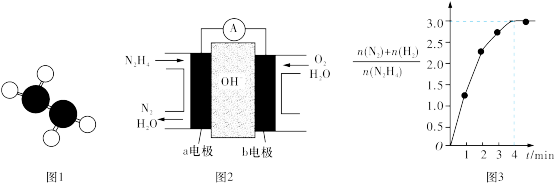
①已知肼的球棍模型如图1所示,试写出肼的电子式:_______ 。
②目前正在研发的一种肼燃料电池的结构如图2所示,_____ (填“a”或“b”)电极为电池的负极。
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应
N2H4(l)⇌N2(g)+2H2(g),测得容器中的[n(N2)+n(H2)]/n(N2H4)与时间的关系如图3所示,则0~4 min内氮气的平均反应速率v(N2)=________ 。
(1)工业上尿素【
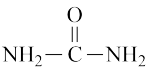 】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=
】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=化学键 | 键能(KJ·mol-1) |
C=O | 728 |
C—N | 305 |
N—H | 389 |
O—H | 464 |
(2)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。

①已知肼的球棍模型如图1所示,试写出肼的电子式:
②目前正在研发的一种肼燃料电池的结构如图2所示,
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应
N2H4(l)⇌N2(g)+2H2(g),测得容器中的[n(N2)+n(H2)]/n(N2H4)与时间的关系如图3所示,则0~4 min内氮气的平均反应速率v(N2)=
您最近一年使用:0次
4 . 1909年,德国化学家哈伯经过反复实验研究发现工业合成氨的可能性。1913年,在德国工程师博施努力下,一个年产7000吨的合成氨工厂建成并投产,合成氨的工业化生产终于实现。因此,哈伯和博施都获得了诺贝尔化学奖。
键能:常温常压下,将1 mol理想气体分子AB拆开为中性气态原子A和B所需要的能量。请回答下列问题:
(1)根据上表中所给数据判断:N2(g)+3H2(g) 2NH3(g)为
2NH3(g)为___________ 热反应(填“放”或“吸”);
(2)下列措施中能加快合成氨反应速率的是___________ ;
A.升高温度 B.使用合适的催化剂 C.分离出生成的氨气
D.增大氮气的浓度 E.扩大容器体积
(3)在一个恒温恒容的密闭容器中,发生可逆反应N2(g)+3H2(g) 2NH3(g),下列情况能说明反应已达到化学平衡状态的是
2NH3(g),下列情况能说明反应已达到化学平衡状态的是___________ ;
A.混合气体的总质量不再改变 B.氨气的质量分数不再改变
C.N2、H2和NH3的物质的量之比为1:3:2 D.容器内压强保持不变
(4)为了提高合成氨的物料利用率和工作效率,科学家们正在制作合成氨原电池。右图为合成氨原电池的原理图,则电极a为___________ 极(填“正”或“负”)。
| 化学键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
键能:常温常压下,将1 mol理想气体分子AB拆开为中性气态原子A和B所需要的能量。请回答下列问题:
(1)根据上表中所给数据判断:N2(g)+3H2(g)
 2NH3(g)为
2NH3(g)为(2)下列措施中能加快合成氨反应速率的是
A.升高温度 B.使用合适的催化剂 C.分离出生成的氨气
D.增大氮气的浓度 E.扩大容器体积
(3)在一个恒温恒容的密闭容器中,发生可逆反应N2(g)+3H2(g)
 2NH3(g),下列情况能说明反应已达到化学平衡状态的是
2NH3(g),下列情况能说明反应已达到化学平衡状态的是A.混合气体的总质量不再改变 B.氨气的质量分数不再改变
C.N2、H2和NH3的物质的量之比为1:3:2 D.容器内压强保持不变
(4)为了提高合成氨的物料利用率和工作效率,科学家们正在制作合成氨原电池。右图为合成氨原电池的原理图,则电极a为

您最近一年使用:0次
2021-05-13更新
|
268次组卷
|
3卷引用:浙江省七彩阳光新高考研究联盟2020-2021学年高一下学期期中联考化学试题
浙江省七彩阳光新高考研究联盟2020-2021学年高一下学期期中联考化学试题(已下线)专题06 化学反应速率和限度【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)浙江省舟山市南海实验高中2021-2022学年高一下学期4月月考化学试题
5 . 原电池是直接把化学能转化为电能的装置。
(1)如图所示:按照构成原电池的基本要素来看,Zn的作用是(填字母,下同)____ ;稀硫酸的作用是________ 。
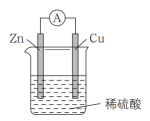
a.负极反应物 b.负极材料 c.正极反应物
d.正极材料 e.离子导体 f.电子导体
(2) ①在Cu-Zn原电池中,Zn片上发生________ 反应(填“氧化”或“还原”)。Cu片上发生的电极反应为________ 。
②外电路中电子流向_____ 极;内电路溶液中SO 移向
移向___ 极。
③能证明化学能转化为电能的实验现象为________ 。
(3)某原电池的总反应为Zn+Cu2+=Cu+Zn2+,该原电池正确的组成是__ 。

(4)从化学的角度分析,原电池装置产生电流的原因是:原电池可将________ ,并通过能导电的物质形成闭合回路,产生电流。
(1)如图所示:按照构成原电池的基本要素来看,Zn的作用是(填字母,下同)

a.负极反应物 b.负极材料 c.正极反应物
d.正极材料 e.离子导体 f.电子导体
(2) ①在Cu-Zn原电池中,Zn片上发生
②外电路中电子流向
 移向
移向③能证明化学能转化为电能的实验现象为
(3)某原电池的总反应为Zn+Cu2+=Cu+Zn2+,该原电池正确的组成是

(4)从化学的角度分析,原电池装置产生电流的原因是:原电池可将
您最近一年使用:0次
解题方法
6 . (1)有①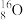 、
、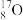 、
、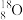 ;②H2、D2、T2;③石墨、金刚石;④
;②H2、D2、T2;③石墨、金刚石;④ 、
、 、
、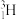 ;四组微粒或物质。互为同位素的是
;四组微粒或物质。互为同位素的是____ (填编号,下同),互为同素异形体的是_____ 。
(2)已知拆开1molH—H键、1molN≡N、1molN—H键分别需要吸收的能量为436kJ、946kJ、391kJ。则由氢气和氮气反应生成1molNH3需要____ (填“放出”或“吸收”)____ kJ能量。
(3)肼(N2H4)又称联氨可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如下图所示,则负极发生的电极反应式为____ 。

(4)若锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25g,铜表面析出了氢气____ L(标准状况),导线中通过____ mol电子。(注:相对原子质量Zn-65)
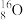 、
、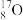 、
、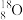 ;②H2、D2、T2;③石墨、金刚石;④
;②H2、D2、T2;③石墨、金刚石;④ 、
、 、
、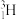 ;四组微粒或物质。互为同位素的是
;四组微粒或物质。互为同位素的是(2)已知拆开1molH—H键、1molN≡N、1molN—H键分别需要吸收的能量为436kJ、946kJ、391kJ。则由氢气和氮气反应生成1molNH3需要
(3)肼(N2H4)又称联氨可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如下图所示,则负极发生的电极反应式为

(4)若锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25g,铜表面析出了氢气
您最近一年使用:0次
名校
解题方法
7 . 把A、B、C、D四种金属按表中装置进行实验。
根据实验现象回答问题:
(1)装置乙中正极的电极反应式是___ 。
(2)装置丙中溶液的酸性___ (填“变大”“变小”或“不变”)。
(3)四种金属活泼性由强到弱的顺序是___ 。
| 装置 | 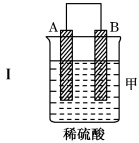 |  | 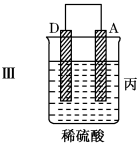 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置乙中正极的电极反应式是
(2)装置丙中溶液的酸性
(3)四种金属活泼性由强到弱的顺序是
您最近一年使用:0次
2021-04-14更新
|
223次组卷
|
3卷引用:湖南省长沙市南雅中学2020-2021学年高一下学期第一次月考化学试题
名校
解题方法
8 . 某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下,设计并进行了以下一系列实验,实验结果记录如下。
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同?__ (填“是”或“否”)。
(2)由实验3完成下列填空:
①铝为__ 极,电极反应式:__ 。
②石墨为__ 极,电极反应式:__ 。
③电池总反应式:__ 。
(3)实验4中铝作负极还是正极?__ ,理由是__ 。写出铝电极的电极反应式:__ 。
(4)解释实验5中电流表指针偏向铝的原因:__ 。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:__ 。
| 编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极(正极或负极)是否相同?
(2)由实验3完成下列填空:
①铝为
②石墨为
③电池总反应式:
(3)实验4中铝作负极还是正极?
(4)解释实验5中电流表指针偏向铝的原因:
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:
您最近一年使用:0次
2021-02-19更新
|
1287次组卷
|
8卷引用:(鲁科版2019)必修第二册 第2章 化学键 化学反应规律 第2节 化学反应与能量转化 第2课时 化学反应能量转化的重要应用——化学电池
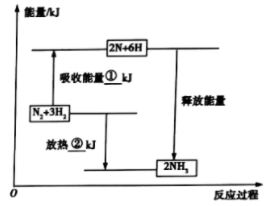
9 . (1)合成氨工业是煤化工产业链中非常重要的一步。已知有一组数据:破坏1mol氮气中的化学键需要吸收946kJ能量;破坏0.5mol氢气中的 键需要吸收218kJ能量;形成氨分子中1mol
键需要吸收218kJ能量;形成氨分子中1mol 键能够释放391kJ能量。图表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值填在下边的横线上。
键能够释放391kJ能量。图表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值填在下边的横线上。
①______ kJ,②_____ kJ。
(2)由A、B、C、D四种金属按如表所示装置进行实验。
根据实验现象回答下列问题:
①装置甲中负极的电极反应式为_______________ 。
②装置乙中正极的电极反应式为_______________ 。
③装置丙中溶液的pH_________ (填“变大”“变小”或“不变”)
④四种金属的活动性由强到弱的顺序是____________ 。
(3)一定温度下,在体积为2L的恒容密闭容器中充入1mol 和3mol
和3mol ,一定条件下发生反应:
,一定条件下发生反应: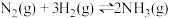 ,测得其中
,测得其中 的物质的量随时间的变化如图所示。
的物质的量随时间的变化如图所示。
从开始反应到 min,氮气的平均反应速率为
min,氮气的平均反应速率为_________ 。
 键需要吸收218kJ能量;形成氨分子中1mol
键需要吸收218kJ能量;形成氨分子中1mol 键能够释放391kJ能量。图表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值填在下边的横线上。
键能够释放391kJ能量。图表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值填在下边的横线上。①

(2)由A、B、C、D四种金属按如表所示装置进行实验。
| 装置 |  | 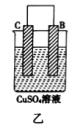 | 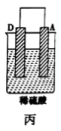 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中负极的电极反应式为
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属的活动性由强到弱的顺序是
(3)一定温度下,在体积为2L的恒容密闭容器中充入1mol
 和3mol
和3mol ,一定条件下发生反应:
,一定条件下发生反应: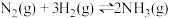 ,测得其中
,测得其中 的物质的量随时间的变化如图所示。
的物质的量随时间的变化如图所示。
从开始反应到
 min,氮气的平均反应速率为
min,氮气的平均反应速率为
您最近一年使用:0次
10 . (1)合成氨工业是煤化工产业链中非常重要的一步。已知有一组数据:破坏1molN2中的 键需要吸收
键需要吸收 能量;破坏
能量;破坏 中的
中的 键需要吸收
键需要吸收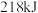 能量;形成
能量;形成 中的
中的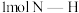 键能释放
键能释放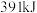 能量。图表示合成氨工业过程中能量的变化,请将图中①②的能量变化的数值填在横线上。
能量。图表示合成氨工业过程中能量的变化,请将图中①②的能量变化的数值填在横线上。
①________________  ,②
,②____________________  。
。

(2)用A、B、C、D四种金属按如表所示的装置进行实验。
根据实验现象回答下列问题:
①装置甲中负极的电极反应式为__________________ 。
②装置乙中正极的电极反应式为________________ 。
③装置丙中溶液的pH________ (填“变大”“变小”或“不变”)。
④四种金属的活动性由强到弱的顺序是________ 。
(3)一定温度下,在体积为 的恒容密闭容器中充入
的恒容密闭容器中充入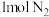 和
和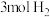 ,发生反应
,发生反应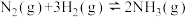 ,测得
,测得 的物质的量随时间的变化如图所示。
的物质的量随时间的变化如图所示。
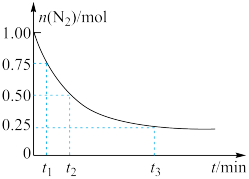
从开始反应到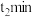 ,用
,用 表示的化学反应速率为
表示的化学反应速率为_________ 。
 键需要吸收
键需要吸收 能量;破坏
能量;破坏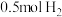 中的
中的 键需要吸收
键需要吸收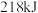 能量;形成
能量;形成 中的
中的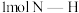 键能释放
键能释放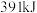 能量。图表示合成氨工业过程中能量的变化,请将图中①②的能量变化的数值填在横线上。
能量。图表示合成氨工业过程中能量的变化,请将图中①②的能量变化的数值填在横线上。①
 ,②
,② 。
。
(2)用A、B、C、D四种金属按如表所示的装置进行实验。
| 装置 |  甲 |  乙 |  丙 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置甲中负极的电极反应式为
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属的活动性由强到弱的顺序是
(3)一定温度下,在体积为
 的恒容密闭容器中充入
的恒容密闭容器中充入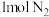 和
和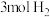 ,发生反应
,发生反应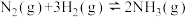 ,测得
,测得 的物质的量随时间的变化如图所示。
的物质的量随时间的变化如图所示。
从开始反应到
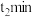 ,用
,用 表示的化学反应速率为
表示的化学反应速率为
您最近一年使用:0次
2020-09-24更新
|
651次组卷
|
3卷引用:陕西省咸阳市武功县普集高级中学2020-2021学年高一下学期第三次月考化学试题



