名校
1 . 铅及其化合物有重要用途,如二氧化铅( )可用于生产铅蓄电池。用方铅矿(主要成分为
)可用于生产铅蓄电池。用方铅矿(主要成分为 ,含少量
,含少量 )为原料生产
)为原料生产 的一种工艺流程如下:
的一种工艺流程如下:

已知:铅能与浓 溶液在通入空气和加热条件下反应生成
溶液在通入空气和加热条件下反应生成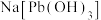 。回答下列问题:
。回答下列问题:
(1)铅元素位于第六周期IVA族,原子序数为82,其原子结构示意图为___________ 。
(2)方铅矿焙烧时生成一种具有漂白性的气体,其分子式为___________ ;焙烧时 未转化为
未转化为 而是生成单质Ag,原因是
而是生成单质Ag,原因是___________ ;上述流程中,制得粗铅的金属冶炼方法的名称是___________ 。
(3)铅与浓氢氧化钠溶液、空气(已去除 )在加热时发生反应的化学方程式为
)在加热时发生反应的化学方程式为___________ ;滤渣1的主要成分为___________ 。
(4)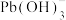 与漂白粉中的有效成分发生反应的离子方程式为
与漂白粉中的有效成分发生反应的离子方程式为___________ 。
(5) 和
和 可分别用于铅蓄电池的负极、正极材料。若以石墨、铅为电极电解
可分别用于铅蓄电池的负极、正极材料。若以石墨、铅为电极电解 溶液制备
溶液制备 和
和 ,则阴极应选用
,则阴极应选用___________ (填“石墨”或“铅”),阳极的电极反应式为___________ 。
 )可用于生产铅蓄电池。用方铅矿(主要成分为
)可用于生产铅蓄电池。用方铅矿(主要成分为 ,含少量
,含少量 )为原料生产
)为原料生产 的一种工艺流程如下:
的一种工艺流程如下:
已知:铅能与浓
 溶液在通入空气和加热条件下反应生成
溶液在通入空气和加热条件下反应生成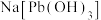 。回答下列问题:
。回答下列问题:(1)铅元素位于第六周期IVA族,原子序数为82,其原子结构示意图为
(2)方铅矿焙烧时生成一种具有漂白性的气体,其分子式为
 未转化为
未转化为 而是生成单质Ag,原因是
而是生成单质Ag,原因是(3)铅与浓氢氧化钠溶液、空气(已去除
 )在加热时发生反应的化学方程式为
)在加热时发生反应的化学方程式为(4)
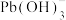 与漂白粉中的有效成分发生反应的离子方程式为
与漂白粉中的有效成分发生反应的离子方程式为(5)
 和
和 可分别用于铅蓄电池的负极、正极材料。若以石墨、铅为电极电解
可分别用于铅蓄电池的负极、正极材料。若以石墨、铅为电极电解 溶液制备
溶液制备 和
和 ,则阴极应选用
,则阴极应选用
您最近一年使用:0次
名校
解题方法
2 . 一碳产品是石油的良好替代品,一碳化学与绿色化工结合可以实现经济与环境的协调发展。甲醇-水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇-水蒸气重整制氢的部分反应过程如图1所示:
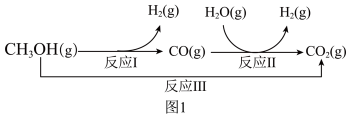
(1)已知一定条件下
反应I:CH3OH(g) ⇌CO(g)+2H2(g) ΔH1=+90.7kJ·mol-1
反应II:H2O(g)+CO(g) ⇌H2(g)+CO2(g) ΔH2=-41.2kJ·mol-1
反应III:CH3OH(g)+H2O(g) ⇌CO2(g)+3H2(g) ΔH3
该条件下反应III的ΔH3=_______ 。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率如图2所示。
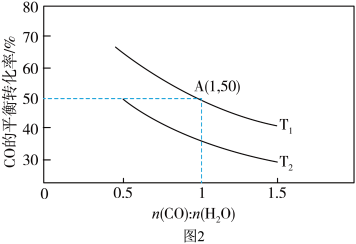
①比较T1、T2的大小,T1_______ T2(填“>”“<”或“=”)。原因为: _______
②T1温度时,按下表数据开始反应建立平衡:
应进行到t时刻时,判断v(正)、v(逆)的大小关系为断v(正)_______ v(逆(填“>“<”或“=”)。
(3)CO2在生产中有着广泛的用途。在弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。
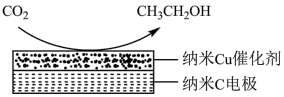
CO2参与反应的一极为_______ (填“阴极”或“阳极”),电极反应式是_______ 。

(1)已知一定条件下
反应I:CH3OH(g) ⇌CO(g)+2H2(g) ΔH1=+90.7kJ·mol-1
反应II:H2O(g)+CO(g) ⇌H2(g)+CO2(g) ΔH2=-41.2kJ·mol-1
反应III:CH3OH(g)+H2O(g) ⇌CO2(g)+3H2(g) ΔH3
该条件下反应III的ΔH3=
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率如图2所示。

①比较T1、T2的大小,T1
②T1温度时,按下表数据开始反应建立平衡:
| CO | H2O | H2 | CO2 | |
| 起始浓度/(mol·L-1) | 2 | 1 | 0 | 0 |
| t时刻浓度/(mol·L-1) | 1.5 | 0.5 | 0.5 | 0.5 |
(3)CO2在生产中有着广泛的用途。在弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。
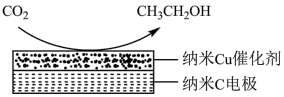
CO2参与反应的一极为
您最近一年使用:0次
解题方法
3 . 乙酸乙酯在工业上有着广泛的用途。科学家以乙烯、乙酸为原料,杂多酸作催化剂制备乙酸乙酯,反应原理为CH2=CH2(g)+CH3COOH(g) CH3COOC2H5(l)
CH3COOC2H5(l)
(1)回答下列问题:
I.2C(s)+2H2(g) CH2=CH2(g) △H1=+52.3
CH2=CH2(g) △H1=+52.3
Ⅱ.2C(s)+2H2(g)+O2(g) CH3COOH(g) △H2=-436.4
CH3COOH(g) △H2=-436.4
Ⅲ.4C(s)+4H2(g)+O2(g CH3COOC2H5(l) △H3=-463.2
CH3COOC2H5(l) △H3=-463.2
以乙烯(g)、乙酸(g)为原料制备乙酸乙酯(l)的反应的热化学方程式为_____ 。
(2)一定条件下,在一个密闭容器中,通入各1mol的乙烯和乙酸气体,发生上述反应。
①若保持温度和压强不变,下列描述能说明反应已达化学平衡的是_____ (填字母)。
A.单位时间内,消耗乙烯和生成乙酸的物质的量相同
B.容器内混合气体的密度不再变化
C. 不再变化
不再变化
D.体系中乙烯和乙酸的转化率相等
②分别在压强P1、P2下,相同时间内测得乙酸乙酯的产率随温度的变化如图。

P1_____ P2(填“>”或“<”),理由是_____ 。A点后乙酸乙酯产率随温度升高反而下降的原因可能是_____ 。A点该反应的压强平衡常数Kp=_____ (用含P1的代数式表示)。
(3)科学家设想通过电化学方法实现乙烯的转化,其原理如图所示(均为惰性电极)。图中b极为_____ 极,M极上的电极反应式为_____ 。

 CH3COOC2H5(l)
CH3COOC2H5(l)(1)回答下列问题:
I.2C(s)+2H2(g)
 CH2=CH2(g) △H1=+52.3
CH2=CH2(g) △H1=+52.3
Ⅱ.2C(s)+2H2(g)+O2(g)
 CH3COOH(g) △H2=-436.4
CH3COOH(g) △H2=-436.4
Ⅲ.4C(s)+4H2(g)+O2(g
 CH3COOC2H5(l) △H3=-463.2
CH3COOC2H5(l) △H3=-463.2
以乙烯(g)、乙酸(g)为原料制备乙酸乙酯(l)的反应的热化学方程式为
(2)一定条件下,在一个密闭容器中,通入各1mol的乙烯和乙酸气体,发生上述反应。
①若保持温度和压强不变,下列描述能说明反应已达化学平衡的是
A.单位时间内,消耗乙烯和生成乙酸的物质的量相同
B.容器内混合气体的密度不再变化
C.
 不再变化
不再变化D.体系中乙烯和乙酸的转化率相等
②分别在压强P1、P2下,相同时间内测得乙酸乙酯的产率随温度的变化如图。

P1
(3)科学家设想通过电化学方法实现乙烯的转化,其原理如图所示(均为惰性电极)。图中b极为

您最近一年使用:0次
解题方法
4 . 以含钴废料(主要成分为Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如图所示:
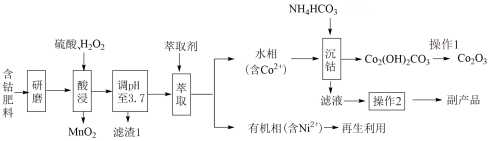
(1)为了提高“酸浸”步骤的浸出率,可采取的措施有_______ (任答一点)。“滤渣1”的化学式为_______ 。
(2)“酸浸”时Co2O3与H2O2反应的化学方程式为_______ 。
(3)“操作2”所得副产品的一种用途为_______ 。 已知该物质的溶液加热到100°C时会分解,该物质的溶解度见表:
操作2是_______ (填字母)。
A.蒸发结晶 B.降温结晶 C.减压蒸发结晶
(4)“沉钴”时温度不能太低也不能太高,原因是_______ 。
(5)“沉钴”步骤中发生反应的离子方程式为_______ 。
(6)已知常温下Ksp(CoC2O4)=6.4×10-8、Ksp(CoCO3)=1.6×10-13,向浓度相同的Na2CO3和Na2C2O4的混合溶液中加入足量CoSO4固体,则所得溶液中c( ):c(
):c( )=
)=_______ 。
(7)有机相提取的Ni2+再生时可用于制备镍氢电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH。则放电时负极的电极反应式为_______ 。

(1)为了提高“酸浸”步骤的浸出率,可采取的措施有
(2)“酸浸”时Co2O3与H2O2反应的化学方程式为
(3)“操作2”所得副产品的一种用途为
| 温度/°C | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 88.0 |
A.蒸发结晶 B.降温结晶 C.减压蒸发结晶
(4)“沉钴”时温度不能太低也不能太高,原因是
(5)“沉钴”步骤中发生反应的离子方程式为
(6)已知常温下Ksp(CoC2O4)=6.4×10-8、Ksp(CoCO3)=1.6×10-13,向浓度相同的Na2CO3和Na2C2O4的混合溶液中加入足量CoSO4固体,则所得溶液中c(
 ):c(
):c( )=
)=(7)有机相提取的Ni2+再生时可用于制备镍氢电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH。则放电时负极的电极反应式为
您最近一年使用:0次
5 . Cl2及其化合物在生产、生活中具有广泛的用途。
(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三 者中所占分数(α)随pH变化的关系如图1所示:
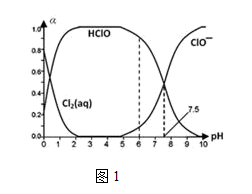
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是_________________ 。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为__________ 。
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应 的化学方程式_________________ 。
(3)工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2.电解时,NaClO3在______ 极(填阴或阳)生成,生成 的电极反应式为
的电极反应式为_________ 。
(4)一定条件下,在水溶液中 1mol Cl-、1mol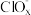 (x=1,2,3,4)的能量大小与化合价的关系如图2所示:
(x=1,2,3,4)的能量大小与化合价的关系如图2所示:

①从能量角度看,C、D、E中最不稳定的离子是_________________ (填离子符号)。
②B→A+D反应的热化学方程式为_________________ (用离子符号表示)。
(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三 者中所占分数(α)随pH变化的关系如图1所示:

①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应 的化学方程式
(3)工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2.电解时,NaClO3在
 的电极反应式为
的电极反应式为(4)一定条件下,在水溶液中 1mol Cl-、1mol
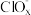 (x=1,2,3,4)的能量大小与化合价的关系如图2所示:
(x=1,2,3,4)的能量大小与化合价的关系如图2所示:
①从能量角度看,C、D、E中最不稳定的离子是
②B→A+D反应的热化学方程式为
您最近一年使用:0次
2019-01-30更新
|
225次组卷
|
6卷引用:2016届广西钦州港经济技术开发区中学高三上学期第二次月考化学试卷



