名校
1 . 氯、氮、硫等及其化合物性质研究。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。写出SO2吸收Br2反应的化学方程式为____ 。
(2)氮氧化物的治理是当前生态环境保护中的重要课题之一。
①从原理上看,NH3可用于治理NO2,该反应在催化剂条件下可实现,写出化学方程式____ 。
②次氯酸盐也可用于脱除NO,主要过程如下:
a.NO+HClO=NO2+HCl b.NO+NO2+H2O 2HNO2 c.HClO+HNO2=HNO3+HCl
2HNO2 c.HClO+HNO2=HNO3+HCl
下列分析正确的是___ 。
A.NO2单独存在不能被次氯酸盐脱除
B.烟气中含有的少量的O2能提高NO的脱除率
C.脱除过程中,次氯酸盐溶液的酸性增强
③电解氧化吸收法:其原理如图所示:
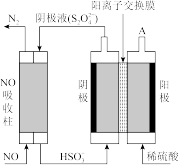
从A口中出来的物质的是____ 。写出电解池阴极的电极反应式____ 。
(3)一种新型催化剂能使NO和CO发生反应2NO+2CO 2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
①上述实验中a=____ ,b=____ 。
②上述实验中,能验证温度对化学反应速率影响规律的一组实验是____ (填实验编号)。

(1)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。写出SO2吸收Br2反应的化学方程式为
(2)氮氧化物的治理是当前生态环境保护中的重要课题之一。
①从原理上看,NH3可用于治理NO2,该反应在催化剂条件下可实现,写出化学方程式
②次氯酸盐也可用于脱除NO,主要过程如下:
a.NO+HClO=NO2+HCl b.NO+NO2+H2O
 2HNO2 c.HClO+HNO2=HNO3+HCl
2HNO2 c.HClO+HNO2=HNO3+HCl下列分析正确的是
A.NO2单独存在不能被次氯酸盐脱除
B.烟气中含有的少量的O2能提高NO的脱除率
C.脱除过程中,次氯酸盐溶液的酸性增强
③电解氧化吸收法:其原理如图所示:

从A口中出来的物质的是
(3)一种新型催化剂能使NO和CO发生反应2NO+2CO
 2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:
2CO2+N2。为验证温度和催化剂的比表面积对化学反应速率的影响规律,某同学设计了如表三组实验。回答下列问题:| 实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| II | 280 | 1.20×10-3 | b | 124 |
| III | 350 | a | 5.80×10-3 | 82 |
②上述实验中,能验证温度对化学反应速率影响规律的一组实验是
您最近一年使用:0次
名校
2 . 用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项所列对应关系均正确的一项是


| 选项 | X极 | 实验前U形管中液体 | 通电后现象及结论 |
| A | 负极 | CuCl2溶液 | b管中有气体逸出 |
| B | 负极 | NaOH溶液 | 溶液pH降低 |
| C | 正极 | Na2SO4溶液 | U形管两端滴入酚酞后,a管中呈红色 |
| D | 正极 | AgNO3溶液 | b管中电极反应式是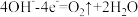 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-04更新
|
3239次组卷
|
15卷引用:四川师范大学附属中学安宁校区2021-2022学年高二上学期期中考试化学试题
四川师范大学附属中学安宁校区2021-2022学年高二上学期期中考试化学试题福建省龙岩第一中学2021-2022学年高二上学期开学考试化学试题(已下线)专题4.2.1 电解原理(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)4.3.2 电解原理的应用-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第4章 电化学基础(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)内蒙古通辽市开鲁县第一中学2021-2022学年高一下学期6月检测化学试题江苏省常熟中学2022-2023学年高二上学期10月份阳光调研化学(选修)试题河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题江苏省常熟市王淦昌高级中学2022-2023学年高二上学期10月月考化学试卷辽宁省辽阳市第二高级中学2022-2023学年高二上学期12月月考化学试题吉林省长春市第五中学2022-2023学年高二上学期期中考试化学试题江苏省连云港市东海县石榴高级中学2022-2023学年高二上学期第一次学情测试化学试题河北省唐山市开滦第二中学2023-2024学年高二上学期第一次月考化学试题江苏省江阴市要塞中学2022-2023学年高二上学期期中考试化学试题吉林省梅河口市第五中学2023-2024学年高二上学期12月月考化学试题
解题方法
3 . 贵金属银有广泛用途。工业上用银锰精矿(主要含 、MnS、
、MnS、 等)制备银,同时获得二氧化锰的流程如下。
等)制备银,同时获得二氧化锰的流程如下。
(1)“浸锰”步骤中产生的浸锰液主要含有 ,生成气体的主要成分为
,生成气体的主要成分为_______ ;用惰性电极电解浸锰液制 ,写出电解总反应的化学方程式
,写出电解总反应的化学方程式_______ 。
(2)已知“浸铁”步骤中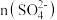 保持不变,反应中n(氧化剂):n(还原剂)=
保持不变,反应中n(氧化剂):n(还原剂)=_______ ;浸铁滤饼的主要成分为S和_______ 。
(3)“浸银”时发生反应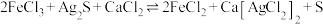 ,其中
,其中 在溶液中是一种稳定配合物。加入
在溶液中是一种稳定配合物。加入 的作用是
的作用是_______ ;结合离子方程式,从平衡角度分析选用氯化物浓溶液的原因是_______ 。
(4)“沉银”步骤中,生成单质银的离子反应方程式为_______ ,沉银液经处理可再利用,方法是向沉银液中通入_______ (写化学式),通过一步转化后循环再用。
 、MnS、
、MnS、 等)制备银,同时获得二氧化锰的流程如下。
等)制备银,同时获得二氧化锰的流程如下。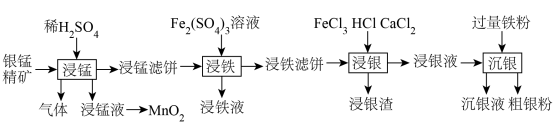
(1)“浸锰”步骤中产生的浸锰液主要含有
 ,生成气体的主要成分为
,生成气体的主要成分为 ,写出电解总反应的化学方程式
,写出电解总反应的化学方程式(2)已知“浸铁”步骤中
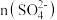 保持不变,反应中n(氧化剂):n(还原剂)=
保持不变,反应中n(氧化剂):n(还原剂)=(3)“浸银”时发生反应
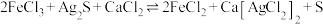 ,其中
,其中 在溶液中是一种稳定配合物。加入
在溶液中是一种稳定配合物。加入 的作用是
的作用是(4)“沉银”步骤中,生成单质银的离子反应方程式为
您最近一年使用:0次
4 . 工业上先将金红石 (TiO2)转化为 ,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。
,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。
(1)已知在一定条件下如下反应的热化学方程式及平衡常数:
i.
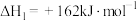

ii.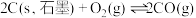
 K2
K2
iii.
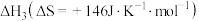

①
___________ 。
②反应iii自发进行的条件为___________ (填“低温”“高温”或“任意温度”)。
___________ (用含 的代数式表示)。
的代数式表示)。
(2)在 的密闭容器中,投入一定量的
的密闭容器中,投入一定量的 、C、
、C、 ,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 时平衡体系气体总物质的量为n,反应
时平衡体系气体总物质的量为n,反应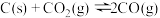 的平衡常数的值
的平衡常数的值
___________ (用含n、V的代数式表示)。
(3)用如图所示装置电解 可制硼氢化钠(
可制硼氢化钠( ,强还原性,硼为
,强还原性,硼为 价),为了防止NaBH4被氧化,则交换膜的种类为
价),为了防止NaBH4被氧化,则交换膜的种类为___________ 交换膜(填“阳离子”或者“阴离子”),写出阴极室的电极反应式:___________ 。
 ,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。
,然后可制得在医疗等领域具有重要用途的钛(Ti)。按要求回答下列问题。(1)已知在一定条件下如下反应的热化学方程式及平衡常数:
i.

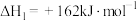

ii.
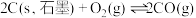
 K2
K2iii.

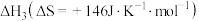

①

②反应iii自发进行的条件为

 的代数式表示)。
的代数式表示)。(2)在
 的密闭容器中,投入一定量的
的密闭容器中,投入一定量的 、C、
、C、 ,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
,进行反应iii的模拟实验。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。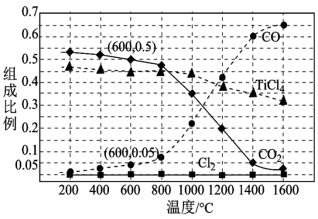
 时平衡体系气体总物质的量为n,反应
时平衡体系气体总物质的量为n,反应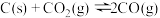 的平衡常数的值
的平衡常数的值
(3)用如图所示装置电解
 可制硼氢化钠(
可制硼氢化钠( ,强还原性,硼为
,强还原性,硼为 价),为了防止NaBH4被氧化,则交换膜的种类为
价),为了防止NaBH4被氧化,则交换膜的种类为
您最近一年使用:0次
2024-04-11更新
|
56次组卷
|
2卷引用:四川省南充市嘉陵第一中学2023-2024学年高二下学期第一次月考化学试题
解题方法
5 . 甲醛(HCHO)在石油化工、医药及能源等行业均有广泛用途,工业上可通过甲醇脱氢的方法合成甲醛,反应原理为: ,回答下列问题:
,回答下列问题:
(1)已知:①
②
反应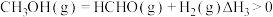 ,则
,则
___________  ,该反应涉及的
,该反应涉及的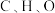 元素的电负性由大到小的顺序是
元素的电负性由大到小的顺序是___________ 。
(2)在密闭容器中入 和适量催化剂
和适量催化剂 ,发生反应
,发生反应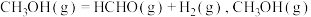 的平衡体积分数随压强变化的曲线如图所示。
的平衡体积分数随压强变化的曲线如图所示。

①图中温度
___________  (填“
(填“ ”、“
”、“ ”或“=”),判断的依据是
”或“=”),判断的依据是___________ 。
② 温度下,根据图中点
温度下,根据图中点 ,计算该处
,计算该处 的平衡转化率为
的平衡转化率为___________ (保留2位小数)。
(3)借助电解技术,可由甲醛为原料制得乙二醇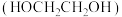 ,装置如图所示。
,装置如图所示。

①阴极上的反应式为___________ 。
②产生标准状况下 ,理论上可制得乙二醇
,理论上可制得乙二醇___________ 
 ,回答下列问题:
,回答下列问题:(1)已知:①

②

反应
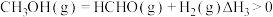 ,则
,则
 ,该反应涉及的
,该反应涉及的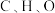 元素的电负性由大到小的顺序是
元素的电负性由大到小的顺序是(2)在密闭容器中入
 和适量催化剂
和适量催化剂 ,发生反应
,发生反应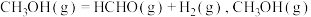 的平衡体积分数随压强变化的曲线如图所示。
的平衡体积分数随压强变化的曲线如图所示。
①图中温度

 (填“
(填“ ”、“
”、“ ”或“=”),判断的依据是
”或“=”),判断的依据是②
 温度下,根据图中点
温度下,根据图中点 ,计算该处
,计算该处 的平衡转化率为
的平衡转化率为(3)借助电解技术,可由甲醛为原料制得乙二醇
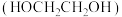 ,装置如图所示。
,装置如图所示。
①阴极上的反应式为
②产生标准状况下
 ,理论上可制得乙二醇
,理论上可制得乙二醇
您最近一年使用:0次
6 . 工业上以铬铁矿( ,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题:
,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题: (铁、铬分别为
(铁、铬分别为 、
、 价)转化为
价)转化为 和
和 ,同时A1、Si氧化物转化为可溶性钠盐。
,同时A1、Si氧化物转化为可溶性钠盐。
(1)“焙烧”过程与 有关的化学反应中,氧化剂和还原剂物质的量之比为
有关的化学反应中,氧化剂和还原剂物质的量之比为___________ 。“浸取”过程所得滤渣的用途有___________ (合理即可)。
(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度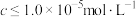 时,可认为已除尽。
时,可认为已除尽。___________ ;从平衡移动的角度解释“酸化”过程加入 的原因
的原因___________ 。
(3)“冷却结晶”时,相关化学反应方程式为___________ 。
(4) 价铬的化合物毒性较大,需将
价铬的化合物毒性较大,需将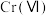 转化为毒性较低的
转化为毒性较低的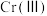 ;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。
;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。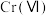 :向含铬(Ⅵ)废水中加入适量
:向含铬(Ⅵ)废水中加入适量 溶液发生反应,生成在乙醚中较稳定存在的
溶液发生反应,生成在乙醚中较稳定存在的 价的含铬氧化物
价的含铬氧化物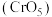 ,1mol
,1mol 中含过氧键
中含过氧键 的数量是
的数量是___________ 。
②电解开始时,A极上主要发生的电极反应式为___________ 。
③电解产生的 将
将 还原为
还原为 同时产生
同时产生 ,其离子方程式为
,其离子方程式为___________ 。
 ,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题:
,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题: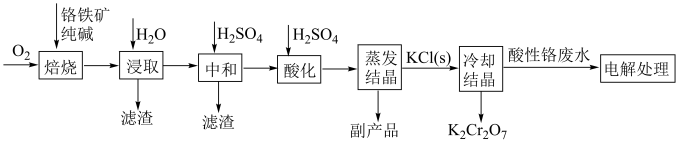
 (铁、铬分别为
(铁、铬分别为 、
、 价)转化为
价)转化为 和
和 ,同时A1、Si氧化物转化为可溶性钠盐。
,同时A1、Si氧化物转化为可溶性钠盐。(1)“焙烧”过程与
 有关的化学反应中,氧化剂和还原剂物质的量之比为
有关的化学反应中,氧化剂和还原剂物质的量之比为(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度
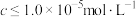 时,可认为已除尽。
时,可认为已除尽。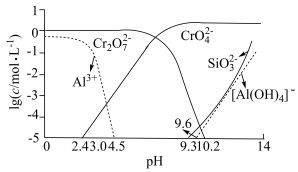
 的原因
的原因(3)“冷却结晶”时,相关化学反应方程式为
(4)
 价铬的化合物毒性较大,需将
价铬的化合物毒性较大,需将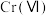 转化为毒性较低的
转化为毒性较低的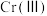 ;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。
;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。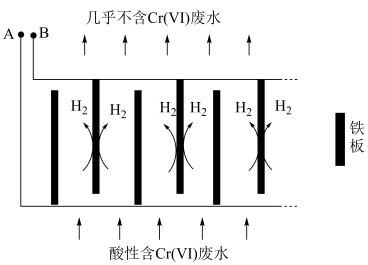
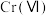 :向含铬(Ⅵ)废水中加入适量
:向含铬(Ⅵ)废水中加入适量 溶液发生反应,生成在乙醚中较稳定存在的
溶液发生反应,生成在乙醚中较稳定存在的 价的含铬氧化物
价的含铬氧化物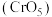 ,1mol
,1mol 中含过氧键
中含过氧键 的数量是
的数量是②电解开始时,A极上主要发生的电极反应式为
③电解产生的
 将
将 还原为
还原为 同时产生
同时产生 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
2024-04-11更新
|
284次组卷
|
2卷引用:2024届四川省雅安市、遂宁市、眉山市高三第二次诊断性考试理科综合试题-高中化学
2023·全国·模拟预测
名校
解题方法
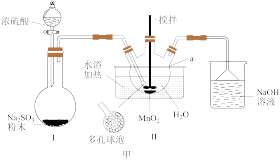
7 . MnSO4·H2O是一种浅粉色晶体,易溶于水,不溶于乙醇,是饲料中常用的添加剂,也是电解制备锰及其他锰盐的原料,工业用途广泛。某同学设计如图甲所示实验装置制备硫酸锰。
回答下列问题:
(1)仪器a的名称是_____ 。连接好实验仪器,装药品之前需进行的操作是______ 。
(2)装置Ⅱ中发生反应的化学方程式为_____ ;装置Ⅱ中水浴温度控制在80℃左右,温度过高时反应速率可能减慢的原因是______ 。
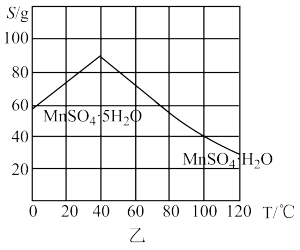
(3)结合图乙,分析反应后从溶液中获得MnSO4·H2O晶体的操作为_____ 、酒精洗涤、低温干燥。
(4)测定饲料中硫酸锰的含量常将饲料溶于水,以磷酸作络合剂,用硝酸铵作氧化剂,将试样中的二价锰定量氧化成三价锰,过量的硝酸铵立即与产生的亚硝酸盐反应而消除其影响。然后加入指示剂,用硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定生成的三价锰,溶液由红色变为亮黄色为滴定终点。有关反应的离子方程式如下:
①2Mn2++NO +4PO
+4PO +2H+=2[Mn(PO4)2]3-+NO
+2H+=2[Mn(PO4)2]3-+NO +H2O;
+H2O;
②NH +NO
+NO =N2↓+2H2O;
=N2↓+2H2O;
③[Mn(PO4)2]3-+Fe2+=Mn2++[Fe(PO4)2]3-。
取ag饲料,消耗浓度为cmol•L-1的硫酸亚铁铵标准溶液VmL,则饲料中MnSO4·H2O的质量分数为_____ %(用含a、c、V的式子表示)。若实验时未用标准溶液润洗滴定管,会导致测定结果_____ (填“偏大”“偏小”或“无影响”)。
(5)用惰性电极电解MnSO4酸性溶液可制得MnO2,请写出电解法制备MnO2时的阳极反应式:_____ 。

回答下列问题:
(1)仪器a的名称是
(2)装置Ⅱ中发生反应的化学方程式为
(3)结合图乙,分析反应后从溶液中获得MnSO4·H2O晶体的操作为

(4)测定饲料中硫酸锰的含量常将饲料溶于水,以磷酸作络合剂,用硝酸铵作氧化剂,将试样中的二价锰定量氧化成三价锰,过量的硝酸铵立即与产生的亚硝酸盐反应而消除其影响。然后加入指示剂,用硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定生成的三价锰,溶液由红色变为亮黄色为滴定终点。有关反应的离子方程式如下:
①2Mn2++NO
 +4PO
+4PO +2H+=2[Mn(PO4)2]3-+NO
+2H+=2[Mn(PO4)2]3-+NO +H2O;
+H2O;②NH
 +NO
+NO =N2↓+2H2O;
=N2↓+2H2O;③[Mn(PO4)2]3-+Fe2+=Mn2++[Fe(PO4)2]3-。
取ag饲料,消耗浓度为cmol•L-1的硫酸亚铁铵标准溶液VmL,则饲料中MnSO4·H2O的质量分数为
(5)用惰性电极电解MnSO4酸性溶液可制得MnO2,请写出电解法制备MnO2时的阳极反应式:
您最近一年使用:0次
2023-04-11更新
|
299次组卷
|
4卷引用:T26-实验综合题
(已下线)T26-实验综合题(已下线)化学押题卷(一)重庆市乌江新高考协作体2023-2024学年高三上学期第一次联合调研抽测(一模)化学试题河南省焦作市博爱县第一中学2023-2024学年高三下学期开学化学试题
名校
8 . 甲醇是一种基本的有机化工原料,用途十分广泛。应用 催化加氢规模化生产甲醇是综合利用
催化加氢规模化生产甲醇是综合利用 ,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
 ,需通过以下两步实现:
,需通过以下两步实现:
I.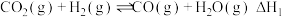
II.
反应过程中各物质的相对能量变化情况如图所示。
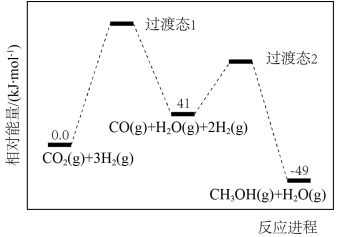
(1)
___________ ,稳定性:过渡态1___________ 过渡态2(填“大于”“小于”或“等于”)
(2)为探究该反应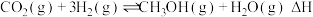 ,进行如下实验:在一恒温、体积为
,进行如下实验:在一恒温、体积为 密闭容器中,充入
密闭容器中,充入 和
和 ,进行该反应(不考虑其它副反应)。
,进行该反应(不考虑其它副反应)。 时测得
时测得 和
和 的体积分数之比为
的体积分数之比为 且比值不再随时间变化。回答下列问题:
且比值不再随时间变化。回答下列问题:
①反应开始到平衡,
___________ 。
②该温度下的平衡常数
___________  (保留三位有效数字)。
(保留三位有效数字)。
③若上述反应过程中不断升高反应温度,下列图像正确的是___________ 。
A.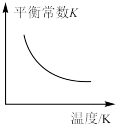 B.
B. C.
C.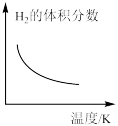 D.
D.
(3)基于催化剂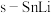 的
的 电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为
电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为___________ ,若电池工作 电极的质量变化为
电极的质量变化为 ,则理论上消耗
,则理论上消耗 的物质的量为
的物质的量为___________ 。

 催化加氢规模化生产甲醇是综合利用
催化加氢规模化生产甲醇是综合利用 ,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应 ,需通过以下两步实现:
,需通过以下两步实现:I.
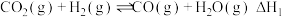
II.

反应过程中各物质的相对能量变化情况如图所示。

(1)

(2)为探究该反应
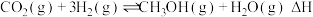 ,进行如下实验:在一恒温、体积为
,进行如下实验:在一恒温、体积为 密闭容器中,充入
密闭容器中,充入 和
和 ,进行该反应(不考虑其它副反应)。
,进行该反应(不考虑其它副反应)。 时测得
时测得 和
和 的体积分数之比为
的体积分数之比为 且比值不再随时间变化。回答下列问题:
且比值不再随时间变化。回答下列问题:①反应开始到平衡,

②该温度下的平衡常数

 (保留三位有效数字)。
(保留三位有效数字)。③若上述反应过程中不断升高反应温度,下列图像正确的是
A.
 B.
B. C.
C. D.
D.
(3)基于催化剂
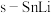 的
的 电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为
电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为 电极的质量变化为
电极的质量变化为 ,则理论上消耗
,则理论上消耗 的物质的量为
的物质的量为
您最近一年使用:0次
2023-11-06更新
|
228次组卷
|
4卷引用:T28-原理综合题
解题方法
9 . Ni(镍)和Ni2O3在工业和国防上有重要的用途。铜镍矿(主要成分为镍、镁、铜、铁、硅的氧化物)的湿法冶炼是获取镍的重要途径,其工艺流程如下图所示:

(1)“氧压酸浸”滤液中含有Fe3+、Mg2+、Ni2+、Cu2+等离子,通入氧气时加压的目的是______ 。
(2)已知铁矾渣的成分是Na2Fe6(SO4)4(OH)12,MgO在“沉淀除铁”过程中的作用是___________ ,请将其参与生成铁矾渣的离子反应方程式补充完整___________ 。
=Na2Fe6(SO4)4(OH)12+Mg2++10H+
(3)“沉镍”步骤所得滤液中的溶质主要是___________ (填化学式);25℃时,沉镍过程中MgO的加入量对镍沉淀的影响如图所示,当pH为8.0时,溶液中Ni2+的浓度___________ (已知该温度下Ksp[Ni(OH)2]=2.0×10-15);结合图中信息回答,选择MgO加入量为3.0g的理由是___________ 。

(4)工业上可用电解法制取Ni2O3.用NaOH溶液调节NiCl2溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-和Cl-,ClO-再把Ni(OH)2氧化为Ni2O3.电解时阴极的电极反应式为___________ ,2amol二价镍全部转化为三价镍时,外电路中通过的电子的物质的量为___________ mol(假设电解时阳极只考虑Cl-放电)。

(1)“氧压酸浸”滤液中含有Fe3+、Mg2+、Ni2+、Cu2+等离子,通入氧气时加压的目的是
(2)已知铁矾渣的成分是Na2Fe6(SO4)4(OH)12,MgO在“沉淀除铁”过程中的作用是
=Na2Fe6(SO4)4(OH)12+Mg2++10H+
(3)“沉镍”步骤所得滤液中的溶质主要是

(4)工业上可用电解法制取Ni2O3.用NaOH溶液调节NiCl2溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-和Cl-,ClO-再把Ni(OH)2氧化为Ni2O3.电解时阴极的电极反应式为
您最近一年使用:0次
名校
解题方法
10 . 甲醇是一种基本的有机化工原料,用途十分广泛。应用 催化加氢规模化生产甲醇是综合利用
催化加氢规模化生产甲醇是综合利用 ,实现“碳达峰”的有效措施之一。我国科学家研究发现二氧化碳电催化还原制甲醇的反应
,实现“碳达峰”的有效措施之一。我国科学家研究发现二氧化碳电催化还原制甲醇的反应 ,需通过以下两步实现:
,需通过以下两步实现:
Ⅰ.
Ⅱ.
(1)反应过程中各物质的相对能量变化情况如图所示。
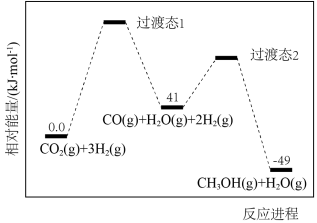

_______ 。
(2)若 ,下列温度下反应能自发进行的是_______(填序号)。
,下列温度下反应能自发进行的是_______(填序号)。
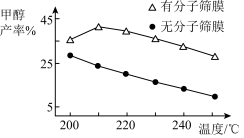
(3)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出 )的两个同体积容器中通入
)的两个同体积容器中通入 和
和 ,甲醇的产率随温度的变化如图所示。温度相同时,有分子筛膜的容器中甲醇的产率大于无分子监膜的原因为
,甲醇的产率随温度的变化如图所示。温度相同时,有分子筛膜的容器中甲醇的产率大于无分子监膜的原因为_______ 。
(4)按照 投料,在恒容密闭容器中进行反应,
投料,在恒容密闭容器中进行反应, 的平衡转化率随温度和压强变化如图所示。
的平衡转化率随温度和压强变化如图所示。
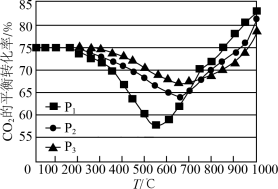
①压强 、
、 、
、 由大到小的顺序是
由大到小的顺序是_______ 。
②压强为 时,温度高于
时,温度高于 之后,随着温度升高平衡转化率增大的原因是
之后,随着温度升高平衡转化率增大的原因是_______ ;
③同时增大 的平衡转化率和
的平衡转化率和 的产率可采取的措施是
的产率可采取的措施是_______ 。
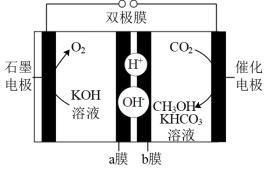
④一种应用双极膜(由阳离子和阴离子交换膜构成)通过电化学还原 制备甲醇的电解原理如图所示。催化电极的电极反应式为
制备甲醇的电解原理如图所示。催化电极的电极反应式为_______ ,双极膜内每消耗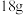 水,理论上石墨电极产生标准状况下
水,理论上石墨电极产生标准状况下_______ 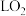 。
。
 催化加氢规模化生产甲醇是综合利用
催化加氢规模化生产甲醇是综合利用 ,实现“碳达峰”的有效措施之一。我国科学家研究发现二氧化碳电催化还原制甲醇的反应
,实现“碳达峰”的有效措施之一。我国科学家研究发现二氧化碳电催化还原制甲醇的反应 ,需通过以下两步实现:
,需通过以下两步实现:Ⅰ.

Ⅱ.

(1)反应过程中各物质的相对能量变化情况如图所示。


(2)若
 ,下列温度下反应能自发进行的是_______(填序号)。
,下列温度下反应能自发进行的是_______(填序号)。A.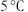 | B.10℃ | C. | D. |
 )的两个同体积容器中通入
)的两个同体积容器中通入 和
和 ,甲醇的产率随温度的变化如图所示。温度相同时,有分子筛膜的容器中甲醇的产率大于无分子监膜的原因为
,甲醇的产率随温度的变化如图所示。温度相同时,有分子筛膜的容器中甲醇的产率大于无分子监膜的原因为
(4)按照
 投料,在恒容密闭容器中进行反应,
投料,在恒容密闭容器中进行反应, 的平衡转化率随温度和压强变化如图所示。
的平衡转化率随温度和压强变化如图所示。
①压强
 、
、 、
、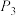 由大到小的顺序是
由大到小的顺序是②压强为
 时,温度高于
时,温度高于 之后,随着温度升高平衡转化率增大的原因是
之后,随着温度升高平衡转化率增大的原因是③同时增大
 的平衡转化率和
的平衡转化率和 的产率可采取的措施是
的产率可采取的措施是④一种应用双极膜(由阳离子和阴离子交换膜构成)通过电化学还原
 制备甲醇的电解原理如图所示。催化电极的电极反应式为
制备甲醇的电解原理如图所示。催化电极的电极反应式为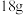 水,理论上石墨电极产生标准状况下
水,理论上石墨电极产生标准状况下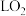 。
。
您最近一年使用:0次
2023-03-26更新
|
809次组卷
|
3卷引用:四川省成都市第七中学2022-2023学年高二下学期期中考试化学试题



