9-10高二下·浙江台州·阶段练习
名校
解题方法
1 . 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:还原性Fe>Ni>Cu)
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中有Cu和Pt |
您最近一年使用:0次
2022-08-15更新
|
1464次组卷
|
119卷引用:浙江省临海市白云中学2009—2010学年度高二下学期第一次月考化学试题
(已下线)浙江省临海市白云中学2009—2010学年度高二下学期第一次月考化学试题(已下线)考点10 电解原理 金属的腐蚀与防护——备战2019年浙江新高考化学考点(已下线)【新东方】 2020-2(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)浙江省宁波市北仑中学2020-2021学年高一下学期期中考试化学(1班选考)试题浙江省舟山市2021-2022学年高二上学期期末检测化学试题(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2011届福建省三明一中高三上学期期中考试化学卷(已下线)2011届山东省济南外国语学校高三上学期第三次质量检测化学试卷(已下线)2010-2011学年江苏省南京六中高二下学期期末考试化学试题(已下线)2011-2012学年山东省潍坊市高二寒假作业化学(一)试卷(已下线)2011-2012学年福建南平政和一中高二期末考试化学试卷(已下线)2011-2012学年天津市耀华中学高二上学期期末考试化学试卷(已下线)2011-2012学年陕西省师大附中高一下学期期末考试化学试卷(已下线)2013届江苏省泰州中学高三上学期期中考试化学试卷(已下线)2013届山东省济宁市鱼台一中高三上学期期中考试化学试卷(已下线)2014高考名师推荐化学电解三池的应用(已下线)2013-2014天津市耀华中学高二上学期期末考试化学试卷(已下线)2015安徽望江中学同步课时练(人教选修4)第四章检测试卷2014-2015四川省重点中学高二下学期期中考试化学试卷2015-2016学年福建省四地六校高二上学期10月联考化学试卷2015-2016学年福建省四地六校高二上学期10月一次联考化学试卷2016届湖南省十校共同体高三上学期12月联考化学试卷2015-2016学年河北省故城高级中学高二上12月月考化学试卷2016届山东省菏泽一中高三上学期12月月考化学试卷2015-2016学年吉林省延边三中高二上12月月考化学试卷2017届山东省滕州市第二中学高三上学期10月月考化学试卷2017届甘肃省天水一中高三上学期第一次月考化学卷2016-2017学年福建省四地六校高二上第一次月考化学试卷(已下线)同步君 选修4 第4章 第3节 电解原理的应用2016-2017学年河北石家庄一中高二上期中考试化学试卷2016-2017学年黑龙江哈尔滨六中高二上期末化学卷2016-2017学年江苏省如东高级中学高一下学期第一次(3月)阶段检测化学试卷福建省龙海市程溪中学2016-2017学年高二下学期期末考试化学试题山东省寿光现代中学2017-2018学年高二上学期开学考试化学试题河南省郑州市中牟县二中2017-2018学年高二第一次月考化学试题宁夏银川市六盘山高级中学2017-2018学年高二上学期第一次月考化学试题福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题河北省承德市第一中学2017-2018学年高二上学期第一次月考化学试题山东省垦利第一中学2017-2018学年高二上学期第一次月考化学试题四川省成都经开区实验中学2018届高三10月月考理综化学试题安徽省蚌埠市第二中学2017-2018学年高二上学期期中考试化学试题山东省菏泽市2017-2018学年高二上学期期中考试(B)化学试题高中化学人教版 选修四 第四章 电化学基础 第三节 电解池 电解池第二课时(电解原理的应用)陕西师范大学附中2017-2018第一学期高二年级化学期中考试化学试题天津市红桥区2017-2018学年高二上学期期末考试化学试题河南省豫南九校2017-2018学年高二上学期期末联考化学试题1河南省豫南九校2017-2018学年高二上学期期末联考化学试题2河北省承德市第二中学2017-2018学年高二上学期第一次月考化学试题2018-2019学年鲁科版高中化学选修四:第1章检测题河南省镇平县第一高级中学2018-2019学年高二上学期第一次月考化学试题吉林省辽源市田家炳高级中学2018-2019学年高二9月月考化学试题广东省惠州市惠东县惠东高级中学2018-2019学年高二上学期10月月考化学试题山东省鄄城市第一中学2018-2019学年高二上学期第一次月考化学试题陕西省黄陵中学2018-2019学年高二(重点班)上学期期中考试化学试题高二人教版选修4 第四章 第三节 电解池山东省泰安市宁阳一中2018-2019学年高二上学期阶段性考试三(12月)化学试题四川省遂宁市2018-2019学年高二下学期期末考试化学试题云南省普洱市澜沧县民族中学2018-2019学年高二下学期期末考试化学试题四川省武胜县烈面中学校2018届高三9月入学考试化学试题(已下线)2019年9月22日 《每日一题》 2020年高考一轮复习-每周一测山东省泰安市宁阳县第一中学2019-2020学年高二上学期第一次段考化学试题(已下线)2019年12月4日 《每日一题》人教版(选修4)——电解精炼铜福建省泉州第十六中学2019-2020学年高二10月份月考化学试题2020年春季人教版高中化学选修4第四章《电化学基础》测试卷河北省沧州市泊头市第一中学2019-2020学年高二月考检测化学试题福建省安溪一中2020年高一实验班线上阶段测试化学试题河北省泊头市第一中学2019-2020学年高二上学期期末模拟考试化学试卷四川省自贡市田家炳中学2019-2020学年高二下学期开学考试化学试题甘肃省西北师范大学附属中学2019-2020学年高二上学期期中考试化学试题甘肃省武威第一中学2019-2020学年高二下学期期中考试化学试题四川省泸县第四中学2019-2020学年高二下学期第四学月考试化学试题四川省泸县第一中学2019-2020学年高二下学期第四学月考试化学试题云南省昆明市官渡区第一中学2019-2020学年高二下学期期中考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二上学期开学考试化学试题黑龙江省哈尔滨市第一中学校2021届高三上学期开学测试化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第3节 电能转化为化学能——电解 课时2 电解原理的应用鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第3节 电能转化为化学能——电解高中必刷题高二选择性必修1第四章 化学反应与电能 第二节 电解池 课时2 电解原理的应用山东省菏泽市单县第五中学2020-2021学年高二上学期第一次月考(10月)化学试题福建省永安市第三中学2020-2021学年高二10月月考化学(选考班)试题福建省三明第一中学2020-2021学年高二上学期第一次月考化学试题人教版(2019)高二化学选择性必修1第四章 化学反应与电能 第二节 电解池 课时2 电解原理的应用湖北省武汉市蔡甸区汉阳一中2020-2021学年高二上学期9月联考化学试题(已下线)专题4.3.2 电解原理的应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)4.2.2 电解原理的应用(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)河北省石家庄市藁城区第一中学2019-2020学年高二上学期第三次月考化学试题(已下线)4.3.2 电解原理的应用(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练解题达人.化学选择题(2021全国卷)提升小卷05江苏省苏州市吴中区2020-2021学年高二下学期期中调研测试化学试题河北沧州泊头一中2020-2021学年高一下学期第二次月考化学试卷黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题贵州省遵义市2020~2021学年高二下学期期末质量检测化学试题黑龙江省哈尔滨市第九中学校2020-2021学年高一下学期6月月考化学试题选择性必修1专题1第二单元 课时4 电解原理的应用(已下线)1.2.4 电解原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)江苏省外国语学校2020-2021学年高二下学期期中调研测试化学试卷河南省南阳市第五中学2021-2022学年高二上学期10月月考化学试题 福建师范大学附属中学2021-2022学年高二上学期期中考试化学试题黑龙江省实验中学2021-2022学年高二上学期期中考试化学试题(已下线)4.2.2 电解原理的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)内蒙古包头市2021-2022学年高二上学期期末考试化学试题辽宁省沈阳市市级重点高中联合体2021-2022学年高二上学期期末考试化学试题河北省保定市博野中学2021-2022学年高二上学期12月月考化学试题河北省衡水市武强中学2021-2022学年高二下学期期中考试化学试题辽宁省部分中学2021-2022学年高二下学期期末检测化学试题山东省德州市2020-2021学年高二上学期反应原理月考(B)化学试题辽宁省部分中学2021-2022学年高二上学期期末测试化学试题黑龙江省嫩江市第一中学2021-2022学年高二下学期开学考试化学试题河南省濮阳市元龙高级中学2021-2022学年高二下学期5月月考化学试题(已下线)第四章 化学反应与电能(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)湖北省襄阳市第一中学2022-2023学年高二上学期12月线上考试化学试题新疆阿克苏市实验中学2021-2022学年高二上学期期末考试化学试题(已下线)4.2.2 电解原理的应用-同步学习必备知识(已下线)第六章 化学反应与能量 第37讲 电解池 金属的腐蚀与防护第2课时 电解原理的应用福建省宁德市第一中学2021-2022学年高二上学期9月月考化学试题
名校
2 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
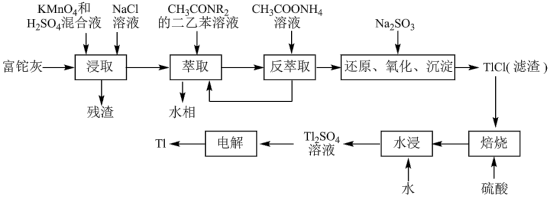
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H++CH3CONR2+TlCl
 [CH3CONR2H]TlCl4;PbSO4是一种难溶性的物质。
[CH3CONR2H]TlCl4;PbSO4是一种难溶性的物质。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示,石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H++CH3CONR2+TlCl

 [CH3CONR2H]TlCl4;PbSO4是一种难溶性的物质。
[CH3CONR2H]TlCl4;PbSO4是一种难溶性的物质。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)用平衡移动解释“反萃取”过程的原理和目的
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示,石墨(C)上电极反应式为

您最近一年使用:0次
解题方法
3 . 二甲醚(DME)在工业上有许多独特用途,由CO2、H2制备二甲醚的主反应、副反应如下:
请回答下列问题:
(1)写出反应IV:CO2与H2一步反应合成二甲醚的热化学反应方程式___________ 。反应IV的平衡常数K=___________ (用 、
、 表示)。
表示)。
(2)催化剂的选择性:同时发生多种反应的反应体系,同一催化剂对不同反应的促进程度不同。恒压条件下,CO2和H2起始投料的物质的量之比为1:3时,二甲醚的选择性随温度的变化曲线如图。CH3OCH3的选择性 。
。

①二甲醚的选择性随温度升高而降低的原因是___________ 。
②关于合成二甲醚工艺的理解,下列说法正确的是___________ 。
A.二甲醚的平衡产率随温度升高而增大
B.提高催化剂的活性和选择性,减少CO等副产物是工艺的关键
C.其他条件不变,平衡状态下缩小容器体积,CO的物质的量保持不变
D.其他条件不变,恒压条件下的二甲醚选择性大于恒容条件下的二甲醚选择性
③280℃时,若加入CO2的物质的量为1mol,生成二甲醚的选择性为40%,现收集到0.08mol的二甲醚,则CO2转化率为___________ 。
(3)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图所示,则b极的电极反应式为___________ 。

| 编号 | 反应方程式 | 反应热 | 平衡常数 |
| I |  | 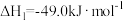 |  |
| II | 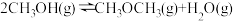 |  |  |
| III |  | 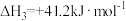 |  |
| IV |  | 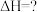 |  |
(1)写出反应IV:CO2与H2一步反应合成二甲醚的热化学反应方程式
 、
、 表示)。
表示)。(2)催化剂的选择性:同时发生多种反应的反应体系,同一催化剂对不同反应的促进程度不同。恒压条件下,CO2和H2起始投料的物质的量之比为1:3时,二甲醚的选择性随温度的变化曲线如图。CH3OCH3的选择性
 。
。
①二甲醚的选择性随温度升高而降低的原因是
②关于合成二甲醚工艺的理解,下列说法正确的是
A.二甲醚的平衡产率随温度升高而增大
B.提高催化剂的活性和选择性,减少CO等副产物是工艺的关键
C.其他条件不变,平衡状态下缩小容器体积,CO的物质的量保持不变
D.其他条件不变,恒压条件下的二甲醚选择性大于恒容条件下的二甲醚选择性
③280℃时,若加入CO2的物质的量为1mol,生成二甲醚的选择性为40%,现收集到0.08mol的二甲醚,则CO2转化率为
(3)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图所示,则b极的电极反应式为

您最近一年使用:0次
4 . 镁、铝、氮及其化合物在科学研究和工业生产中用途非常广泛。请回答:
(1)某同学在实验室从如图标签的试剂瓶中取少量镁在空气中进行燃烧:

①实验后发现有少许黑色固体生成。从反应物及实验操作猜测:该黑色物质可能是炭与另一种黑色氧化物组成的混合物,则该氧化物可能是___________ (写化学式),写出镁燃烧产生碳的化学方程式___________ 。
②设计一个简单实验,验证黑色固体中是否含有碳:___________ 。
(2)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
①写出该化合物可作阻燃剂的任意一条依据___________ 。
②用离子方程式表示除去固体产物中Al2O3的原理___________ 。
(3)已知镁单质与SiO2固体在高温下会生成固体Mg2Si,试写出相应的化学方程式___________ 。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4气体,该反应的化学方程式为___________ 。
(4)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO 可转化为NH2OH,以铂为另一极,请写出汞电极上的电极方程式
可转化为NH2OH,以铂为另一极,请写出汞电极上的电极方程式___________ 。
(1)某同学在实验室从如图标签的试剂瓶中取少量镁在空气中进行燃烧:

①实验后发现有少许黑色固体生成。从反应物及实验操作猜测:该黑色物质可能是炭与另一种黑色氧化物组成的混合物,则该氧化物可能是
②设计一个简单实验,验证黑色固体中是否含有碳:
(2)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4
 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3①写出该化合物可作阻燃剂的任意一条依据
②用离子方程式表示除去固体产物中Al2O3的原理
(3)已知镁单质与SiO2固体在高温下会生成固体Mg2Si,试写出相应的化学方程式
(4)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO
 可转化为NH2OH,以铂为另一极,请写出汞电极上的电极方程式
可转化为NH2OH,以铂为另一极,请写出汞电极上的电极方程式
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
5 . 对氨基苯甲酸(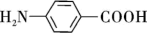 )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸( )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法不正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法不正确的是
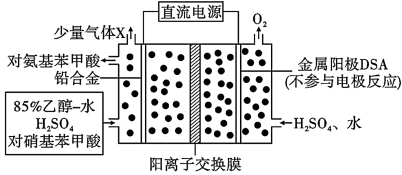
 )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸( )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法不正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法不正确的是
| A.电子由金属阳极DSA经导线流入直流电源 |
B.阴极的主要电极反应式为  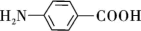 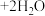 |
| C.每转移1 mol e-时,阳极电解质溶液的质量减少9g |
| D.反应结束后阳极区pH增大 |
您最近一年使用:0次
2021-08-05更新
|
435次组卷
|
7卷引用:考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时31 新型电解池装置-2022年高考化学一轮复习小题多维练(全国通用)(已下线)课时33 多池多室带膜电化学装置-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(全国通用)福建省福州市第四十中学2021-2022学年高二上学期9月阶段测试化学试题(已下线)考点19 电解池-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点19 电解池(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
6 . Ⅰ.电解法制取有广泛用途的Na2FeO4,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

(1)电解过程中,阳极电极反应式___ 。
(2)c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c(Na2FeO4)低于最高值的原因:___ 。
(3)有实验表明用铁粉末压制的“粉末铁”做阳极比用纯铁块做阳极能够获得更高的浓度和产量,试分析原因:___ 。
Ⅱ.在酸性介质中HNO2参加的氧化还原反应速率相当快。实验表明HNO2加入酸性NaI溶液,HNO2将I-氧化成I2的过程由3步反应组成:
①HNO2(aq)+H+((aq)=NO+(aq)+H2O(1)②___;③2ONI(aq)=I2(aq)+2NO↑
(1)写出第②步反应的离子方程式___ 。
(2)在溶液中存在化学平衡:I2(aq)+NaI(aq) NaI3(aq),其平衡常数表达式为
NaI3(aq),其平衡常数表达式为___ 。
Ⅲ.合成氨工业中的原料气H2可以利用如下反应获取CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4kJ•mol-1Ea=240.1kJ•mol-1
(1)一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___ 。
A.升高温度 B.增大水蒸气浓度
C.选择性能优良的催化剂 D.投料比不变,增大反应物浓度
(2)该反应的逆反应活化能Ea′=___ kJ•mol-1。
 ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
(1)电解过程中,阳极电极反应式
(2)c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c(Na2FeO4)低于最高值的原因:
(3)有实验表明用铁粉末压制的“粉末铁”做阳极比用纯铁块做阳极能够获得更高的浓度和产量,试分析原因:
Ⅱ.在酸性介质中HNO2参加的氧化还原反应速率相当快。实验表明HNO2加入酸性NaI溶液,HNO2将I-氧化成I2的过程由3步反应组成:
①HNO2(aq)+H+((aq)=NO+(aq)+H2O(1)②___;③2ONI(aq)=I2(aq)+2NO↑
(1)写出第②步反应的离子方程式
(2)在溶液中存在化学平衡:I2(aq)+NaI(aq)
 NaI3(aq),其平衡常数表达式为
NaI3(aq),其平衡常数表达式为Ⅲ.合成氨工业中的原料气H2可以利用如下反应获取CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4kJ•mol-1Ea=240.1kJ•mol-1
(1)一定可以提高平衡体系中H2百分含量,又能加快反应速率的是
A.升高温度 B.增大水蒸气浓度
C.选择性能优良的催化剂 D.投料比不变,增大反应物浓度
(2)该反应的逆反应活化能Ea′=
您最近一年使用:0次
19-20高三·浙江·阶段练习
解题方法
7 . 氯系消毒剂在生活中有着广泛的用途。
(1)氯气用于自来水消毒,氯水中存在如下平衡(温度均为室温)。
Cl2(g)⇌Cl2(aq) K1=10-1.2
Cl2(aq) +H2O⇌HClO+H+ +Cl- K2=10-3.4
HClO⇌H++ ClO- K3=10-7.5
反应Cl2(g) +H2O⇌2H+ +ClO- +Cl- 的平衡常数K=______________ 。
(2)将氯气通入冷的NaOH溶液可制得84消毒液(有效成分是NaClO)。
①84消毒液产品中含有少量NaOH,NaOH作用是_____________ 。
②疫情期间,84消毒液和医用酒精都成为家用消毒剂的重要选择,但两者混合使用会缓慢发生反应使消毒效果降低,其中一步反应中有乙醛生成,这步反应的离子方程式是___________ 。
③当温度过高时,NaClO会转化为NaClO3,反应分两步进行:
I.2ClO- =ClO +Cl- 活化能为 Ea1
+Cl- 活化能为 Ea1
II.ClO +ClO- =ClO
+ClO- =ClO +Cl- 活化能为Ea2
+Cl- 活化能为Ea2
常温下,反应II能快速进行,但氯气与NaOH溶液反应却很难得到大量的NaClO3,据此推测活化能大小关系为Ea1_____ Ea2(填“>”、“<”或“=”)。
(3)ClO2也是一种高效消毒剂,文献记载可在酸性条件下电解NaClO3溶液制备高纯度的ClO2,判断C1O2在________ 极生成(填“阴”或“阳”),该电极反应式是_______ 。
(1)氯气用于自来水消毒,氯水中存在如下平衡(温度均为室温)。
Cl2(g)⇌Cl2(aq) K1=10-1.2
Cl2(aq) +H2O⇌HClO+H+ +Cl- K2=10-3.4
HClO⇌H++ ClO- K3=10-7.5
反应Cl2(g) +H2O⇌2H+ +ClO- +Cl- 的平衡常数K=
(2)将氯气通入冷的NaOH溶液可制得84消毒液(有效成分是NaClO)。
①84消毒液产品中含有少量NaOH,NaOH作用是
②疫情期间,84消毒液和医用酒精都成为家用消毒剂的重要选择,但两者混合使用会缓慢发生反应使消毒效果降低,其中一步反应中有乙醛生成,这步反应的离子方程式是
③当温度过高时,NaClO会转化为NaClO3,反应分两步进行:
I.2ClO- =ClO
 +Cl- 活化能为 Ea1
+Cl- 活化能为 Ea1II.ClO
 +ClO- =ClO
+ClO- =ClO +Cl- 活化能为Ea2
+Cl- 活化能为Ea2常温下,反应II能快速进行,但氯气与NaOH溶液反应却很难得到大量的NaClO3,据此推测活化能大小关系为Ea1
(3)ClO2也是一种高效消毒剂,文献记载可在酸性条件下电解NaClO3溶液制备高纯度的ClO2,判断C1O2在
您最近一年使用:0次
19-20高二·浙江·期末
解题方法
8 . 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,(已知:氧化性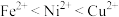 )下列叙述不正确的是
)下列叙述不正确的是
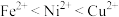 )下列叙述不正确的是
)下列叙述不正确的是| A.电解后,电解槽底部的阳极泥中只有Cu和Pt |
| B.电解过程中,阳极质量的减少与阴极质量的增加不相等 |
C.电解后,溶液中存在的金属阳离子有 、 、 、 、 |
D.阳极发生氧化反应,其电极反应式: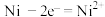 |
您最近一年使用:0次
18-19高三·浙江·阶段练习
解题方法
9 . (一)环氧乙烷(EO)是一种重要的化工原料,可用于生产乙二醇、乙醇胺等化工产品,目前乙烯直接氧化法被广泛应用于环氧乙烷的生产并得到广泛关注。制备环氧乙烷工艺装置如图: ,其中“反应床”中发生的反应有:
,其中“反应床”中发生的反应有:
主反应①:2CH2=CH2(g)+O2(g)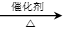 2
2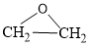 (g) △H1=-221.0kJ/mol;
(g) △H1=-221.0kJ/mol;
副反应②:CH2=CH2(g)+3O2(g)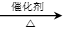 2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
副反应③:2 (g)+5O2(g)
(g)+5O2(g) 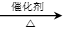 4CO2(g)+4H2O(g) △H3;
4CO2(g)+4H2O(g) △H3;
副反应④: (g)
(g) CH3CHO(g) △H3=-115.0kJ/mol
CH3CHO(g) △H3=-115.0kJ/mol
已知:环氧乙烷选择性是指乙烯进行反应①生成环氧乙烷的优势
(1)写出反应③的△H3=______ kJ/mol;
(2)下列有关环氧乙烷制备说法不正确的是______
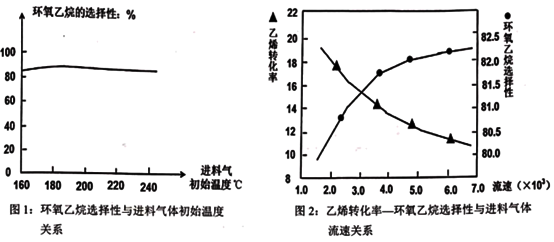
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降;主要是原料气与催化剂接触时间过短造成
C.图2表明,原料气的流速加快,环氧乙烷选择性略微增大;主要原因是温度得到较好控制,催化剂活性较强
D.若进料气中O2比例增大,环氧乙烷产率降低;其中主要原因是环氧乙烷转化为乙醛
(3)已知“反应床”中压强对乙烯转化率和环氧乙烷选择性的影响如图3:
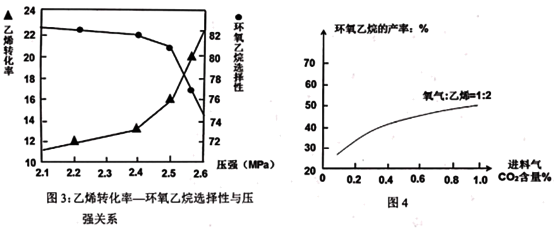
请解释当反应体系中压强高于2.4Mpa,导致环氧乙烷选择性下降的主要原因:______ 。
(4)不同进料组分,环氧乙烷产率不同;其中进料气n(O2):n(C2H4)=1:2时,随CO2含量变化,环氧乙烷的产率变化如图4。请在图4上画出进料气n(O2):n(C2H4)=3:1时,随CO2含量变化,环氧乙烷的产率变化曲线_______ 。
(二)环氧丙烷是一种重要的化工原料,且广泛用途。有机电化学法电解合成环氧丙烷是一种常见的生成工艺;其原理是将丙烯与电解饱和食盐水的电解产物反应,转化为氯丙醇(CH3CHOHCH2Cl),氯丙醇进一步反应生成环氧丙烷。其电解简易装置如图。

(1)写出a电极的电极反应式:__________ ;
(2)写出b电极区域生成环氧丙烷的化学方程式:__________ 。
 ,其中“反应床”中发生的反应有:
,其中“反应床”中发生的反应有:主反应①:2CH2=CH2(g)+O2(g)
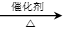 2
2 (g) △H1=-221.0kJ/mol;
(g) △H1=-221.0kJ/mol;副反应②:CH2=CH2(g)+3O2(g)
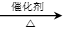 2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;副反应③:2
 (g)+5O2(g)
(g)+5O2(g) 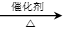 4CO2(g)+4H2O(g) △H3;
4CO2(g)+4H2O(g) △H3;副反应④:
 (g)
(g) CH3CHO(g) △H3=-115.0kJ/mol
CH3CHO(g) △H3=-115.0kJ/mol 已知:环氧乙烷选择性是指乙烯进行反应①生成环氧乙烷的优势
(1)写出反应③的△H3=
(2)下列有关环氧乙烷制备说法不正确的是
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降;主要是原料气与催化剂接触时间过短造成
C.图2表明,原料气的流速加快,环氧乙烷选择性略微增大;主要原因是温度得到较好控制,催化剂活性较强
D.若进料气中O2比例增大,环氧乙烷产率降低;其中主要原因是环氧乙烷转化为乙醛

(3)已知“反应床”中压强对乙烯转化率和环氧乙烷选择性的影响如图3:

请解释当反应体系中压强高于2.4Mpa,导致环氧乙烷选择性下降的主要原因:
(4)不同进料组分,环氧乙烷产率不同;其中进料气n(O2):n(C2H4)=1:2时,随CO2含量变化,环氧乙烷的产率变化如图4。请在图4上画出进料气n(O2):n(C2H4)=3:1时,随CO2含量变化,环氧乙烷的产率变化曲线
(二)环氧丙烷是一种重要的化工原料,且广泛用途。有机电化学法电解合成环氧丙烷是一种常见的生成工艺;其原理是将丙烯与电解饱和食盐水的电解产物反应,转化为氯丙醇(CH3CHOHCH2Cl),氯丙醇进一步反应生成环氧丙烷。其电解简易装置如图。

(1)写出a电极的电极反应式:
(2)写出b电极区域生成环氧丙烷的化学方程式:
您最近一年使用:0次
10 . 碳氢化合物有多种,它们在工业生产、生活中有重要用途。
(1)工业上可由丁烯(C4H8)来制备丙烯(C3H6)和乙烯(C2H4),其主要反应原理为:
反应I:C4H8 (g)
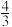 C3H6(g) ΔH1
C3H6(g) ΔH1
反应II:C4H8(g) 2C2H4 (g) ΔH2
2C2H4 (g) ΔH2
①已知烃的裂解是吸热反应,则ΔH1________ ΔH2(填“>”、 “=”或“<”)。
②若某温度下反应达到平衡时C4H8、C3H6、C2H4的体积分数分别为20%、70%、10%,平衡时总压强为P,请计算该温度下反应II的平衡常数Kp=________ (Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
(2)石油危机日渐严重,甲烷的转化和利用在天然气化工行业有非常重要的作用。甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和H2混合气体)。现在常见的重整技术有甲烷-水蒸气重整,甲烷-二氧化碳重整,其反应分别为:
CH4(g) + H2O(g)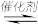 CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
CH4(g) + CO2(g)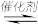 2CO(g) + 2H2(g)
2CO(g) + 2H2(g)
①下图为反应压强为0.3 MPa,投料比n(H2O)/n(CH4)为1,在三种不同催化剂催化作用下,甲烷-水蒸气重整反应中CH4转化率随温度变化的关系。


下列说法正确的是________ 。
A 在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ
B b点CH4的转化率高于a点,原因是b、a两点均未达到平衡状态,b点温度高,反应速率较快,故CH4的转化率较大
C C点一定未达到平衡状态
D 催化剂只改变反应速率不改变平衡移动,所以在850℃时,不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同
②催化剂Ⅰ也可以催化甲烷-二氧化碳重整。在催化剂Ⅰ催化下,反应温度850 oC ,n(H2O)/n(CH4)为1的体系中,加入CO2。画出反应达到平衡时n(H2)/n(CO)随进料时n(CO2)/n(CH4)的变化曲线。(已知:甲烷-二氧化碳重整的平衡常数>>甲烷-水蒸气重整反应的平衡常数)________ 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
①阳极的电极反应式为________ 。
②电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL10 g/L 乳酸溶液通电一段时间后,浓度上升为 145 g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为________ L。(乳酸的摩尔质量为90g/ mol )
(1)工业上可由丁烯(C4H8)来制备丙烯(C3H6)和乙烯(C2H4),其主要反应原理为:
反应I:C4H8 (g)

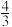 C3H6(g) ΔH1
C3H6(g) ΔH1反应II:C4H8(g)
 2C2H4 (g) ΔH2
2C2H4 (g) ΔH2①已知烃的裂解是吸热反应,则ΔH1
②若某温度下反应达到平衡时C4H8、C3H6、C2H4的体积分数分别为20%、70%、10%,平衡时总压强为P,请计算该温度下反应II的平衡常数Kp=
(2)石油危机日渐严重,甲烷的转化和利用在天然气化工行业有非常重要的作用。甲烷重整技术主要是利用甲烷和其他原料来制备合成气(CO和H2混合气体)。现在常见的重整技术有甲烷-水蒸气重整,甲烷-二氧化碳重整,其反应分别为:
CH4(g) + H2O(g)
 CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0CH4(g) + CO2(g)
 2CO(g) + 2H2(g)
2CO(g) + 2H2(g)①下图为反应压强为0.3 MPa,投料比n(H2O)/n(CH4)为1,在三种不同催化剂催化作用下,甲烷-水蒸气重整反应中CH4转化率随温度变化的关系。


下列说法正确的是
A 在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ
B b点CH4的转化率高于a点,原因是b、a两点均未达到平衡状态,b点温度高,反应速率较快,故CH4的转化率较大
C C点一定未达到平衡状态
D 催化剂只改变反应速率不改变平衡移动,所以在850℃时,不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同
②催化剂Ⅰ也可以催化甲烷-二氧化碳重整。在催化剂Ⅰ催化下,反应温度850 oC ,n(H2O)/n(CH4)为1的体系中,加入CO2。画出反应达到平衡时n(H2)/n(CO)随进料时n(CO2)/n(CH4)的变化曲线。(已知:甲烷-二氧化碳重整的平衡常数>>甲烷-水蒸气重整反应的平衡常数)
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
①阳极的电极反应式为

②电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL10 g/L 乳酸溶液通电一段时间后,浓度上升为 145 g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为
您最近一年使用:0次



