名校
解题方法
1 . 钽(Ta)和铌(Nb)的性质相似,因此常常共生于自然界的矿物中。一种以钽铌伴生矿(主要成分为SiO2、MnO2、Nb2O5、Ta2O5和少量的TiO2、FeO、CaO、MgO)为原料制取钽和铌的流程如下:
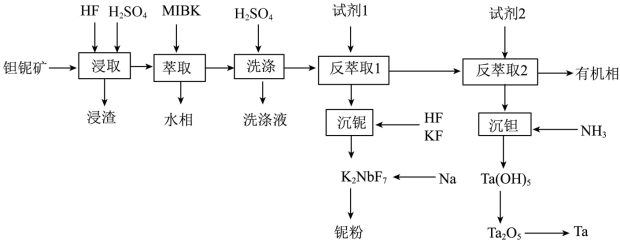
“浸取”后,浸出液中含有H2TaF7、H2NbF7两种二元强酸和锰、钛等元素。已知:
①MIBK为甲基异丁基酮;
②Ksp(CaF2)=2.5×10-11,Ksp(MgF2)=6.4×10-9
(1)“浸取”时通常在_______材料的反应器中进行(填标号)。
(2)浸渣的主要成分是_______ ,Ta2O5发生的离子方程式为_______ 。
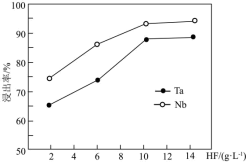
(3)“浸取”时,HF的浓度对铌、钽的浸出率的影响如下图所示,则HF的最佳浓度约为_______ molL1。
(4)金属铌可用金属钠还原K2NbF7制取,也可用电解熔融的K2NbF7制取。
①流程中钠热还原法制备铌粉的化学方程式为_______ 。
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,电解总化学反应方程式为_______ 。
(5)铌(41Nb)和镍合金的用途非常广泛,Nb、Ni互化物的晶胞结构如图所示:
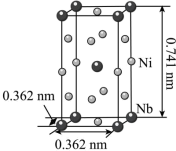
①基态Nb原子核外有_______ 种能量不同的电子。
②Nb、Ni互化物晶体的密度为_______ g/m3(列出计算式)。

“浸取”后,浸出液中含有H2TaF7、H2NbF7两种二元强酸和锰、钛等元素。已知:
①MIBK为甲基异丁基酮;
②Ksp(CaF2)=2.5×10-11,Ksp(MgF2)=6.4×10-9
(1)“浸取”时通常在_______材料的反应器中进行(填标号)。
| A.陶瓷 | B.玻璃 | C.铁 | D.塑料 |
(3)“浸取”时,HF的浓度对铌、钽的浸出率的影响如下图所示,则HF的最佳浓度约为

(4)金属铌可用金属钠还原K2NbF7制取,也可用电解熔融的K2NbF7制取。
①流程中钠热还原法制备铌粉的化学方程式为
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,电解总化学反应方程式为
(5)铌(41Nb)和镍合金的用途非常广泛,Nb、Ni互化物的晶胞结构如图所示:

①基态Nb原子核外有
②Nb、Ni互化物晶体的密度为
您最近一年使用:0次
2023-09-23更新
|
103次组卷
|
2卷引用:重庆市第一中学校2023-2024学年高三上学期开学考试化学试题
名校
解题方法
2 . 碲在冶金工业中用途广泛,被誉为现代工业的维生素。某精炼铜的阳极泥经过处理后的主要成分为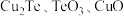 等,从中回收碲和胆矾的工艺如下:
等,从中回收碲和胆矾的工艺如下: 和
和 ;
;
② 在酸性条件下会发生歧化反应;
在酸性条件下会发生歧化反应;
③ 元素在酸化和碱浸后分别转化为
元素在酸化和碱浸后分别转化为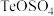 和
和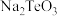
两种易溶于水的盐 。
回答下列问题:
(1)“高温焙烧”时,从结构的角度分析 的产物是
的产物是 而不是
而不是 的原因为
的原因为___________ 。
(2)“酸化”时还需要加入一定量的 ,其目的是
,其目的是___________ 。
(3)“还原”时发生反应的离子方程式为___________ 。
(4)碱浸后铜元素的存在形式为___________ (写化学式)。
(5)“电解”制 的原理如图,其中N与电源的
的原理如图,其中N与电源的___________ (填“正极”或“负极”)相连:与M相连的惰性电极上发生电极反应式为___________ 。
(7) 的立方晶胞结构如图。其中
的立方晶胞结构如图。其中 的配位数为
的配位数为___________ ;已知晶胞边长为 ,
, 为阿伏伽德罗常数的值,则该晶体的密度为
为阿伏伽德罗常数的值,则该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
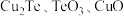 等,从中回收碲和胆矾的工艺如下:
等,从中回收碲和胆矾的工艺如下:
 和
和 ;
;②
 在酸性条件下会发生歧化反应;
在酸性条件下会发生歧化反应;③
 元素在酸化和碱浸后分别转化为
元素在酸化和碱浸后分别转化为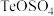 和
和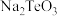
回答下列问题:
(1)“高温焙烧”时,从结构的角度分析
 的产物是
的产物是 而不是
而不是 的原因为
的原因为(2)“酸化”时还需要加入一定量的
 ,其目的是
,其目的是(3)“还原”时发生反应的离子方程式为
(4)碱浸后铜元素的存在形式为
(5)“电解”制
 的原理如图,其中N与电源的
的原理如图,其中N与电源的

| A.胆矾晶体中含有离子键、配位键、氢键等化学键 | B.胆矾属于离子晶体 |
C. 的空间结构为正四面体形 的空间结构为正四面体形 | D.电负性O>S,第一电离能 |
(7)
 的立方晶胞结构如图。其中
的立方晶胞结构如图。其中 的配位数为
的配位数为 ,
, 为阿伏伽德罗常数的值,则该晶体的密度为
为阿伏伽德罗常数的值,则该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2023-06-22更新
|
477次组卷
|
3卷引用:重庆市渝北中学校2023-2024学年高三上学期12月月考化学试题
2023·全国·模拟预测
名校
解题方法
3 . MnSO4·H2O是一种浅粉色晶体,易溶于水,不溶于乙醇,是饲料中常用的添加剂,也是电解制备锰及其他锰盐的原料,工业用途广泛。某同学设计如图甲所示实验装置制备硫酸锰。
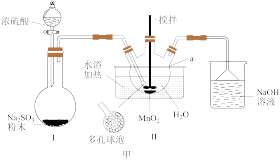
回答下列问题:
(1)仪器a的名称是_____ 。连接好实验仪器,装药品之前需进行的操作是______ 。
(2)装置Ⅱ中发生反应的化学方程式为_____ ;装置Ⅱ中水浴温度控制在80℃左右,温度过高时反应速率可能减慢的原因是______ 。
(3)结合图乙,分析反应后从溶液中获得MnSO4·H2O晶体的操作为_____ 、酒精洗涤、低温干燥。
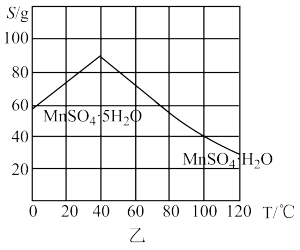
(4)测定饲料中硫酸锰的含量常将饲料溶于水,以磷酸作络合剂,用硝酸铵作氧化剂,将试样中的二价锰定量氧化成三价锰,过量的硝酸铵立即与产生的亚硝酸盐反应而消除其影响。然后加入指示剂,用硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定生成的三价锰,溶液由红色变为亮黄色为滴定终点。有关反应的离子方程式如下:
①2Mn2++NO +4PO
+4PO +2H+=2[Mn(PO4)2]3-+NO
+2H+=2[Mn(PO4)2]3-+NO +H2O;
+H2O;
②NH +NO
+NO =N2↓+2H2O;
=N2↓+2H2O;
③[Mn(PO4)2]3-+Fe2+=Mn2++[Fe(PO4)2]3-。
取ag饲料,消耗浓度为cmol•L-1的硫酸亚铁铵标准溶液VmL,则饲料中MnSO4·H2O的质量分数为_____ %(用含a、c、V的式子表示)。若实验时未用标准溶液润洗滴定管,会导致测定结果_____ (填“偏大”“偏小”或“无影响”)。
(5)用惰性电极电解MnSO4酸性溶液可制得MnO2,请写出电解法制备MnO2时的阳极反应式:_____ 。

回答下列问题:
(1)仪器a的名称是
(2)装置Ⅱ中发生反应的化学方程式为
(3)结合图乙,分析反应后从溶液中获得MnSO4·H2O晶体的操作为

(4)测定饲料中硫酸锰的含量常将饲料溶于水,以磷酸作络合剂,用硝酸铵作氧化剂,将试样中的二价锰定量氧化成三价锰,过量的硝酸铵立即与产生的亚硝酸盐反应而消除其影响。然后加入指示剂,用硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定生成的三价锰,溶液由红色变为亮黄色为滴定终点。有关反应的离子方程式如下:
①2Mn2++NO
 +4PO
+4PO +2H+=2[Mn(PO4)2]3-+NO
+2H+=2[Mn(PO4)2]3-+NO +H2O;
+H2O;②NH
 +NO
+NO =N2↓+2H2O;
=N2↓+2H2O;③[Mn(PO4)2]3-+Fe2+=Mn2++[Fe(PO4)2]3-。
取ag饲料,消耗浓度为cmol•L-1的硫酸亚铁铵标准溶液VmL,则饲料中MnSO4·H2O的质量分数为
(5)用惰性电极电解MnSO4酸性溶液可制得MnO2,请写出电解法制备MnO2时的阳极反应式:
您最近一年使用:0次
2023-04-11更新
|
299次组卷
|
4卷引用:重庆市乌江新高考协作体2023-2024学年高三上学期第一次联合调研抽测(一模)化学试题
重庆市乌江新高考协作体2023-2024学年高三上学期第一次联合调研抽测(一模)化学试题(已下线)化学押题卷(一)河南省焦作市博爱县第一中学2023-2024学年高三下学期开学化学试题(已下线)T26-实验综合题
4 . 甲醇是重要的化工原料,研究甲醇的制备及用途在工业上有重要的意义。常见的制备方法如下:
反应I: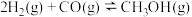

反应II: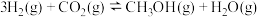

反应III:

回答下列问题:
(1)对于反应I,可以同时提高反应速率和 产率的措施有_______(填字母序号)。
产率的措施有_______(填字母序号)。
(2) 时,在2 L刚性容器中投入
时,在2 L刚性容器中投入
 和
和
 ,初始压强为
,初始压强为 ,若只发生反应II,
,若只发生反应II, 后达到平衡,压强为
后达到平衡,压强为 ,回答下列问题:
,回答下列问题:
①H2的反应速率v(H2)=_______ 
②下列描述能说明反应达到平衡状态的是_______ (填序号)。
A.混合气体的密度保持不变
B.容器中 ,且保持不变
,且保持不变
C.容器中 的体积分数保持不变
的体积分数保持不变
D.体系的压强保持恒定
③该反应的平衡常数为_______  。
。
(3)利用甲醇燃料电池作为电源,可以制取 ,工作原理如下图所示,假设离子交换膜只允许
,工作原理如下图所示,假设离子交换膜只允许 通过,一段时间后,铁电极减少16.8 g。
通过,一段时间后,铁电极减少16.8 g。

①阳极区的电极反应为_______ 。
②镍电极产生气体的体积为_______ L(标准状况)。
③电解池两端溶液质量的变化差为_______ g。
反应I:
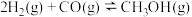

反应II:
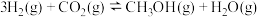

反应III:


回答下列问题:
(1)对于反应I,可以同时提高反应速率和
 产率的措施有_______(填字母序号)。
产率的措施有_______(填字母序号)。| A.升高反应温度 | B.使用高效催化剂 |
| C.增大体系压强 | D.增大 和 和 的初始投料比 的初始投料比 |
 时,在2 L刚性容器中投入
时,在2 L刚性容器中投入
 和
和
 ,初始压强为
,初始压强为 ,若只发生反应II,
,若只发生反应II, 后达到平衡,压强为
后达到平衡,压强为 ,回答下列问题:
,回答下列问题:①H2的反应速率v(H2)=

②下列描述能说明反应达到平衡状态的是
A.混合气体的密度保持不变
B.容器中
 ,且保持不变
,且保持不变C.容器中
 的体积分数保持不变
的体积分数保持不变D.体系的压强保持恒定
③该反应的平衡常数为
 。
。(3)利用甲醇燃料电池作为电源,可以制取
 ,工作原理如下图所示,假设离子交换膜只允许
,工作原理如下图所示,假设离子交换膜只允许 通过,一段时间后,铁电极减少16.8 g。
通过,一段时间后,铁电极减少16.8 g。
①阳极区的电极反应为
②镍电极产生气体的体积为
③电解池两端溶液质量的变化差为
您最近一年使用:0次
名校
解题方法
5 . Ⅰ. 催化加氢制烯烃(
催化加氢制烯烃(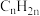 )是缓解化石能源消耗、实现减排的重要途径之一。其转化路径(
)是缓解化石能源消耗、实现减排的重要途径之一。其转化路径(
 )涉及的主要反应如下:
)涉及的主要反应如下:
ⅰ.

ⅱ. n=2时,
n=2时,
ⅲ.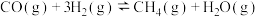

(1)

_______ 
(2)不利于提高 平衡转化率的措施有_______(填序号)。
平衡转化率的措施有_______(填序号)。
(3)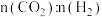 投料比为1:2,压力为2MPa时,无烷烃产物的平衡体系中
投料比为1:2,压力为2MPa时,无烷烃产物的平衡体系中 转化率和产物选择性随反应温度变化曲线如图所示:
转化率和产物选择性随反应温度变化曲线如图所示:

①有利于短链烯烃(n≤4)生成的温度范围为_______ (填序号)。
a.973~1173K B.773~973K C.573~773K D.373~573K
②计算1083K时,反应ⅰ的
_______ 。
③373~1173K范围内, 的转化率先降低后升高的原因是
的转化率先降低后升高的原因是_______ 。
(4) 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:_______ 。
Ⅱ.电致变色系统常用于汽车玻璃中,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节(如图所示)。

已知: 和
和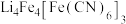 ;均为无色透明,
;均为无色透明,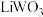 和
和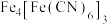 均为蓝色。
均为蓝色。
(5)当Y接电源的_______ (填“正极”或“负极”),膜的透射率降低,可以有效阻挡阳光,此时离子储存层发生的反应为_______ 。
 催化加氢制烯烃(
催化加氢制烯烃(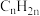 )是缓解化石能源消耗、实现减排的重要途径之一。其转化路径(
)是缓解化石能源消耗、实现减排的重要途径之一。其转化路径(
 )涉及的主要反应如下:
)涉及的主要反应如下:ⅰ.


ⅱ.
 n=2时,
n=2时,
ⅲ.
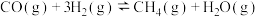

(1)



(2)不利于提高
 平衡转化率的措施有_______(填序号)。
平衡转化率的措施有_______(填序号)。| A.增大体系压强 | B.增大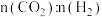 投料比 投料比 |
| C.使用高效催化剂 | D.及时分离 |
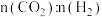 投料比为1:2,压力为2MPa时,无烷烃产物的平衡体系中
投料比为1:2,压力为2MPa时,无烷烃产物的平衡体系中 转化率和产物选择性随反应温度变化曲线如图所示:
转化率和产物选择性随反应温度变化曲线如图所示:
①有利于短链烯烃(n≤4)生成的温度范围为
a.973~1173K B.773~973K C.573~773K D.373~573K
②计算1083K时,反应ⅰ的

③373~1173K范围内,
 的转化率先降低后升高的原因是
的转化率先降低后升高的原因是(4)
 用途广泛,写出基于其物理性质的一种用途:
用途广泛,写出基于其物理性质的一种用途:Ⅱ.电致变色系统常用于汽车玻璃中,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节(如图所示)。

已知:
 和
和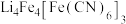 ;均为无色透明,
;均为无色透明,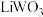 和
和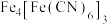 均为蓝色。
均为蓝色。(5)当Y接电源的
您最近一年使用:0次
名校
6 . 锗属于稀有分散元素,一种以锗精矿(含GeO2、GeO、SiO2、As2O3)制备高纯二氧化锗的工艺流程如下:

下列数据是对应物质的熔点:
(1)第32号元素锗的原子结构示意图________ ,根据锗在元素周期表中的位置写出单质锗的一种用途________ 。
(2)“焙烧”前,粉碎锗精矿的目的是________ 。矿渣1的主要成分是________ 。
(3)“还原焙烧”中,含Ge氧化物在不同气氛中的挥发情况如图。800~1100℃之间,含Ge氧化物在CO中的挥发率明显高于空气中的原因是________ 。

(4)“碱浸氧化”后,GeO转化为锗酸盐,请写出反应的离子方程式________ 。
(5)“精馏水解”发生反应的化学方程式________ 。
(6)在氯化物熔盐中,电解SiO2和GeO2的混合物,可制得硅锗合金。反应原理如下:
SiO2+GeO2 SiGe(合金)+2O2↑
SiGe(合金)+2O2↑
生成硅锗合金的电极为________ (填“阳极”或“阴极”),写出生成O2的电极反应式________ 。

下列数据是对应物质的熔点:
| 物质 | GeO2 | GeO | SiO2 | As2O3 |
| 熔点/℃ | 1115 | 710(升华) | 1723 | 193(升华) |
(2)“焙烧”前,粉碎锗精矿的目的是
(3)“还原焙烧”中,含Ge氧化物在不同气氛中的挥发情况如图。800~1100℃之间,含Ge氧化物在CO中的挥发率明显高于空气中的原因是

(4)“碱浸氧化”后,GeO转化为锗酸盐,请写出反应的离子方程式
(5)“精馏水解”发生反应的化学方程式
(6)在氯化物熔盐中,电解SiO2和GeO2的混合物,可制得硅锗合金。反应原理如下:
SiO2+GeO2
 SiGe(合金)+2O2↑
SiGe(合金)+2O2↑生成硅锗合金的电极为
您最近一年使用:0次
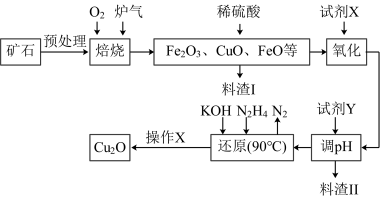
7 . 氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
(1)炉气中的有害气体成分是__________ ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________ 。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________ 。当试剂X是______ 时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________ 。
(4)写出用N2H4制备Cu2O的化学方程式:________ ,操作X包括_________ 、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________ 。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________ 。

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀 | 7.5 | 2.7 | 4.8 |
| 完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:
(3)加入试剂Y调pH时,pH的调控范围是
(4)写出用N2H4制备Cu2O的化学方程式:
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:
您最近一年使用:0次
2020-03-16更新
|
676次组卷
|
11卷引用:重庆市云阳江口中学校2020届高三上学期第二次月考理综化学试题
重庆市云阳江口中学校2020届高三上学期第二次月考理综化学试题【市级联考】河南省安阳市2019届高三下学期二模考试理科综合化学试题2019年秋高三化学复习强化练习—— 离子反应方程式及离子共存2020届人教版高三化学二轮复习非选择题专攻练——工艺流程云南省楚雄州禄丰县第一中学2020届高三下学期3月线上模拟考试理综化学试题西藏自治区拉萨市拉萨中学2020届高三第六次月考理科化学试题山东省2020届高三模拟考试化学(二)山西省运城市稷山县第二中学2020届高三上学期第三次月考化学试题四川省成都实验中学2021届高三上学期11月月考理综化学试题云南省大理州祥云四中2020届高三下学期3月线上模拟考试理综化学试题四川省内江市威远中学2021-2022学年高三上学期第三次月考化学试题
8 . 亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2∙12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______ 。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________ 。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________ 。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________ 。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________ 。若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4∙FeSO4】溶液后,再与NaClO溶液混合,观察试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为____________ 。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________ 。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式
您最近一年使用:0次
2019-01-30更新
|
443次组卷
|
3卷引用:2016届重庆市南开中学高三7月月考化学试卷1
名校
9 . 菱锰矿的主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素。氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①相关金属离子[c0(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
②常温下,CaF2、MgF2的溶度积常数分别为1.46×10-10、 7.42×10-11
回答下列问题:
(1) “焙烧”时发生的主要反应的化学方程式为__________ 。气体X为________ (填化学式),写出它生活中的一种用途_______________ 。
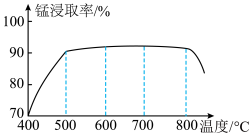
(2)焙烧时温度对锰浸出率的影响如图所示。焙烧时适应温度为_______________ 。
(3)浸出液“净化除杂”过程如下:首先用MnO2将Fe2+氧化为Fe3+,再调节溶液的pH将Al3+、Fe3+变成沉淀除去,溶液的pH的范围为____ 然后加入NH4F将Ca2+、Mg2+转化为CaF2、MgF2沉淀除去,两种沉淀共存时,溶液中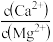 =
=________ (所得结果保留两位小数)。
(4)碳化结晶的原理(用离子方程式表示):______________________ 。
(5)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为_________ 。
(6)在该工艺流程中可以循环使用的物质有__________ 。(填化学式)

已知:①相关金属离子[c0(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
②常温下,CaF2、MgF2的溶度积常数分别为1.46×10-10、 7.42×10-11
回答下列问题:
(1) “焙烧”时发生的主要反应的化学方程式为
(2)焙烧时温度对锰浸出率的影响如图所示。焙烧时适应温度为

(3)浸出液“净化除杂”过程如下:首先用MnO2将Fe2+氧化为Fe3+,再调节溶液的pH将Al3+、Fe3+变成沉淀除去,溶液的pH的范围为
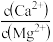 =
=(4)碳化结晶的原理(用离子方程式表示):
(5)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为
(6)在该工艺流程中可以循环使用的物质有
您最近一年使用:0次
2019-04-19更新
|
643次组卷
|
3卷引用:【全国百强校】重庆市西南大学附属中学校2019届高三下学期第九次月考理科综合化学试题
10 . 二氧化硫和硫化氢都是有毒物质,但它们在工业上都有着重要的用途。请回答下列有关问题:
(1)燃煤脱硫是科研工作者研究的重要课题之一,已知有两种脱硫方法,一是活性炭作化氧化法脱流;二是CO还原法脱硫。
①活性炭在反应过程中作为催化剂,改变了______ (填选项字母)。
a.反应限度b.反应速率c.反应活化能d.反应焓变e.反应路径
②CO还原法的原理是: 2CO(g) +SO2(g) S(g) +2CO2(g),△H。
S(g) +2CO2(g),△H。
已知:S(g) +O2(g) =SO2(g),△H1= -574.0kJ/mol,CO的燃烧热为283. 0kJ/mol,则△H=___ 。
③在两个容积为10L的恒容绝热密闭容器中发生反应:
2CO(g) +SO2(g) S(g) +2CO2(g),各起始反应物的物质的量如右表所示,起始温度均为T℃。两容器中平衡常数K甲
S(g) +2CO2(g),各起始反应物的物质的量如右表所示,起始温度均为T℃。两容器中平衡常数K甲______ K乙(填“>”“=”或“<”),理由是__________ 。
(2)H2S受热发生分解反应: 2H2S(g)= 2H2(g) +S2(g),在密闭容器中,充入0.20mol H2S(g),压强为p时,控制不同的温度进行实验,H2S的平衡转化率如图所示。
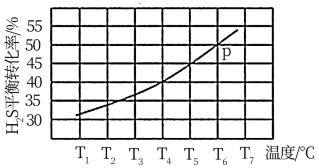
①出强为p,温度为T6℃时,反应经tmin达到平衡,则平均反应速率v(S2)=_______ mol/min.
②若压强p=aMPa,温度为T4℃时,该反应的平衡常数Kp=____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)H2S废气可用足量烧碱溶液吸收,将吸收后的溶液加入由惰性电极组成的电解池中进行电解,阳极区可生成Sx2-。请写出生成Sx2-的电极反应式____________ 。
(1)燃煤脱硫是科研工作者研究的重要课题之一,已知有两种脱硫方法,一是活性炭作化氧化法脱流;二是CO还原法脱硫。
①活性炭在反应过程中作为催化剂,改变了
a.反应限度b.反应速率c.反应活化能d.反应焓变e.反应路径
②CO还原法的原理是: 2CO(g) +SO2(g)
 S(g) +2CO2(g),△H。
S(g) +2CO2(g),△H。已知:S(g) +O2(g) =SO2(g),△H1= -574.0kJ/mol,CO的燃烧热为283. 0kJ/mol,则△H=
③在两个容积为10L的恒容绝热密闭容器中发生反应:
2CO(g) +SO2(g)
 S(g) +2CO2(g),各起始反应物的物质的量如右表所示,起始温度均为T℃。两容器中平衡常数K甲
S(g) +2CO2(g),各起始反应物的物质的量如右表所示,起始温度均为T℃。两容器中平衡常数K甲| 容器 | 起始的物质的量/mol | |||
| CO(g) | SO2(g) | S(g) | CO2(g) | |
| 甲 | 1 | 0.5 | 0 | 0 |
| 乙 | 1 | 0.5 | 0.5 | 0 |
(2)H2S受热发生分解反应: 2H2S(g)= 2H2(g) +S2(g),在密闭容器中,充入0.20mol H2S(g),压强为p时,控制不同的温度进行实验,H2S的平衡转化率如图所示。

①出强为p,温度为T6℃时,反应经tmin达到平衡,则平均反应速率v(S2)=
②若压强p=aMPa,温度为T4℃时,该反应的平衡常数Kp=
(3)H2S废气可用足量烧碱溶液吸收,将吸收后的溶液加入由惰性电极组成的电解池中进行电解,阳极区可生成Sx2-。请写出生成Sx2-的电极反应式
您最近一年使用:0次



