名校
1 . 用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项所列对应关系均正确的一项是


| 选项 | X极 | 实验前U形管中液体 | 通电后现象及结论 |
| A | 负极 | CuCl2溶液 | b管中有气体逸出 |
| B | 负极 | NaOH溶液 | 溶液pH降低 |
| C | 正极 | Na2SO4溶液 | U形管两端滴入酚酞后,a管中呈红色 |
| D | 正极 | AgNO3溶液 | b管中电极反应式是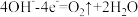 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-04更新
|
3239次组卷
|
15卷引用:内蒙古通辽市开鲁县第一中学2021-2022学年高一下学期6月检测化学试题
内蒙古通辽市开鲁县第一中学2021-2022学年高一下学期6月检测化学试题福建省龙岩第一中学2021-2022学年高二上学期开学考试化学试题(已下线)专题4.2.1 电解原理(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)4.3.2 电解原理的应用-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第4章 电化学基础(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)四川师范大学附属中学安宁校区2021-2022学年高二上学期期中考试化学试题江苏省常熟中学2022-2023学年高二上学期10月份阳光调研化学(选修)试题河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题江苏省常熟市王淦昌高级中学2022-2023学年高二上学期10月月考化学试卷辽宁省辽阳市第二高级中学2022-2023学年高二上学期12月月考化学试题吉林省长春市第五中学2022-2023学年高二上学期期中考试化学试题江苏省连云港市东海县石榴高级中学2022-2023学年高二上学期第一次学情测试化学试题河北省唐山市开滦第二中学2023-2024学年高二上学期第一次月考化学试题江苏省江阴市要塞中学2022-2023学年高二上学期期中考试化学试题吉林省梅河口市第五中学2023-2024学年高二上学期12月月考化学试题
解题方法
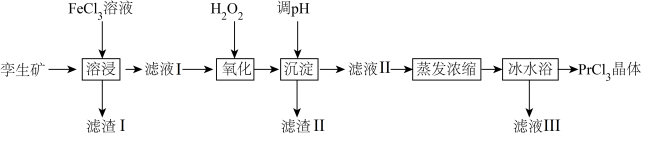
2 . 无水氯化镨(PrCl3)是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含 、
、 、
、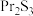 、
、 等)制备氯化镨晶体(
等)制备氯化镨晶体(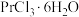 )。
)。
已知:①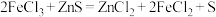 ;
;
②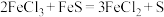 ;
;
③该条件下,溶液中部分金属离子生成氢氧化物开始沉淀和沉淀完全时的pH如表所示:
④沉淀时加入氨水逐步调节溶液的pH至6.5。此时滤渣中Ⅱ不含Pr的化合物。
回答下列问题:
(1)为了提高镨元素的浸出率,可采取的措施有___________ (填一种即可)。
(2)滤渣Ⅰ的主要成分为 和
和 ;
;
①写出 的一种用途:
的一种用途:___________ 。
②S可用来处理体温计破碎时渗出的液态Hg,还可用来制黑火药(由硫黄粉、硝酸钾和木炭混合而成,爆炸时的生成物为硫化钾、氮气和二氧化碳),写出黑火药爆炸时发生反应的化学方程式:___________ 。
(3)加入 的目的是
的目的是___________ ,其发生反应的离子方程式为___________ 。
(4)滤渣Ⅱ的主要成分为___________ (填化学式)。
(5)利用表中的数据求出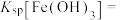
___________ 。
(6)利用电解法可以生产金属镨。先将氯化镨与工业纯KCl配成二元电解质体系( ),然后置于槽内熔化,通入直流电进行电解(如图所示,两电极均为惰性电极)。
),然后置于槽内熔化,通入直流电进行电解(如图所示,两电极均为惰性电极)。
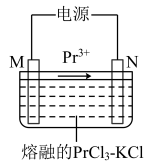
①M电极与电源的___________ (㙋“正极”或“负极”)相连。
②电池工作时,每转移 个电子,此时产生的气体的体积为
个电子,此时产生的气体的体积为___________ L(已换算成标准状况下)。
 、
、 、
、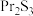 、
、 等)制备氯化镨晶体(
等)制备氯化镨晶体(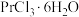 )。
)。
已知:①
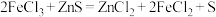 ;
;②
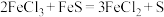 ;
;③该条件下,溶液中部分金属离子生成氢氧化物开始沉淀和沉淀完全时的pH如表所示:
| 金属离子 |  |  |  |
开始沉淀时的 | 5.4 | 2.2 | 7.5 |
沉淀完全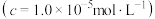 时的 时的 | 6.4 | 3.2 | 9.0 |
回答下列问题:
(1)为了提高镨元素的浸出率,可采取的措施有
(2)滤渣Ⅰ的主要成分为
 和
和 ;
;①写出
 的一种用途:
的一种用途:②S可用来处理体温计破碎时渗出的液态Hg,还可用来制黑火药(由硫黄粉、硝酸钾和木炭混合而成,爆炸时的生成物为硫化钾、氮气和二氧化碳),写出黑火药爆炸时发生反应的化学方程式:
(3)加入
 的目的是
的目的是(4)滤渣Ⅱ的主要成分为
(5)利用表中的数据求出
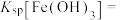
(6)利用电解法可以生产金属镨。先将氯化镨与工业纯KCl配成二元电解质体系(
 ),然后置于槽内熔化,通入直流电进行电解(如图所示,两电极均为惰性电极)。
),然后置于槽内熔化,通入直流电进行电解(如图所示,两电极均为惰性电极)。
①M电极与电源的
②电池工作时,每转移
 个电子,此时产生的气体的体积为
个电子,此时产生的气体的体积为
您最近一年使用:0次
解题方法
3 . 铁及其化合物在生产和生活中具有广泛的用途。请回答下列问题。
(1)铁制品暴露在潮湿空气中容易发生腐蚀,通过图甲所示装置可验证铁钉是否发生电化学腐蚀,正极反应式是___________ 。

(2)利用图乙装置可模拟工业生产高铁酸盐,阳极反应为___________ ,阴极区的溶液
___________ (填“增大”“减小”或“不变”)。利用高铁酸盐可制作新型可充电电池,该电池的总反应为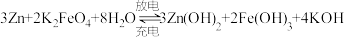 ,充电时阳极反应为
,充电时阳极反应为___________ ,放电时每转移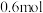 电子,正极有
电子,正极有___________ 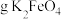 被还原。
被还原。
(1)铁制品暴露在潮湿空气中容易发生腐蚀,通过图甲所示装置可验证铁钉是否发生电化学腐蚀,正极反应式是

(2)利用图乙装置可模拟工业生产高铁酸盐,阳极反应为

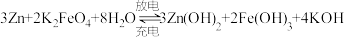 ,充电时阳极反应为
,充电时阳极反应为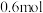 电子,正极有
电子,正极有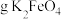 被还原。
被还原。
您最近一年使用:0次
9-10高二下·浙江台州·阶段练习
名校
解题方法
4 . 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:还原性Fe>Ni>Cu)
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中有Cu和Pt |
您最近一年使用:0次
2022-08-15更新
|
1464次组卷
|
119卷引用:内蒙古包头市2021-2022学年高二上学期期末考试化学试题
内蒙古包头市2021-2022学年高二上学期期末考试化学试题(已下线)浙江省临海市白云中学2009—2010学年度高二下学期第一次月考化学试题(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2011届福建省三明一中高三上学期期中考试化学卷(已下线)2011届山东省济南外国语学校高三上学期第三次质量检测化学试卷(已下线)2010-2011学年江苏省南京六中高二下学期期末考试化学试题(已下线)2011-2012学年山东省潍坊市高二寒假作业化学(一)试卷(已下线)2011-2012学年福建南平政和一中高二期末考试化学试卷(已下线)2011-2012学年天津市耀华中学高二上学期期末考试化学试卷(已下线)2011-2012学年陕西省师大附中高一下学期期末考试化学试卷(已下线)2013届江苏省泰州中学高三上学期期中考试化学试卷(已下线)2013届山东省济宁市鱼台一中高三上学期期中考试化学试卷(已下线)2014高考名师推荐化学电解三池的应用(已下线)2013-2014天津市耀华中学高二上学期期末考试化学试卷(已下线)2015安徽望江中学同步课时练(人教选修4)第四章检测试卷2014-2015四川省重点中学高二下学期期中考试化学试卷2015-2016学年福建省四地六校高二上学期10月联考化学试卷2015-2016学年福建省四地六校高二上学期10月一次联考化学试卷2016届湖南省十校共同体高三上学期12月联考化学试卷2015-2016学年河北省故城高级中学高二上12月月考化学试卷2016届山东省菏泽一中高三上学期12月月考化学试卷2015-2016学年吉林省延边三中高二上12月月考化学试卷2017届山东省滕州市第二中学高三上学期10月月考化学试卷2017届甘肃省天水一中高三上学期第一次月考化学卷2016-2017学年福建省四地六校高二上第一次月考化学试卷(已下线)同步君 选修4 第4章 第3节 电解原理的应用2016-2017学年河北石家庄一中高二上期中考试化学试卷2016-2017学年黑龙江哈尔滨六中高二上期末化学卷2016-2017学年江苏省如东高级中学高一下学期第一次(3月)阶段检测化学试卷福建省龙海市程溪中学2016-2017学年高二下学期期末考试化学试题山东省寿光现代中学2017-2018学年高二上学期开学考试化学试题河南省郑州市中牟县二中2017-2018学年高二第一次月考化学试题宁夏银川市六盘山高级中学2017-2018学年高二上学期第一次月考化学试题福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题河北省承德市第一中学2017-2018学年高二上学期第一次月考化学试题山东省垦利第一中学2017-2018学年高二上学期第一次月考化学试题四川省成都经开区实验中学2018届高三10月月考理综化学试题安徽省蚌埠市第二中学2017-2018学年高二上学期期中考试化学试题山东省菏泽市2017-2018学年高二上学期期中考试(B)化学试题高中化学人教版 选修四 第四章 电化学基础 第三节 电解池 电解池第二课时(电解原理的应用)陕西师范大学附中2017-2018第一学期高二年级化学期中考试化学试题天津市红桥区2017-2018学年高二上学期期末考试化学试题河南省豫南九校2017-2018学年高二上学期期末联考化学试题1河南省豫南九校2017-2018学年高二上学期期末联考化学试题2河北省承德市第二中学2017-2018学年高二上学期第一次月考化学试题2018-2019学年鲁科版高中化学选修四:第1章检测题河南省镇平县第一高级中学2018-2019学年高二上学期第一次月考化学试题吉林省辽源市田家炳高级中学2018-2019学年高二9月月考化学试题广东省惠州市惠东县惠东高级中学2018-2019学年高二上学期10月月考化学试题山东省鄄城市第一中学2018-2019学年高二上学期第一次月考化学试题陕西省黄陵中学2018-2019学年高二(重点班)上学期期中考试化学试题高二人教版选修4 第四章 第三节 电解池山东省泰安市宁阳一中2018-2019学年高二上学期阶段性考试三(12月)化学试题(已下线)考点10 电解原理 金属的腐蚀与防护——备战2019年浙江新高考化学考点四川省遂宁市2018-2019学年高二下学期期末考试化学试题云南省普洱市澜沧县民族中学2018-2019学年高二下学期期末考试化学试题四川省武胜县烈面中学校2018届高三9月入学考试化学试题(已下线)2019年9月22日 《每日一题》 2020年高考一轮复习-每周一测山东省泰安市宁阳县第一中学2019-2020学年高二上学期第一次段考化学试题(已下线)2019年12月4日 《每日一题》人教版(选修4)——电解精炼铜福建省泉州第十六中学2019-2020学年高二10月份月考化学试题2020年春季人教版高中化学选修4第四章《电化学基础》测试卷河北省沧州市泊头市第一中学2019-2020学年高二月考检测化学试题(已下线)【新东方】 2020-2福建省安溪一中2020年高一实验班线上阶段测试化学试题河北省泊头市第一中学2019-2020学年高二上学期期末模拟考试化学试卷四川省自贡市田家炳中学2019-2020学年高二下学期开学考试化学试题甘肃省西北师范大学附属中学2019-2020学年高二上学期期中考试化学试题甘肃省武威第一中学2019-2020学年高二下学期期中考试化学试题四川省泸县第四中学2019-2020学年高二下学期第四学月考试化学试题四川省泸县第一中学2019-2020学年高二下学期第四学月考试化学试题云南省昆明市官渡区第一中学2019-2020学年高二下学期期中考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二上学期开学考试化学试题黑龙江省哈尔滨市第一中学校2021届高三上学期开学测试化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第3节 电能转化为化学能——电解 课时2 电解原理的应用鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第3节 电能转化为化学能——电解高中必刷题高二选择性必修1第四章 化学反应与电能 第二节 电解池 课时2 电解原理的应用山东省菏泽市单县第五中学2020-2021学年高二上学期第一次月考(10月)化学试题福建省永安市第三中学2020-2021学年高二10月月考化学(选考班)试题福建省三明第一中学2020-2021学年高二上学期第一次月考化学试题人教版(2019)高二化学选择性必修1第四章 化学反应与电能 第二节 电解池 课时2 电解原理的应用湖北省武汉市蔡甸区汉阳一中2020-2021学年高二上学期9月联考化学试题(已下线)专题4.3.2 电解原理的应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)4.2.2 电解原理的应用(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)河北省石家庄市藁城区第一中学2019-2020学年高二上学期第三次月考化学试题(已下线)4.3.2 电解原理的应用(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练浙江省宁波市北仑中学2020-2021学年高一下学期期中考试化学(1班选考)试题解题达人.化学选择题(2021全国卷)提升小卷05江苏省苏州市吴中区2020-2021学年高二下学期期中调研测试化学试题河北沧州泊头一中2020-2021学年高一下学期第二次月考化学试卷黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题贵州省遵义市2020~2021学年高二下学期期末质量检测化学试题黑龙江省哈尔滨市第九中学校2020-2021学年高一下学期6月月考化学试题选择性必修1专题1第二单元 课时4 电解原理的应用(已下线)1.2.4 电解原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)江苏省外国语学校2020-2021学年高二下学期期中调研测试化学试卷河南省南阳市第五中学2021-2022学年高二上学期10月月考化学试题 福建师范大学附属中学2021-2022学年高二上学期期中考试化学试题黑龙江省实验中学2021-2022学年高二上学期期中考试化学试题(已下线)4.2.2 电解原理的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)辽宁省沈阳市市级重点高中联合体2021-2022学年高二上学期期末考试化学试题浙江省舟山市2021-2022学年高二上学期期末检测化学试题河北省保定市博野中学2021-2022学年高二上学期12月月考化学试题河北省衡水市武强中学2021-2022学年高二下学期期中考试化学试题辽宁省部分中学2021-2022学年高二下学期期末检测化学试题山东省德州市2020-2021学年高二上学期反应原理月考(B)化学试题辽宁省部分中学2021-2022学年高二上学期期末测试化学试题黑龙江省嫩江市第一中学2021-2022学年高二下学期开学考试化学试题河南省濮阳市元龙高级中学2021-2022学年高二下学期5月月考化学试题(已下线)第四章 化学反应与电能(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)湖北省襄阳市第一中学2022-2023学年高二上学期12月线上考试化学试题新疆阿克苏市实验中学2021-2022学年高二上学期期末考试化学试题(已下线)4.2.2 电解原理的应用-同步学习必备知识(已下线)第六章 化学反应与能量 第37讲 电解池 金属的腐蚀与防护第2课时 电解原理的应用福建省宁德市第一中学2021-2022学年高二上学期9月月考化学试题
解题方法
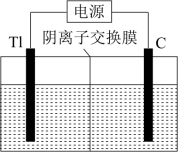
5 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料;铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、FeO、Tl2O等)中提炼,具体工艺流程如图。

已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H++CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)“浸取”过程中为提高铊的浸取速率,可采取的措施有___________ (写出两条)。
(2)残渣的主要成分为___________ (填化学式);在实验室中,“萃取”和“反萃取”过程均必须使用的玻璃仪器的名称为___________ 。
(3)“反萃取”过程中发生反应的化学方程式为___________ 。
(4)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为___________ 。
(5)流程中得到的“TlCl”需要用盐酸洗涤,用平衡原理解释与蒸馏水相比,盐酸洗涤的优点为___________ 。
(6)电解Tl2SO4制备金属Tl的装置如图所示。阳极的电极反应式为___________ ;当转移1mole-时,左侧电极室中溶液的质量减少___________ g。

已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H++CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)“浸取”过程中为提高铊的浸取速率,可采取的措施有
(2)残渣的主要成分为
(3)“反萃取”过程中发生反应的化学方程式为
(4)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(5)流程中得到的“TlCl”需要用盐酸洗涤,用平衡原理解释与蒸馏水相比,盐酸洗涤的优点为
(6)电解Tl2SO4制备金属Tl的装置如图所示。阳极的电极反应式为

您最近一年使用:0次
解题方法
6 . Cu2O在涂料、有色玻璃和催化剂等领域有着广泛的用途。Cu2O为红色粉末,不溶于水,易溶于盐酸和稀硫酸。可用电解法制备氧化亚铜:用铜作阳极,钛片作阴极,电解液为一定浓度的NaCl和NaOH的混合溶液;阳极及其溶液中有关转化如图所示。下列说法错误的是
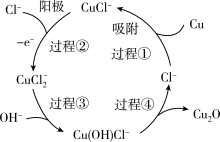

| A.电解液中的NaOH不能用盐酸代替 |
| B.过程①中Cu被氧化生成CuCl- |
| C.过程④的离子方程式为2Cu(OH)Cl-=Cu2O+2Cl-+H2O |
| D.当电路中有0.05mole-通过时,消耗3.2gCu |
您最近一年使用:0次
解题方法
7 . 我国首创以铝组成的金属—海水—空气电池作为新型海水标志灯的能源,它以海水为电解质溶液,靠空气中的氧气使铝组成的金属不断氧化而产生电流。
(1)只要把灯放入海水中数分钟,就会发出耀眼的白光,则该电池的负极反应式为__________ ;
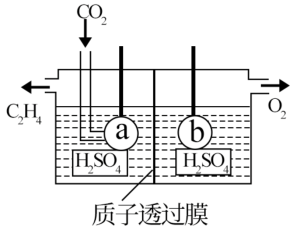
(2)电解法可制取碳的一种气态氢化物C2H4(如图所示)电极a接电源的__________ 极,该电极反应式为__________ ;
(3)将SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体NO,有关反应的离子方程式为__________ ;
(4)处理NOx的一种方法是利用甲烷催化还原NOx,
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ•mol-1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为__________ ;
(5)H2O2在工业、农业、医药上都有广泛的用途。用碱性氢氧燃料电池可合成H2O2,具有效率高、无污染等特点。电池总反应式为H2+O2+OH-=H2O+ ,写出正极反应式
,写出正极反应式__________ 。
(1)只要把灯放入海水中数分钟,就会发出耀眼的白光,则该电池的负极反应式为
(2)电解法可制取碳的一种气态氢化物C2H4(如图所示)电极a接电源的

(3)将SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体NO,有关反应的离子方程式为
(4)处理NOx的一种方法是利用甲烷催化还原NOx,
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ•mol-1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(5)H2O2在工业、农业、医药上都有广泛的用途。用碱性氢氧燃料电池可合成H2O2,具有效率高、无污染等特点。电池总反应式为H2+O2+OH-=H2O+
 ,写出正极反应式
,写出正极反应式
您最近一年使用:0次



