名校
解题方法
1 . 用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则表格中各项所列对应关系均正确的是
| 选项 | X极 | 实验前U形管中液体 | 通电后现象及结论 |  |
| A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞后,a管中呈红色 | |
| B | 正极 | AgNO3溶液 | b管中电极反应式是4OH⁻-4e⁻=O2↑+2H2O | |
| C | 负极 | CuCl2溶液 | b管中有气体逸出 | |
| D | 负极 | NaOH不饱和溶液 | 溶液碱性降低 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 目前世界各国都规划了碳达峰、碳中和的时间节点,以CO2为碳源,将其转化为能源物质。选择性加氢合成CH3OH,合成过程中发生下列反应:
反应i:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1=-akJ‧mol-1
反应ii:CO(g)+2H2(g)⇌CH3OH(g) ∆H2
反应iii:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H3=-bkJ‧mol-1
回答下列问题:
(1)根据盖斯定律,∆H2=。___________ kJ‧mol-1(用含a,b的代数式表示)。
(2)在一绝热、刚性容器中,只发生反应iii。下列说法表明反应已达到平衡状态的是___________(填序号)。
(3)中科院兰州化物所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,反应过程如图所示。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。

在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表所示:
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加Na助剂是否效果最好?_________ (填“是”或“否”),请叙述原因:___________ 。
(4)合成二甲醚反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H=-74kJ‧mol-1。该反应正反应的活化能___________ (填“>”“<”或“=”) 逆反应的活化能。
(5)在一定条件下,将1molCO和2molH2充入IL恒容密闭容器中:发生反应:CO(g)+2H2(g)⇌CH3OH(g) ∆H2,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
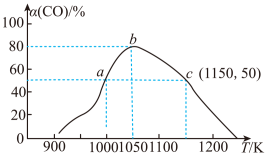
①温度为1000K时,反应开始至2min时,v(H2)=___________ mol‧L-1‧min-1
②CO的转化率随温度的升高先增大后变小的原因是___________ 。
(6)为实现CO2资源化利用,通过光电转化原理以CO2为原料制备甲酸产品(如图所示)。
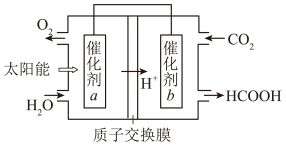
①光电转化过程中,阴极反应式为___________
②催化剂b附近生成lmolHCOOH时,标准状况下催化剂a附近理论上产生______ L气体。
反应i:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1=-akJ‧mol-1
反应ii:CO(g)+2H2(g)⇌CH3OH(g) ∆H2
反应iii:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H3=-bkJ‧mol-1
回答下列问题:
(1)根据盖斯定律,∆H2=。
(2)在一绝热、刚性容器中,只发生反应iii。下列说法表明反应已达到平衡状态的是___________(填序号)。
| A.混合气体的总物质的量不再变化 | B.n(CH3OH):n(H2O)=1:1 |
| C.v正(CH3OH)=3v逆(H2) | D.该反应的K不再变化 |

在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表所示:
| 助剂 | CO2转化率(%) | 各产物在所有产物中的占比 | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
(4)合成二甲醚反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H=-74kJ‧mol-1。该反应正反应的活化能
(5)在一定条件下,将1molCO和2molH2充入IL恒容密闭容器中:发生反应:CO(g)+2H2(g)⇌CH3OH(g) ∆H2,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:

①温度为1000K时,反应开始至2min时,v(H2)=
②CO的转化率随温度的升高先增大后变小的原因是
(6)为实现CO2资源化利用,通过光电转化原理以CO2为原料制备甲酸产品(如图所示)。

①光电转化过程中,阴极反应式为
②催化剂b附近生成lmolHCOOH时,标准状况下催化剂a附近理论上产生
您最近一年使用:0次
3 . I.某工业废水中含 、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
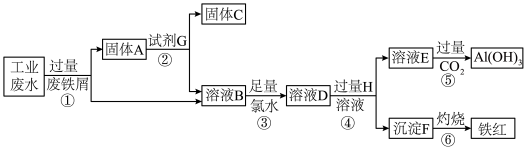
(1)溶液E焰色试验呈黄色,透过蓝色钴玻璃未见紫色。为了尽量减少杂质的引入,试剂G最好选择_______ (填序号,下同);试剂H是_______ 。
a.盐酸 b.硝酸 c.NaOH d.KOH
(2)反应②的离子方程式为_______ ;反应③的离子方程式为_______ 。
Ⅱ.以上流程中步骤③中所用氯水为氯气的水溶液,氯气的制备分为实验室制法和工业制法。
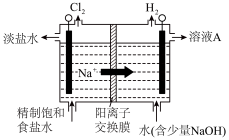
(3)实验室制氯气常用软锰矿(主要成分为MnO2)与浓盐酸混合加热,请用化学方程式表示涉及的化学反应_______ 。
(4)工业常用图装置制备氯气,产生氯气的电极应与电源_______ (选填“正极”或“负极”)相连,发生的电极反应为_______ 。
(5)氯气用途十分广泛,其中1984年北京地坛医院的前身北京第一传染病医院的医生们将氯气通入浓氢氧化钠溶液中,成功研制出了能迅速杀灭各类肝炎病毒的消毒液,请你用离子方程式表示这一过程中的主要反应_______ 。
 、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
(1)溶液E焰色试验呈黄色,透过蓝色钴玻璃未见紫色。为了尽量减少杂质的引入,试剂G最好选择
a.盐酸 b.硝酸 c.NaOH d.KOH
(2)反应②的离子方程式为
Ⅱ.以上流程中步骤③中所用氯水为氯气的水溶液,氯气的制备分为实验室制法和工业制法。

(3)实验室制氯气常用软锰矿(主要成分为MnO2)与浓盐酸混合加热,请用化学方程式表示涉及的化学反应
(4)工业常用图装置制备氯气,产生氯气的电极应与电源
(5)氯气用途十分广泛,其中1984年北京地坛医院的前身北京第一传染病医院的医生们将氯气通入浓氢氧化钠溶液中,成功研制出了能迅速杀灭各类肝炎病毒的消毒液,请你用离子方程式表示这一过程中的主要反应
您最近一年使用:0次
名校
解题方法
4 . 金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。(已知:氧化性Fe2+<Ni2+<Cu2+) 下列叙述中正确的是
| A.电解后,电解槽底部的阳极泥中有Cu和Pt |
| B.电解过程中,阳极质量的减少量与阴极质量的增加量相等 |
| C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+ |
| D.阳极发生还原反应,其电极反应式为Ni2+ + 2e- = Ni |
您最近一年使用:0次
2023-08-08更新
|
218次组卷
|
3卷引用:云南省大理州民族中学2023-2024学年高二下学期见面考化学试题
5 . Ⅰ.金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为 ,再进一步还原得到钛。回答下列问题:
,再进一步还原得到钛。回答下列问题:
(1) 转化为
转化为 有直接氯化法和碳氯化法。在
有直接氯化法和碳氯化法。在 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化: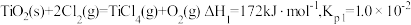
(ⅱ)碳氯化: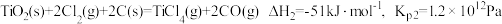
①反应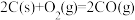 的
的
_______ Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是_______ 。
③对于碳氯化反应:增大压强,平衡_______ 移动(填“向左”“向右”或“不”);温度升高,平衡转化率_______ (填“变大”“变小”或“不变”)。
Ⅱ.纳米级Cu2O由于具有优良的催化性能而备受关往,下表为制取纳米级Cu2O的2种方法:
(2)已知:2Cu(s)+ O2(g)=Cu2O(s);△H = -akJ·mol-1
O2(g)=Cu2O(s);△H = -akJ·mol-1
C(s)+ O2(g)=CO(g);△H = -bkJ·mol-1
O2(g)=CO(g);△H = -bkJ·mol-1
Cu(s)+ O2(g)=CuO(s);△H = -ckJ·mol-1
O2(g)=CuO(s);△H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_______ kJ·mol-1
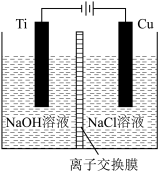
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图,阳极生成Cu2O,其电极反应式为_______ 。
 ,再进一步还原得到钛。回答下列问题:
,再进一步还原得到钛。回答下列问题:(1)
 转化为
转化为 有直接氯化法和碳氯化法。在
有直接氯化法和碳氯化法。在 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:
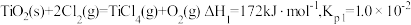
(ⅱ)碳氯化:
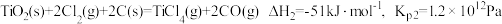
①反应
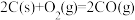 的
的
②碳氯化的反应趋势远大于直接氯化,其原因是
③对于碳氯化反应:增大压强,平衡
Ⅱ.纳米级Cu2O由于具有优良的催化性能而备受关往,下表为制取纳米级Cu2O的2种方法:
| 方法I | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu +H2O Cu2O+H2↑。 Cu2O+H2↑。 |
 O2(g)=Cu2O(s);△H = -akJ·mol-1
O2(g)=Cu2O(s);△H = -akJ·mol-1C(s)+
 O2(g)=CO(g);△H = -bkJ·mol-1
O2(g)=CO(g);△H = -bkJ·mol-1Cu(s)+
 O2(g)=CuO(s);△H = -ckJ·mol-1
O2(g)=CuO(s);△H = -ckJ·mol-1则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图,阳极生成Cu2O,其电极反应式为

您最近一年使用:0次
9-10高二下·浙江台州·阶段练习
名校
解题方法
6 . 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:还原性Fe>Ni>Cu)
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中有Cu和Pt |
您最近一年使用:0次
2022-08-15更新
|
1465次组卷
|
119卷引用:2010年云南省玉溪一中高二下学期期末考试化学试题
(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题云南省普洱市澜沧县民族中学2018-2019学年高二下学期期末考试化学试题云南省昆明市官渡区第一中学2019-2020学年高二下学期期中考试化学试题(已下线)浙江省临海市白云中学2009—2010学年度高二下学期第一次月考化学试题(已下线)2011届福建省三明一中高三上学期期中考试化学卷(已下线)2011届山东省济南外国语学校高三上学期第三次质量检测化学试卷(已下线)2010-2011学年江苏省南京六中高二下学期期末考试化学试题(已下线)2011-2012学年山东省潍坊市高二寒假作业化学(一)试卷(已下线)2011-2012学年福建南平政和一中高二期末考试化学试卷(已下线)2011-2012学年天津市耀华中学高二上学期期末考试化学试卷(已下线)2011-2012学年陕西省师大附中高一下学期期末考试化学试卷(已下线)2013届江苏省泰州中学高三上学期期中考试化学试卷(已下线)2013届山东省济宁市鱼台一中高三上学期期中考试化学试卷(已下线)2014高考名师推荐化学电解三池的应用(已下线)2013-2014天津市耀华中学高二上学期期末考试化学试卷(已下线)2015安徽望江中学同步课时练(人教选修4)第四章检测试卷2014-2015四川省重点中学高二下学期期中考试化学试卷2015-2016学年福建省四地六校高二上学期10月联考化学试卷2015-2016学年福建省四地六校高二上学期10月一次联考化学试卷2016届湖南省十校共同体高三上学期12月联考化学试卷2015-2016学年河北省故城高级中学高二上12月月考化学试卷2016届山东省菏泽一中高三上学期12月月考化学试卷2015-2016学年吉林省延边三中高二上12月月考化学试卷2017届山东省滕州市第二中学高三上学期10月月考化学试卷2017届甘肃省天水一中高三上学期第一次月考化学卷2016-2017学年福建省四地六校高二上第一次月考化学试卷(已下线)同步君 选修4 第4章 第3节 电解原理的应用2016-2017学年河北石家庄一中高二上期中考试化学试卷2016-2017学年黑龙江哈尔滨六中高二上期末化学卷2016-2017学年江苏省如东高级中学高一下学期第一次(3月)阶段检测化学试卷福建省龙海市程溪中学2016-2017学年高二下学期期末考试化学试题山东省寿光现代中学2017-2018学年高二上学期开学考试化学试题河南省郑州市中牟县二中2017-2018学年高二第一次月考化学试题宁夏银川市六盘山高级中学2017-2018学年高二上学期第一次月考化学试题福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题河北省承德市第一中学2017-2018学年高二上学期第一次月考化学试题山东省垦利第一中学2017-2018学年高二上学期第一次月考化学试题四川省成都经开区实验中学2018届高三10月月考理综化学试题安徽省蚌埠市第二中学2017-2018学年高二上学期期中考试化学试题山东省菏泽市2017-2018学年高二上学期期中考试(B)化学试题高中化学人教版 选修四 第四章 电化学基础 第三节 电解池 电解池第二课时(电解原理的应用)陕西师范大学附中2017-2018第一学期高二年级化学期中考试化学试题天津市红桥区2017-2018学年高二上学期期末考试化学试题河南省豫南九校2017-2018学年高二上学期期末联考化学试题1河南省豫南九校2017-2018学年高二上学期期末联考化学试题2河北省承德市第二中学2017-2018学年高二上学期第一次月考化学试题2018-2019学年鲁科版高中化学选修四:第1章检测题河南省镇平县第一高级中学2018-2019学年高二上学期第一次月考化学试题吉林省辽源市田家炳高级中学2018-2019学年高二9月月考化学试题广东省惠州市惠东县惠东高级中学2018-2019学年高二上学期10月月考化学试题山东省鄄城市第一中学2018-2019学年高二上学期第一次月考化学试题陕西省黄陵中学2018-2019学年高二(重点班)上学期期中考试化学试题高二人教版选修4 第四章 第三节 电解池山东省泰安市宁阳一中2018-2019学年高二上学期阶段性考试三(12月)化学试题(已下线)考点10 电解原理 金属的腐蚀与防护——备战2019年浙江新高考化学考点四川省遂宁市2018-2019学年高二下学期期末考试化学试题四川省武胜县烈面中学校2018届高三9月入学考试化学试题(已下线)2019年9月22日 《每日一题》 2020年高考一轮复习-每周一测山东省泰安市宁阳县第一中学2019-2020学年高二上学期第一次段考化学试题(已下线)2019年12月4日 《每日一题》人教版(选修4)——电解精炼铜福建省泉州第十六中学2019-2020学年高二10月份月考化学试题2020年春季人教版高中化学选修4第四章《电化学基础》测试卷河北省沧州市泊头市第一中学2019-2020学年高二月考检测化学试题(已下线)【新东方】 2020-2福建省安溪一中2020年高一实验班线上阶段测试化学试题河北省泊头市第一中学2019-2020学年高二上学期期末模拟考试化学试卷四川省自贡市田家炳中学2019-2020学年高二下学期开学考试化学试题甘肃省西北师范大学附属中学2019-2020学年高二上学期期中考试化学试题甘肃省武威第一中学2019-2020学年高二下学期期中考试化学试题四川省泸县第四中学2019-2020学年高二下学期第四学月考试化学试题四川省泸县第一中学2019-2020学年高二下学期第四学月考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二上学期开学考试化学试题黑龙江省哈尔滨市第一中学校2021届高三上学期开学测试化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第3节 电能转化为化学能——电解 课时2 电解原理的应用鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第3节 电能转化为化学能——电解高中必刷题高二选择性必修1第四章 化学反应与电能 第二节 电解池 课时2 电解原理的应用山东省菏泽市单县第五中学2020-2021学年高二上学期第一次月考(10月)化学试题福建省永安市第三中学2020-2021学年高二10月月考化学(选考班)试题福建省三明第一中学2020-2021学年高二上学期第一次月考化学试题人教版(2019)高二化学选择性必修1第四章 化学反应与电能 第二节 电解池 课时2 电解原理的应用湖北省武汉市蔡甸区汉阳一中2020-2021学年高二上学期9月联考化学试题(已下线)专题4.3.2 电解原理的应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)4.2.2 电解原理的应用(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)河北省石家庄市藁城区第一中学2019-2020学年高二上学期第三次月考化学试题(已下线)4.3.2 电解原理的应用(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练浙江省宁波市北仑中学2020-2021学年高一下学期期中考试化学(1班选考)试题解题达人.化学选择题(2021全国卷)提升小卷05江苏省苏州市吴中区2020-2021学年高二下学期期中调研测试化学试题河北沧州泊头一中2020-2021学年高一下学期第二次月考化学试卷黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题贵州省遵义市2020~2021学年高二下学期期末质量检测化学试题黑龙江省哈尔滨市第九中学校2020-2021学年高一下学期6月月考化学试题选择性必修1专题1第二单元 课时4 电解原理的应用(已下线)1.2.4 电解原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)江苏省外国语学校2020-2021学年高二下学期期中调研测试化学试卷河南省南阳市第五中学2021-2022学年高二上学期10月月考化学试题 福建师范大学附属中学2021-2022学年高二上学期期中考试化学试题黑龙江省实验中学2021-2022学年高二上学期期中考试化学试题(已下线)4.2.2 电解原理的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)内蒙古包头市2021-2022学年高二上学期期末考试化学试题辽宁省沈阳市市级重点高中联合体2021-2022学年高二上学期期末考试化学试题浙江省舟山市2021-2022学年高二上学期期末检测化学试题河北省保定市博野中学2021-2022学年高二上学期12月月考化学试题河北省衡水市武强中学2021-2022学年高二下学期期中考试化学试题辽宁省部分中学2021-2022学年高二下学期期末检测化学试题山东省德州市2020-2021学年高二上学期反应原理月考(B)化学试题辽宁省部分中学2021-2022学年高二上学期期末测试化学试题黑龙江省嫩江市第一中学2021-2022学年高二下学期开学考试化学试题河南省濮阳市元龙高级中学2021-2022学年高二下学期5月月考化学试题(已下线)第四章 化学反应与电能(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)湖北省襄阳市第一中学2022-2023学年高二上学期12月线上考试化学试题新疆阿克苏市实验中学2021-2022学年高二上学期期末考试化学试题(已下线)4.2.2 电解原理的应用-同步学习必备知识(已下线)第六章 化学反应与能量 第37讲 电解池 金属的腐蚀与防护第2课时 电解原理的应用福建省宁德市第一中学2021-2022学年高二上学期9月月考化学试题
解题方法
7 . 以对硝基苯甲酸( )为原料,采用电解法合成一种用途广泛的化工产品对氨基苯甲酸(
)为原料,采用电解法合成一种用途广泛的化工产品对氨基苯甲酸(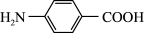 )的装置如图,下列说法不正确的是
)的装置如图,下列说法不正确的是

 )为原料,采用电解法合成一种用途广泛的化工产品对氨基苯甲酸(
)为原料,采用电解法合成一种用途广泛的化工产品对氨基苯甲酸( )的装置如图,下列说法不正确的是
)的装置如图,下列说法不正确的是
| A.反应结束后阳极区 pH减小 |
| B.电子由金属阳极DSA经导线流入直流电源 |
C.阴极的主要电极反应式为: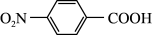 +6e—+6H+→ +6e—+6H+→ +2H2O +2H2O |
| D.每转移1 mol e—时,阳极电解质溶液的质量减少8g |
您最近一年使用:0次
2022-07-26更新
|
639次组卷
|
3卷引用:云南省保山市2021-2022学年高三第一次教学质量监测理科综合化学试题
云南省保山市2021-2022学年高三第一次教学质量监测理科综合化学试题云南省保山市2022届高三上学期第一次教学质量监测理综化学试题(已下线)专题讲座(六) 电解质介质和隔膜在电化学的作用(讲)-2023年高考化学一轮复习讲练测(全国通用)
8 . 氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
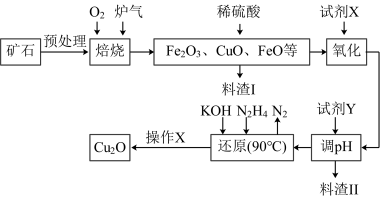
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
(1)炉气中的有害气体成分是__________ ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________ 。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________ 。当试剂X是______ 时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________ 。
(4)写出用N2H4制备Cu2O的化学方程式:________ ,操作X包括_________ 、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________ 。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________ 。

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀 | 7.5 | 2.7 | 4.8 |
| 完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:
(3)加入试剂Y调pH时,pH的调控范围是
(4)写出用N2H4制备Cu2O的化学方程式:
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:
您最近一年使用:0次
2020-03-16更新
|
676次组卷
|
11卷引用:云南省楚雄州禄丰县第一中学2020届高三下学期3月线上模拟考试理综化学试题
云南省楚雄州禄丰县第一中学2020届高三下学期3月线上模拟考试理综化学试题云南省大理州祥云四中2020届高三下学期3月线上模拟考试理综化学试题【市级联考】河南省安阳市2019届高三下学期二模考试理科综合化学试题重庆市云阳江口中学校2020届高三上学期第二次月考理综化学试题2019年秋高三化学复习强化练习—— 离子反应方程式及离子共存2020届人教版高三化学二轮复习非选择题专攻练——工艺流程西藏自治区拉萨市拉萨中学2020届高三第六次月考理科化学试题山东省2020届高三模拟考试化学(二)山西省运城市稷山县第二中学2020届高三上学期第三次月考化学试题四川省成都实验中学2021届高三上学期11月月考理综化学试题四川省内江市威远中学2021-2022学年高三上学期第三次月考化学试题
解题方法
9 . 中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成分为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3, 工艺流程简图如下:
(1)过程I中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是_______。
(2)过程II中发生的反应_______ 氧化还原反应(填“是”或“不是”)。
(3)过程V中系列操作为_______ (填化学实验基本操作名称)。
(4)①过程I中焙烧As2S3的化学反应方程式为_______ 。
②过程IV中生成As2O3的离子反应方程式为_______ 。
(5)有毒的AsO 通过电解反应可转化为无毒的AsO
通过电解反应可转化为无毒的AsO 。用石墨为电极,在强碱性溶液中
。用石墨为电极,在强碱性溶液中
电解含AsO33-的溶液,阳极的电极反应式为_______ 。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO 、AsO
、AsO 的混合溶液l00mL。
的混合溶液l00mL。
b.分别移取25.00mL上述溶液,用0.02500 mol·L-1的I2标准溶液进行滴定(I2将AsO 氧化为AsO
氧化为AsO ,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二〜图四所示。
,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二〜图四所示。_______ 。
②粗产品中As2O3的质量分数为_______ (用含有m的代数式表示)。

(1)过程I中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是_______。
| A.工业制硫酸 | B.漂白纸张 | C.自来水消毒 |
(3)过程V中系列操作为
(4)①过程I中焙烧As2S3的化学反应方程式为
②过程IV中生成As2O3的离子反应方程式为
(5)有毒的AsO
 通过电解反应可转化为无毒的AsO
通过电解反应可转化为无毒的AsO 。用石墨为电极,在强碱性溶液中
。用石墨为电极,在强碱性溶液中电解含AsO33-的溶液,阳极的电极反应式为
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO
 、AsO
、AsO 的混合溶液l00mL。
的混合溶液l00mL。b.分别移取25.00mL上述溶液,用0.02500 mol·L-1的I2标准溶液进行滴定(I2将AsO
 氧化为AsO
氧化为AsO ,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二〜图四所示。
,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二〜图四所示。
②粗产品中As2O3的质量分数为
您最近一年使用:0次



