名校
解题方法
1 . 下列化学用语或图示表达正确的是
A. 、 、 、 、 都是碱性氧化物 都是碱性氧化物 |
B.顺-2-丁烯的结构简式: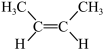 |
C.中子数为10的氧原子: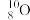 |
D.基态 的价层电子的轨道表示式: 的价层电子的轨道表示式: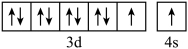 |
您最近一年使用:0次
2023-08-08更新
|
262次组卷
|
3卷引用:广西玉林市博白县2023-2024学年高三上学期六校联考化学试卷
2 . 下列化学用语表述错误的是
A.HClO的电子式: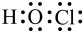 |
B.中子数为10的氧原子: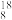 O O |
C.NH3分子的VSEPR模型: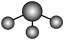 |
D.基态N原子的价层电子排布图: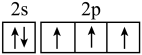 |
您最近一年使用:0次
2023-06-16更新
|
11326次组卷
|
32卷引用:广西玉林市博白县中学2023-2024学年高三上学期开学考试化学试题
广西玉林市博白县中学2023-2024学年高三上学期开学考试化学试题2023年高考湖南卷化学真题(已下线)专题02 化学用语(已下线)专题02 化学用语(已下线)专题02 化学用语(已下线)2023年湖南卷高考真题变式题(选择题1-5)(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第18讲原子结构和核外电子排布(已下线)专题02 化学用语的正误判断-2023年高考化学真题题源解密(全国通用)(已下线)专题02 化学用语及其应用-2023年高考化学真题题源解密(新高考专用)甘肃省武威市凉州区2024届高三上学期第一次诊断考试化学试题(已下线)考点17 原子结构和核外电子排布(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)重庆市第七中学校2023-2024学年高三上学期11月月考化学试卷吉林省长春市2024届高三上学期质量监测(一)化学试题(已下线)题型01 物质的组成与分类 传统文化 化学用语-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)宁夏石嘴山市第三中学2023-2024学年高三上学期第四次月考理科综合试卷天津市第四中学2023-2024学年高三上学期第二次月考化学试卷广东省深圳市盐田高级中学2023-2024学年高二上学期1月期末化学试题(已下线)选择题6-10宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期第四次月考理综试题(已下线)化学(九省联考考后提升卷,贵州卷)-2024年1月“九省联考”真题完全解读与考后提升辽宁省鞍山市普通高中2023-2024学年高三上学期期末联考化学试题湖南省邵东市第三中学2023-2024学年高二上学期1月期末考试化学试卷 (已下线)专题01 基本概念-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)2023-2024学年度第二学期高三化学零模试卷北京市师范大学附属实验中学2024届高三零模化学试题安徽省淮北市第一中学2023-2024学年高二下学期第一次月考化学试题山西省太原师范学院附属中学 师苑中学校2023-2024学年高二下学期准高三第二次月考化学试题黑龙江省肇东市第四中学2023-2024学年高三上学期期末考试化学试题北京市大兴区第一中学2023-2024学年高二下学期期中考试化学试题广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题四川省达州外国语学校2023-2024学年高二下学期3月月考化学试题
名校
解题方法
3 . X、Y、Z、W、E均为短周期主族元素,原子序数依次增大,且E与其他元素均不在同一周期。这五种元素组成的一种化合物的结构如图所示。下列说法不正确的是
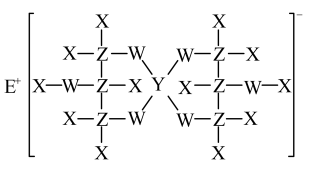

| A.W和E形成的化合物中可能存在共价键 |
| B.第一电离能:W>Z>Y |
| C.沸点:EX>X2W>ZX4 |
| D.Y的氟化物YF3中所有原子均为8电子稳定结构 |
您最近一年使用:0次
2023-04-28更新
|
805次组卷
|
3卷引用:广西玉林市博白县中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
4 . 工业上制备硫酸的流程: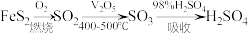 ,设
,设 为阿伏伽德罗常数,下列有关说法正确的是
为阿伏伽德罗常数,下列有关说法正确的是
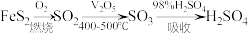 ,设
,设 为阿伏伽德罗常数,下列有关说法正确的是
为阿伏伽德罗常数,下列有关说法正确的是A. 中 中 的未成对电子数目为6 的未成对电子数目为6 |
B. 的中心原子孤对电子数为1,其空间构型为V型 的中心原子孤对电子数为1,其空间构型为V型 |
C.标准状况下,22.4L 中含有氧原子数目为 中含有氧原子数目为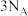 |
D. 作催化剂,能降低该反应的活化能,提高 作催化剂,能降低该反应的活化能,提高 的平衡转化率 的平衡转化率 |
您最近一年使用:0次
2023-04-28更新
|
704次组卷
|
4卷引用:广西玉林市博白县中学2023-2024学年高三上学期10月月考化学试题
解题方法
5 . 近年来,我国的材料技术如陶瓷基复合材料氮化硼(BN)、太阳能电池材料砷化镓(GaAs)、新型储氢材料、光电材料等发展迅猛,请按要求回答下列问题。
(1)基态N原子的轨道表示式为_______ ,B与N的电负性由大到小的顺序为_______ (用元素符号表示)。
(2)基态砷原子的价层电子排布式为_______ ,占据最高能级的电子所在的原子轨道为_______ 形。
(3)硼氢化钠(NaBH4,其中氢元素显-1价)是研究最广泛的储氢材料之一,硼原子在成键时,能将一个2s电子激发进入2p能级参与形成化学键,该过程形成的原子光谱为_______ 光谱(填“吸收”或“发射”),与硼处于同一周期的元素中,第一电离能大于硼的主族元素有_______ 种。
(4)铜配合物在光电材料方面的应用非常广泛,其中基态Cu原子的核外电子排布式为_______ ,Cu在元素周期表中属于_______ 区。
(1)基态N原子的轨道表示式为
(2)基态砷原子的价层电子排布式为
(3)硼氢化钠(NaBH4,其中氢元素显-1价)是研究最广泛的储氢材料之一,硼原子在成键时,能将一个2s电子激发进入2p能级参与形成化学键,该过程形成的原子光谱为
(4)铜配合物在光电材料方面的应用非常广泛,其中基态Cu原子的核外电子排布式为
您最近一年使用:0次
6 . 下表为某短周期元素 的各级电离能数据(用
的各级电离能数据(用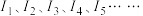 表示,单位
表示,单位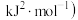 。下列关于元素
。下列关于元素 的判断不正确的是
的判断不正确的是
 的各级电离能数据(用
的各级电离能数据(用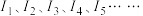 表示,单位
表示,单位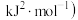 。下列关于元素
。下列关于元素 的判断不正确的是
的判断不正确的是| 元素 | I1 | I2 | I3 | I4 | I5 | …… |
| R | 738 | 1451 | 7733 | 10540 | 13630 | …… |
A. 元素位于元素周期表的第IIA族 元素位于元素周期表的第IIA族 |
B. 元素同周期相邻元素的第一电离能均小于 元素同周期相邻元素的第一电离能均小于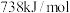 |
| C.R元素位于元素周期表的s区 |
D.R元素基态原子的电子排布式为: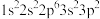 |
您最近一年使用:0次
7 .  在化工、医药等领域有着广泛的应用,下列相关说法正确的是
在化工、医药等领域有着广泛的应用,下列相关说法正确的是
 在化工、医药等领域有着广泛的应用,下列相关说法正确的是
在化工、医药等领域有着广泛的应用,下列相关说法正确的是A. 的原子序数为25,则基态 的原子序数为25,则基态 的核外电子排布式为 的核外电子排布式为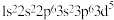 |
B.基态 原子中,核外电子占据最高能层的符号是 原子中,核外电子占据最高能层的符号是 |
C.氧元素原子的价层电子轨道表示式为 |
| D.钾的焰色为紫色是钾原子核外电子吸收能量发生跃迁的结果 |
您最近一年使用:0次
解题方法
8 . 下列说法正确的是
A.某基态原子的核外电子排布式为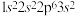 ,该原子核外电子共占据4个轨道 ,该原子核外电子共占据4个轨道 |
| B.第一电离能越大的元素,其电负性也越大 |
C.C原子的基态电子排布式写成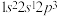 ,它违背了能量最低原理 ,它违背了能量最低原理 |
| D.N、P、As的电负性随原子序数的增大而增大 |
您最近一年使用:0次
名校
解题方法
9 . 柠檬酸铁铵是一种常见的补铁剂,其制备流程如下:
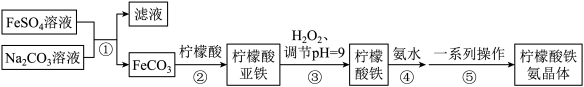
下列说法错误的是

下列说法错误的是
| A.基态Fe原子的价层电子排布式为3d64s2 |
| B.可用铁氰化钾检验Fe2+是否完全转化为Fe3+ |
| C.碳酸根离子和硫酸根离子的空间结构均为正四面体形 |
| D.步骤⑤一系列操作包括蒸发浓缩,冷却结晶,过滤、洗涤,干燥 |
您最近一年使用:0次
2023-02-02更新
|
801次组卷
|
5卷引用:广西博白县中学2022-2023学年高二下学期3月月考化学试题
广西博白县中学2022-2023学年高二下学期3月月考化学试题广东省江门市部分名校2023届高三高考仿真模拟测试化学试题(已下线)素养卷08 微型化学工艺流程分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)河南省郑州市第一中学2022-2023学年高二下学期期中考试化学试题江西省贵溪市实验中学2023-2024学年高三上学期10月第二次月考化学试题
名校
10 . 硫、磷的化合物在农药、石油工业、矿物开采、萃取及有机合成等领域的应用广泛,如O,Oˊ二取代基二硫代磷酸在萃取金属中有如下应用:
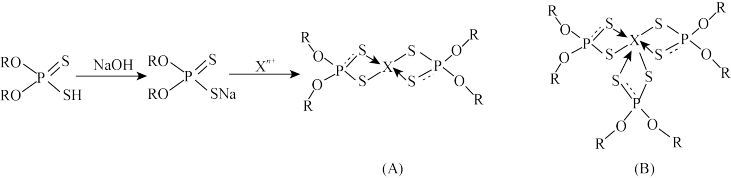
回答下列问题:
(1)P的第一电离能大于S的原因是_______ 。
(2)基态氧原子价电子排布式为_______ 。
(3)物质(A)中的S原子的杂化方式为_______ ,二硫代磷酸根的VSEPR模型为_______ 。
(4)H2O、H2S、H2Se沸点由低到高的顺序_______ ,Te与S同主族,与I同周期,Te属于元素周期表中_______ 区元素。
(5)将物质(A)在N2气氛中加热至730℃不再失重,得到金属硫化物的无定形粉末,其六方晶胞如图所示。已知该晶胞参数α=120°,β=γ=90°,X的相对原子质量用M表示,阿伏加德罗常数用NA表示,则该晶体的密度为_______ g·cm-3(列出计算式)。
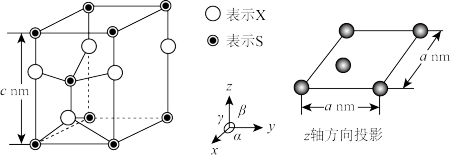

回答下列问题:
(1)P的第一电离能大于S的原因是
(2)基态氧原子价电子排布式为
(3)物质(A)中的S原子的杂化方式为
(4)H2O、H2S、H2Se沸点由低到高的顺序
(5)将物质(A)在N2气氛中加热至730℃不再失重,得到金属硫化物的无定形粉末,其六方晶胞如图所示。已知该晶胞参数α=120°,β=γ=90°,X的相对原子质量用M表示,阿伏加德罗常数用NA表示,则该晶体的密度为

您最近一年使用:0次
2022-07-06更新
|
452次组卷
|
2卷引用:广西玉林市普通高中2022届高三上学期1月统考理科综合化学试题



