名校
解题方法
1 . 下列化学用语表述正确的是
A. 的球棍模型: 的球棍模型: | B.NaClO的电子式为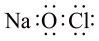 |
C.丁二烯的键线式: | D.基态Cr原子的价层电子轨道式: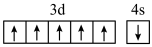 |
您最近半年使用:0次
2 . 缺电子化合物是指电子数不符合路易斯结构(路易斯结构是通过共用电子使原子价层电子数达到8,氢原子达到2所形成的稳定分子结构)要求的一类化合物,某科学小组依据 、
、 、
、 分子对此进行研究。
分子对此进行研究。
(1)写出B原子的价层电子轨道表示式_______ 。
(2) 中心原子的轨道杂化类型是
中心原子的轨道杂化类型是_______ ,其_______ (能/不能)提供孤对电子与Fe2+形成配位键。
(3)上述三种化合物中,是缺电子化合物的是_______ 。
(4)NH3分子极易溶于水,是说明理由_______ 。
 、
、 、
、 分子对此进行研究。
分子对此进行研究。(1)写出B原子的价层电子轨道表示式
(2)
 中心原子的轨道杂化类型是
中心原子的轨道杂化类型是(3)上述三种化合物中,是缺电子化合物的是
(4)NH3分子极易溶于水,是说明理由
您最近半年使用:0次
解题方法
3 . 第L能层所含的能级数,最多容纳的电子数分别为
| A.2,2 | B.2,8 | C.2,16 | D.4,32 |
您最近半年使用:0次
解题方法
4 . 短周期元素X、Y、Z、W、M、P、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,P简单离子在同周期离子中半径最小,Q与Z同主族。冰晶石的主要成分是由W、M、P三种元素组成的。
(1)元素X在周期表中的位置为___________ ,其位于___________ 区。
(2)Z元素原子的轨道表示式为___________ 。
(3)P元素基态电子排布式为___________ 。
(4)Q元素基态原子核外电子占据的最高能级为___________ ,该能级能容纳的最多电子数为___________ 。
(5)X、Y、Z、W第一电离由大到小的顺序为___________ (用元素符号表示,下同),Z、W、Q电负性由大到小的顺序为___________ ,X、Y、Z、M、P原子半径由大到小的顺序为___________ 。
(6)原子序数为29和51的元素基态原子价电子排布式分别为___________ 。
(1)元素X在周期表中的位置为
(2)Z元素原子的轨道表示式为
(3)P元素基态电子排布式为
(4)Q元素基态原子核外电子占据的最高能级为
(5)X、Y、Z、W第一电离由大到小的顺序为
(6)原子序数为29和51的元素基态原子价电子排布式分别为
您最近半年使用:0次
5 . 高附加值产品 的合成催化反应历程如图所示。下列说法错误的是
的合成催化反应历程如图所示。下列说法错误的是
 的合成催化反应历程如图所示。下列说法错误的是
的合成催化反应历程如图所示。下列说法错误的是
A.第一电离能和电负性均为: |
B.反应物→ 过程中,有 过程中,有 键和 键和 键的断裂 键的断裂 |
| C.①→②过程吸收能量,且E为该过程正向的活化能 |
| D.该反应总反应的原子利用率为100% |
您最近半年使用:0次
解题方法
6 . 下列有关能级或原子轨道说法错误的是
| A.2p、3p、4p能量逐渐升高,能级的轨道数逐渐增多 |
B.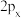 、 、 、 、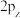 轨道形状均为哑铃形,且相互垂直,但能量相等 轨道形状均为哑铃形,且相互垂直,但能量相等 |
| C.p能级能量不一定大于s能级能量 |
| D.从空间角度看,2s轨道比1s轨道大,其空间包围了1s轨道 |
您最近半年使用:0次
7 . 下列关于原子结构的表述正确的是
| A.基态铁原子价电子只有4个成对电子,基态铬原子有6个未成对电子 |
B.基态氮原子的轨道表示式: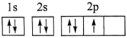 |
C.基态碘原子价电子排布式: |
D.基态P原子电子排布式 ,违背了泡利不相容原理 ,违背了泡利不相容原理 |
您最近半年使用:0次
名校
解题方法
8 . 下列表述不正确的是
A. 分子中 分子中 键的电子云轮廓图: 键的电子云轮廓图: |
B. 的分子模型:Ⅴ形 的分子模型:Ⅴ形 |
C.基态 原子的价层电子轨道表示式: 原子的价层电子轨道表示式: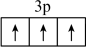 |
D. 的形成过程: 的形成过程: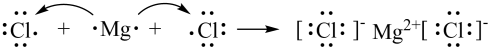 |
您最近半年使用:0次
9 . 回答下列问题。
(1)镍元素基态原子的核外电子排布式为___________ ,3d能级上的未成对电子数为___________ 。
(2)基态Ge原子的价层电子排布式为___________ ,有___________ 个未成对电子。
(3)Zn2+基态核外电子排布式为___________ 。
(4)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________ 形象化描述。在基态 14C原子中,核外存在___________ 对自旋相反的电子。
(5)基态Fe原子有___________ 个未成对电子。Fe3+的电子排布式为___________ 。
(1)镍元素基态原子的核外电子排布式为
(2)基态Ge原子的价层电子排布式为
(3)Zn2+基态核外电子排布式为
(4)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(5)基态Fe原子有
您最近半年使用:0次
10 . 硅(Si)、硒(Se)、镓(Ga)、锗(Ge)的单质及某些化合物都是航空航天测控、光纤通信等领域常用的半导体材料。回答下列问题:
(1)制造手机芯片需要高纯度硅,晶体硅属于___________ 晶体,可溶于氢氟酸生成氢气。写出晶体硅与氢氟酸反应的化学方程式:___________ 。
(2)基态硒原子的价电子排布图为___________ ;硒、硅均能与氢元素形成气态氢化物,硅的氢化物的分子中共用电子对偏向氢原子,而氢气与硒反应时单质硒是氧化剂,则电负性大小为Se___________ (填“>”或“<”)Si, 的立体构型为
的立体构型为___________ 。
(3)镓和砷都是第四周期的元素,则第一电离能:Ga___________ (填“大于”或“小于”)As。GaN、GaAs的晶体类型与晶体硅相同,试解释,熔点GaN>GaAs的原因:___________ 。
(4)氮化镓是一种重要的半导体材料,其立方晶胞结构如图所示。每个Ga原子周围距离最近的Ga原子数为___________ 。已知晶胞边长为apm,若该晶体的密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
___________ (只列出计算式即可)。
(1)制造手机芯片需要高纯度硅,晶体硅属于
(2)基态硒原子的价电子排布图为
 的立体构型为
的立体构型为(3)镓和砷都是第四周期的元素,则第一电离能:Ga
(4)氮化镓是一种重要的半导体材料,其立方晶胞结构如图所示。每个Ga原子周围距离最近的Ga原子数为
 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值

您最近半年使用:0次



