解题方法
1 . Co、La元素及其化合物在工业及生活方面有重要应用。回答下列问题:
(1)基态Co的价电子排布图_______ ,核外电子的空间运动状态有_______ 种。
(2)一定条件下, 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为_______ , 的配位数为
的配位数为_______ 。区别 和
和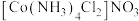 两种溶液的试剂是
两种溶液的试剂是_______ 。
(3) 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是_______ ,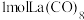 含
含_______  键。
键。 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
_______ 。晶体 的密度为
的密度为_______  。(写出计算式即可)
。(写出计算式即可)
(1)基态Co的价电子排布图
(2)一定条件下,
 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为 的配位数为
的配位数为 和
和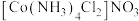 两种溶液的试剂是
两种溶液的试剂是(3)
 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是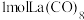 含
含 键。
键。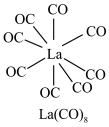
 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
 的密度为
的密度为 。(写出计算式即可)
。(写出计算式即可)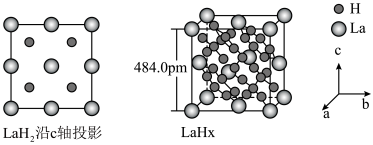
您最近一年使用:0次
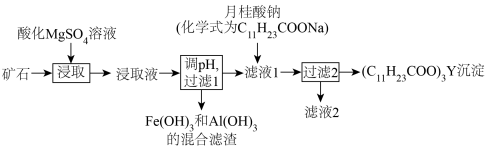
2 . 元素钇(Y)是制备航空航天设备所需的特殊材料的关键成分。一种从某矿石(含钇、铁、铝等元素)中提取Y元素的工艺流程如下:
回答下列问题。
(1)钇位于第5周期第IIIB族,钇的价电子排布式为___________ 。
(2)Mg的第一电离能___________ Al(填“>”或“<”),原因是___________ 。
(3)“过滤1”操作中需将所得混合滤渣洗涤2~3次,并将洗涤液与“滤液1”合并。
①验证混合滤渣已经洗涤干净的操作与现象是___________ 。
②洗涤液与“滤液1”合并的目的是___________ 。
(4)“过滤2”后,滤渣中无Mg元素,“滤液2”中 浓度为0.8
浓度为0.8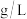 。为尽可能多的提取
。为尽可能多的提取 ,可提高
,可提高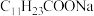 的加入量,但应确保“过滤2”前的溶液中
的加入量,但应确保“过滤2”前的溶液中 )低于
)低于___________ mol/L。
(5)钇可用于制备高活性的合金类催化剂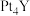 。
。
①还原YCl3和PtCl4混合熔融盐制备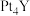 ,生成0.1
,生成0.1 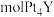 时转移的电子的物质的量为
时转移的电子的物质的量为___________ mol。
②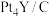 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化电极反应,则
用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化电极反应,则  发生的电极反应式为
发生的电极反应式为___________ 。

回答下列问题。
(1)钇位于第5周期第IIIB族,钇的价电子排布式为
(2)Mg的第一电离能
(3)“过滤1”操作中需将所得混合滤渣洗涤2~3次,并将洗涤液与“滤液1”合并。
①验证混合滤渣已经洗涤干净的操作与现象是
②洗涤液与“滤液1”合并的目的是
(4)“过滤2”后,滤渣中无Mg元素,“滤液2”中
 浓度为0.8
浓度为0.8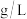 。为尽可能多的提取
。为尽可能多的提取 ,可提高
,可提高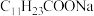 的加入量,但应确保“过滤2”前的溶液中
的加入量,但应确保“过滤2”前的溶液中 )低于
)低于(5)钇可用于制备高活性的合金类催化剂
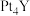 。
。①还原YCl3和PtCl4混合熔融盐制备
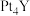 ,生成0.1
,生成0.1 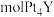 时转移的电子的物质的量为
时转移的电子的物质的量为②
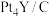 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化电极反应,则
用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化电极反应,则  发生的电极反应式为
发生的电极反应式为
您最近一年使用:0次
3 . 下列关于Be、Mg及其化合物结构与性质的论述错误的是
| A.基态Mg原子有四种能量不同的电子 |
| B.Be(OH)2和Mg(OH)2均能溶于盐酸,均不溶于NaOH溶液 |
C.0.1 mol/L  2溶液的pH比0.1mol/L Mg(NO3)2溶液小 2溶液的pH比0.1mol/L Mg(NO3)2溶液小 |
D.MgCl2溶液与  2溶液分别蒸干并灼烧,剩余固体成分相同 2溶液分别蒸干并灼烧,剩余固体成分相同 |
您最近一年使用:0次
4 . 减少NOx、CO2的排放,实现资源化利用是化学工作者研究的重要课题。
(1)尿素水解生成的NH3催化还原NO是重要的烟气脱硝技术,且为可逆过程。反应过程与能量关系如图1,在以Fe2O3为主的催化剂表面可能发生的反应过程如图2。

①NH3催化还原NO为______ (填“放热”“吸热”)反应。
②基态Fe3+的价层电子排布式为______ 。
③上述脱硝的总反应化学方程式为:______ 。
(2)电厂烟气脱氮的反应为:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g)ΔH<0,现向某2L密闭容器中分别投入一定量的NH3和2.0×10-4molNO发生以上反应。其他条件相同时,在甲、乙两种催化剂的作用下,反应1min时NO的转化率与温度的关系如图3。

①在催化剂甲的作用下,温度高于210℃小于300℃时,NO转化率降低的可能原因是______ 。
②100—300℃区间,0~1min内,使用甲催化剂时NO的最高平均速率为______ 。
(3)工业以NH3和CO2为原料合成尿素。液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l) H2O(l)+NH2CONH2(l) ΔH<0,在液相中,CO2的平衡转化率与温度、初始氨碳比(用L表示,L=
H2O(l)+NH2CONH2(l) ΔH<0,在液相中,CO2的平衡转化率与温度、初始氨碳比(用L表示,L= )、初始水碳比(用W表示,W=
)、初始水碳比(用W表示,W= )关系如图4。
)关系如图4。

①曲线A、B中,______ (填“A”或“B”)的W较小。
②对于液相反应,常用某组分M达到平衡时的物质的量分数x(M)代替平衡浓度来计算平衡常数(记作Kx)。195℃时,2NH3(l)+CO2(l) H2O(l)+NH2CONH2(l)的Kx的值为
H2O(l)+NH2CONH2(l)的Kx的值为______ 。
(1)尿素水解生成的NH3催化还原NO是重要的烟气脱硝技术,且为可逆过程。反应过程与能量关系如图1,在以Fe2O3为主的催化剂表面可能发生的反应过程如图2。

①NH3催化还原NO为
②基态Fe3+的价层电子排布式为
③上述脱硝的总反应化学方程式为:
(2)电厂烟气脱氮的反应为:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g)ΔH<0,现向某2L密闭容器中分别投入一定量的NH3和2.0×10-4molNO发生以上反应。其他条件相同时,在甲、乙两种催化剂的作用下,反应1min时NO的转化率与温度的关系如图3。

①在催化剂甲的作用下,温度高于210℃小于300℃时,NO转化率降低的可能原因是
②100—300℃区间,0~1min内,使用甲催化剂时NO的最高平均速率为
(3)工业以NH3和CO2为原料合成尿素。液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)
 H2O(l)+NH2CONH2(l) ΔH<0,在液相中,CO2的平衡转化率与温度、初始氨碳比(用L表示,L=
H2O(l)+NH2CONH2(l) ΔH<0,在液相中,CO2的平衡转化率与温度、初始氨碳比(用L表示,L= )、初始水碳比(用W表示,W=
)、初始水碳比(用W表示,W= )关系如图4。
)关系如图4。
①曲线A、B中,
②对于液相反应,常用某组分M达到平衡时的物质的量分数x(M)代替平衡浓度来计算平衡常数(记作Kx)。195℃时,2NH3(l)+CO2(l)
 H2O(l)+NH2CONH2(l)的Kx的值为
H2O(l)+NH2CONH2(l)的Kx的值为
您最近一年使用:0次
解题方法
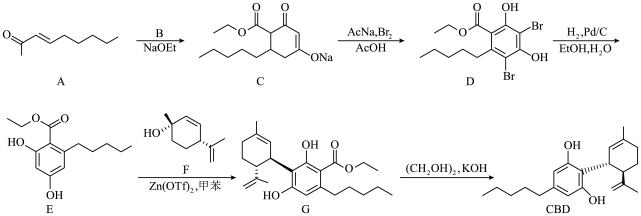
5 . 大麻二酚(CBD)具有降血糖、抗肿瘤、抗焦虑等多种生物活性。以下是CBD在医药工业上的一种合成路线,回答下列问题。___________ 。
(2)B的结构为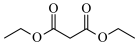 ,其化学名称是
,其化学名称是___________ ;D中含氧官能团的名称是___________ 。
(3)写出由E生成G的化学方程式___________ ,该反应类型为___________ 。
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有___________ 种。(不考虑立体异构)
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是___________ (写出结构简式)。
(5)已知:R-CN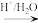 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):___________ 。
(2)B的结构为
 ,其化学名称是
,其化学名称是(3)写出由E生成G的化学方程式
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是
(5)已知:R-CN
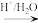 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成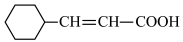 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):
您最近一年使用:0次
名校
6 . 氮、磷、硫、氯元素在科研与生产中有许多重要的用途。请回答下列问题:
(1)磷原子在成键时,能将一个3s轨道上的电子激发进入3d轨道而参与成键,则该激发态原子的核外电子排布式为_______ 。
(2)比较键角大小:气态 分子
分子_______  离子(填“>”“<”或“=”)
离子(填“>”“<”或“=”)
(3)联氨( )为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离的离子方程式:
)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离的离子方程式:_______ 。
(4)已知一定条件下发生反应: ,该反应过程中破坏和形成的化学键类型为
,该反应过程中破坏和形成的化学键类型为_______ 。
(5)多原子分子中各原子若在同一平面内,且有互相平行的p轨道,则p电子可在多个原子间运动,形成离域π键,可用符号正表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。如苯分子中的大π键可表示为 ,则
,则 中的大π键应表示为
中的大π键应表示为_______ 。
(6) 中阴离子为
中阴离子为 ,
, 与
与 分子空间结构相似,由此可以推知
分子空间结构相似,由此可以推知 的空间结构为
的空间结构为_______ 。
(7) 尿素分子
尿素分子 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为_______ ;电子式:碳化钙( )
)_______ 。
(8)三聚氰胺俗称“蛋白精”,其结构如图,其中氮原子的杂化方式为_______ 。

(1)磷原子在成键时,能将一个3s轨道上的电子激发进入3d轨道而参与成键,则该激发态原子的核外电子排布式为
(2)比较键角大小:气态
 分子
分子 离子(填“>”“<”或“=”)
离子(填“>”“<”或“=”)(3)联氨(
 )为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离的离子方程式:
)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离的离子方程式:(4)已知一定条件下发生反应:
 ,该反应过程中破坏和形成的化学键类型为
,该反应过程中破坏和形成的化学键类型为(5)多原子分子中各原子若在同一平面内,且有互相平行的p轨道,则p电子可在多个原子间运动,形成离域π键,可用符号正表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。如苯分子中的大π键可表示为
 ,则
,则 中的大π键应表示为
中的大π键应表示为(6)
 中阴离子为
中阴离子为 ,
, 与
与 分子空间结构相似,由此可以推知
分子空间结构相似,由此可以推知 的空间结构为
的空间结构为(7)
 尿素分子
尿素分子 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为 )
)(8)三聚氰胺俗称“蛋白精”,其结构如图,其中氮原子的杂化方式为

您最近一年使用:0次
7 . 实验室以含钴废料(主要成分是CoO、Co2O3,含少量Fe2O3、Al2O3等杂质)为原料制备CoCO3的流程如图所示。
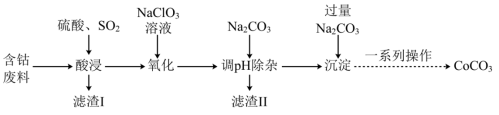
已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
回答下列问题:
(1)基态钴原子的价层电子排布式为_______ ,在“酸浸”之前,先要对含钴废料进行粉碎处理,其目的是_______ 。
(2)“酸浸”时需通入SO2,其中SO2作______ (填“氧化剂”或“还原剂”),由于“酸浸”时,溶液中会产生Fe3+,写出SO2与Fe3+反应的离子方程式:______ 。
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为______ 。
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为______ 至______ 。(加入NaClO3和Na2CO3时,溶液的体积变化忽略)
(5)“滤渣II”的主要成分为______ 。
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有_______ 。
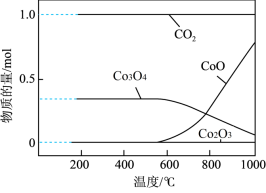
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为_______ 。

已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
| 沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 |
| 恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 |
(1)基态钴原子的价层电子排布式为
(2)“酸浸”时需通入SO2,其中SO2作
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为
(5)“滤渣II”的主要成分为
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为

您最近一年使用:0次
名校
解题方法
8 . 回答下列问题
(1)基态碘原子的价层电子的运动状态有______ 种,基态Pb原子的价层电子排布式为______ 。
(2)Fe³⁺价电子轨道表示式为______ ;基态As原子的最高能级组的电子排布式为______
(3)一种磷酸硅铝分子筛常用于催化甲醇制烯烃的反应。由硅原子核形成的三种微粒:
a.(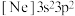 )、b.(
)、b.(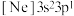 )、c.(
)、c.(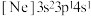 ),半径由大到小的顺序为
),半径由大到小的顺序为______ (填标号);第三周期元素中,第一电离能介于A1和P之间的元素有______ 种。
(4)下列状态的铁中,电离最外层一个电子所需能量最大的是______ (填标号)。

(5)基态Co原子的价电子中,两种自旋状态的电子数之比为______ 。
(6) 、
、 、
、 的第一电离能由大到小顺序为:
的第一电离能由大到小顺序为:______ 。
(7)原子发射光谱法是通过处于激发态的待测元素微粒回到基态时发射的特征谱线对其进行鉴别的方法。下列状态的铁粒子处于激发态的是______(填标号)。
(1)基态碘原子的价层电子的运动状态有
(2)Fe³⁺价电子轨道表示式为
(3)一种磷酸硅铝分子筛常用于催化甲醇制烯烃的反应。由硅原子核形成的三种微粒:
a.(
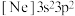 )、b.(
)、b.(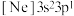 )、c.(
)、c.(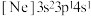 ),半径由大到小的顺序为
),半径由大到小的顺序为(4)下列状态的铁中,电离最外层一个电子所需能量最大的是

(5)基态Co原子的价电子中,两种自旋状态的电子数之比为
(6)
 、
、 、
、 的第一电离能由大到小顺序为:
的第一电离能由大到小顺序为:(7)原子发射光谱法是通过处于激发态的待测元素微粒回到基态时发射的特征谱线对其进行鉴别的方法。下列状态的铁粒子处于激发态的是______(填标号)。
A.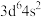 | B.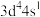 | C.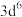 | D.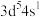 |
您最近一年使用:0次
解题方法
9 . 微颗粒的氧化锌作为一种纳米材料开始在相关领域发挥作用,利用锌焙砂 主要成分为
主要成分为 ,含
,含 及铅、铜、镉的氧化物
及铅、铜、镉的氧化物 生产高纯氧化锌的工业流程如图所示,回答下列问题:
生产高纯氧化锌的工业流程如图所示,回答下列问题:

已知: 微溶于水而生成亚砷酸
微溶于水而生成亚砷酸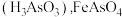 和
和 难溶于水。
难溶于水。
(1)基态 原子核外价层电子轨道表达式为
原子核外价层电子轨道表达式为______ , 中
中 的化合价为
的化合价为______ 。
(2)“浸出”过程中 足量,则生成的主要配离子的化学式为
足量,则生成的主要配离子的化学式为______ ;增大浸出率可采取的措施是______  写出两条
写出两条 。
。
(3)“除砷”过程中, 作氧化剂
作氧化剂 溶液呈酸性
溶液呈酸性 ,发生反应的离子方程式为
,发生反应的离子方程式为______ 。
(4)“除重金属”过程中加入 后
后 在溶液中的残留浓度为
在溶液中的残留浓度为 ,此时
,此时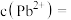
______ 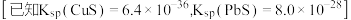 。
。
(5)“沉锌”前锌元素以 存在,写出“沉锌”的化学方程式
存在,写出“沉锌”的化学方程式______ 。
(6)流程中可循环利用的物质有 、
、______ 、______  填化学式
填化学式 。
。
 主要成分为
主要成分为 ,含
,含 及铅、铜、镉的氧化物
及铅、铜、镉的氧化物 生产高纯氧化锌的工业流程如图所示,回答下列问题:
生产高纯氧化锌的工业流程如图所示,回答下列问题:
已知:
 微溶于水而生成亚砷酸
微溶于水而生成亚砷酸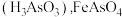 和
和 难溶于水。
难溶于水。(1)基态
 原子核外价层电子轨道表达式为
原子核外价层电子轨道表达式为 中
中 的化合价为
的化合价为(2)“浸出”过程中
 足量,则生成的主要配离子的化学式为
足量,则生成的主要配离子的化学式为 写出两条
写出两条 。
。(3)“除砷”过程中,
 作氧化剂
作氧化剂 溶液呈酸性
溶液呈酸性 ,发生反应的离子方程式为
,发生反应的离子方程式为(4)“除重金属”过程中加入
 后
后 在溶液中的残留浓度为
在溶液中的残留浓度为 ,此时
,此时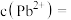
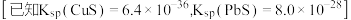 。
。(5)“沉锌”前锌元素以
 存在,写出“沉锌”的化学方程式
存在,写出“沉锌”的化学方程式(6)流程中可循环利用的物质有
 、
、 填化学式
填化学式 。
。
您最近一年使用:0次
10 . 铁、钴及其化合物在生活中有广泛应用。
(1)Fe2+的基态核外电子排布式为___________ 。
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol苯酚分子中含有σ键的数目为___________ 。
②类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H S
S C≡N)和异硫氰酸
C≡N)和异硫氰酸 ,这两种酸中沸点较高的是
,这两种酸中沸点较高的是___________ ,原因:___________ 。
(3)氮化铁晶体的晶胞结构如图−1所示。该晶体中铁、氮的微粒个数之比为___________ 。

(4)某铁的化合物结构简式如图−2所示:

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为___________ (用元素符号表示)。
②上述化合物中氮原子的杂化方式为___________ 。
(5)配合物[Co(NH3)5Cl]Cl2中与Co2+形成配位键的原子是___________ (用元素符号表示),与NH3互为等电子体的离子是___________ ,区别[Co(NH3)5Cl]Cl2和[Co(NH3)6]Cl3这两种晶体的实验方案为___________ 。
(1)Fe2+的基态核外电子排布式为
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol苯酚分子中含有σ键的数目为
②类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H
 S
S C≡N)和异硫氰酸
C≡N)和异硫氰酸 ,这两种酸中沸点较高的是
,这两种酸中沸点较高的是(3)氮化铁晶体的晶胞结构如图−1所示。该晶体中铁、氮的微粒个数之比为

(4)某铁的化合物结构简式如图−2所示:

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为
②上述化合物中氮原子的杂化方式为
(5)配合物[Co(NH3)5Cl]Cl2中与Co2+形成配位键的原子是
您最近一年使用:0次



