名校
1 . CMU是一种荧光指示剂。下列关于CMU的说法错误的是
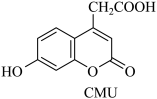

A.可与 溶液发生显色反应 溶液发生显色反应 | B.苯环上有两种不同化学环境的氢原子 |
| C.CMU分子中不含有手性碳原子 | D.CMU分子中涉及元素的电负性:O>C>H |
您最近一年使用:0次
2023-02-07更新
|
295次组卷
|
2卷引用:云南省大理白族自治州民族中学2023-2024学年高三上学期见面考理科综合化学试题
名校
解题方法
2 . 丁二酮肟常用于检验 ,在稀氨水介质中,丁二酮肟与
,在稀氨水介质中,丁二酮肟与 反应可生成鲜红色沉淀,其结构如图所示。下列说法不正确的是
反应可生成鲜红色沉淀,其结构如图所示。下列说法不正确的是
 ,在稀氨水介质中,丁二酮肟与
,在稀氨水介质中,丁二酮肟与 反应可生成鲜红色沉淀,其结构如图所示。下列说法不正确的是
反应可生成鲜红色沉淀,其结构如图所示。下列说法不正确的是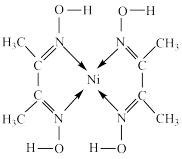
A.元素H、C、N、O、Ni电负性由大到小的顺序为 |
| B.1mol该沉淀含有σ键与π键的个数比为17:2 |
C.基态 的价电子排布式为 的价电子排布式为 |
D.该沉淀中C的杂化方式为 、 、 |
您最近一年使用:0次
2022-12-17更新
|
758次组卷
|
7卷引用:云南省曲靖市第一中学2023-2024学年高三上学期12月月考理综试题
3 . Br2是一种重要的工业原料,沸点为59℃,微溶于水,有很强的挥发性和腐蚀性。海水苦卤含溴(Br-)高达60mg•L-1,是非常宝贵的化工资源。从苦卤中提溴的一种工艺流程如图1,回答下列问题:
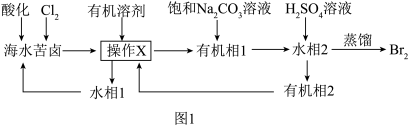
(1)基态溴原子的价层电子排布式为____ 。
(2)①不同pH下,Cl2的用量即配氯率(实际通入Cl2和理论需要Cl2的体积比)与所得溶液中Br2的含量关系如图2所示。综合考虑,选择配氯率为和酸化的pH分别为____ 。
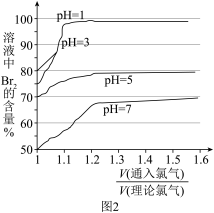
a.1.1,1 b.1.1,3 c.1.1,5 d.1,7
②用有机溶剂提溴的操作X名称为____ ,大部分卤代烃对环境不友好,所以工业上常用“乙酸仲丁酯”提溴,“有机相1”在原溶液的____ (填“上”或“下”)层。
③向“有机相1”中加入饱和Na2CO3溶液,Br2歧化为NaBrO3和NaBr,同时产生气体,写出化学方程式:____ ;向“水相2”中加入硫酸又可以得到Br2,离子方程式为____ 。
(3)某化学兴趣小组模拟“粗溴”蒸馏收集溴的过程,设计了如图3所示的实验装置。
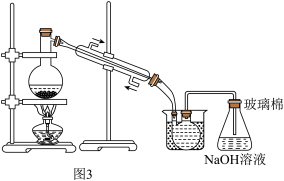
①实验过程中,蒸馏加热温度需控制80~90℃,再收集59℃的馏分。在图中补画出____ ,完成该控温实验操作,所需要的常用玻璃仪器____ 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是____ 。
(4)现有1m3含溴(Br-)60mg•L-1的海水苦卤,若整个流程中有20%的溴损失,最终可以制得Br2质量为____ 。

(1)基态溴原子的价层电子排布式为
(2)①不同pH下,Cl2的用量即配氯率(实际通入Cl2和理论需要Cl2的体积比)与所得溶液中Br2的含量关系如图2所示。综合考虑,选择配氯率为和酸化的pH分别为

a.1.1,1 b.1.1,3 c.1.1,5 d.1,7
②用有机溶剂提溴的操作X名称为
③向“有机相1”中加入饱和Na2CO3溶液,Br2歧化为NaBrO3和NaBr,同时产生气体,写出化学方程式:
(3)某化学兴趣小组模拟“粗溴”蒸馏收集溴的过程,设计了如图3所示的实验装置。

①实验过程中,蒸馏加热温度需控制80~90℃,再收集59℃的馏分。在图中补画出
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
(4)现有1m3含溴(Br-)60mg•L-1的海水苦卤,若整个流程中有20%的溴损失,最终可以制得Br2质量为
您最近一年使用:0次
名校
解题方法
4 . 短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
| 0.1 mol∙L−1溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
| A.原子半径:Y<W | B.元素第一电离能:Z>W |
| C.元素电负性:X<Z | D.简单氢化物的沸点:X<Z |
您最近一年使用:0次
名校
解题方法
5 . 近年来我国取得让世界瞩目的科技成果,化学功不可没。下列说法不正确的是
| A.“天和核心舱”电推进系统中的腔体采用氮化硼陶瓷属于新型无机非金属材料 |
| B.“神舟十三号”载人飞船返回舱的降落伞面料为芳纶,芳纶是有机高分子材料 |
| C.“嫦娥五号”运载火箭用液氧液氢推进剂,产物对环境无污染 |
| D.“奋斗者”号潜水器外壳材料为钛合金,22号钛元素在周期表中位于ds区 |
您最近一年使用:0次
名校
解题方法
6 . 最近合成的一种铁基超导材料 ,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
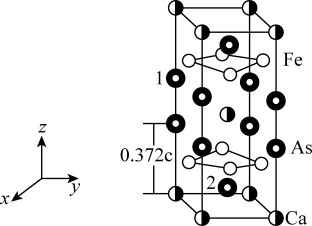
(1)Fe的基态原子共有_______ 种不同能级的电子。
(2) 的沸点(1935℃)高于
的沸点(1935℃)高于 的沸点(130.2℃)原因是
的沸点(130.2℃)原因是_______ 。
(3)Fe可以与CO、NO、 等多种微粒形成配合物。
等多种微粒形成配合物。
①C、N、O的第一电离能由大到小的顺序为_______ 。
②写出 的一种等电子体分子
的一种等电子体分子_______ 。
(4) 溶液中含有的微粒内部及微粒间作用力除共价键外还有
溶液中含有的微粒内部及微粒间作用力除共价键外还有_______ ,溶质阴离子的中心原子杂化轨道类型为_______ 。
(5)该材料的化学式为_______ ,已知:体心的Ca原子与顶点的Ca原子有着相同的化学环境(化学环境受周围粒子的数目与距离所影响),该晶胞的晶胞参数为a pm、a pm、c pm,晶胞中As原子1分数坐标为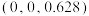 ,则As原子2的分数坐标为
,则As原子2的分数坐标为_______ 。
 ,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
(1)Fe的基态原子共有
(2)
 的沸点(1935℃)高于
的沸点(1935℃)高于 的沸点(130.2℃)原因是
的沸点(130.2℃)原因是(3)Fe可以与CO、NO、
 等多种微粒形成配合物。
等多种微粒形成配合物。①C、N、O的第一电离能由大到小的顺序为
②写出
 的一种等电子体分子
的一种等电子体分子(4)
 溶液中含有的微粒内部及微粒间作用力除共价键外还有
溶液中含有的微粒内部及微粒间作用力除共价键外还有(5)该材料的化学式为
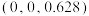 ,则As原子2的分数坐标为
,则As原子2的分数坐标为
您最近一年使用:0次
2022-11-13更新
|
104次组卷
|
2卷引用:福建省宁德市2022-2023学年高三上学期期中区域性学业质量检测化学试题
名校
解题方法
7 . 下列化学用语表达正确的是
A.基态As原子的简化电子排布式: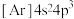 | B.丙炔的键线式: |
C.KCl形成过程: | D.质量数为2的氢核素: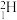 |
您最近一年使用:0次
2022-11-13更新
|
95次组卷
|
2卷引用:福建省宁德市2022-2023学年高三上学期期中区域性学业质量检测化学试题
8 . 铜是人类最早使用的金属之一。回答下列问题:
(1)基态铜原子的价层电子排布图为___________ 。
(2)向 溶液中加入足量氨水得到深蓝色
溶液中加入足量氨水得到深蓝色 溶液,再向其中加入盐酸羟胺(
溶液,再向其中加入盐酸羟胺(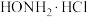 )至溶液变为无色,再通入
)至溶液变为无色,再通入 后析出
后析出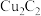 红色沉淀(干燥时极易爆炸)。上述涉及的H、C、N、O、S、Cl、Cu七种元素中第一电离能最大的是
红色沉淀(干燥时极易爆炸)。上述涉及的H、C、N、O、S、Cl、Cu七种元素中第一电离能最大的是___________ (填元素符号); 的空间结构名称为
的空间结构名称为___________ ; 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为___________ ; 在水中的溶解度较小的原因是
在水中的溶解度较小的原因是___________ ; 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为___________ 。
(3)上述 、
、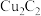 的晶体类型都属于下列中的___________(填标号)。
的晶体类型都属于下列中的___________(填标号)。
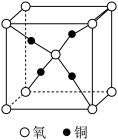
(4)铜和氧形成的一种离子化合物的晶体结构如图所示。若其晶胞边长为a pm,阿伏加德罗常数值为 ,则该晶体密度为
,则该晶体密度为___________  。
。
(1)基态铜原子的价层电子排布图为
(2)向
 溶液中加入足量氨水得到深蓝色
溶液中加入足量氨水得到深蓝色 溶液,再向其中加入盐酸羟胺(
溶液,再向其中加入盐酸羟胺(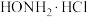 )至溶液变为无色,再通入
)至溶液变为无色,再通入 后析出
后析出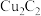 红色沉淀(干燥时极易爆炸)。上述涉及的H、C、N、O、S、Cl、Cu七种元素中第一电离能最大的是
红色沉淀(干燥时极易爆炸)。上述涉及的H、C、N、O、S、Cl、Cu七种元素中第一电离能最大的是 的空间结构名称为
的空间结构名称为 分子中
分子中 键与
键与 键的数目之比为
键的数目之比为 在水中的溶解度较小的原因是
在水中的溶解度较小的原因是 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为(3)上述
 、
、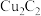 的晶体类型都属于下列中的___________(填标号)。
的晶体类型都属于下列中的___________(填标号)。| A.分子晶体 | B.共价晶体 | C.金属晶体 | D.离子晶体 |
 ,则该晶体密度为
,则该晶体密度为 。
。
您最近一年使用:0次
9 . 全球的海底和冰川底部藏在天然气水合物(又称“可燃冰”)中的天然气,是巨大的潜在能源。我国可燃冰开采技术世界领先。某种可燃冰平均46个 分子构成8个笼,每个笼可以装1个分子,假设其中6个笼里装有
分子构成8个笼,每个笼可以装1个分子,假设其中6个笼里装有 分子,2个笼里装有
分子,2个笼里装有 分子。下列说法错误的是
分子。下列说法错误的是
 分子构成8个笼,每个笼可以装1个分子,假设其中6个笼里装有
分子构成8个笼,每个笼可以装1个分子,假设其中6个笼里装有 分子,2个笼里装有
分子,2个笼里装有 分子。下列说法错误的是
分子。下列说法错误的是A.该可燃冰的组成可表示为 |
| B.其组成元素中电负性最大的是O,最小的是H |
| C.可燃冰可看作由水和甲烷等分子通过非共价键形成的超分子 |
| D.硫化氢分子间也能通过与水分子间类似的相互作用形成分子笼 |
您最近一年使用:0次
名校
解题方法
10 . 工业上用含砷、锑烟灰(主要成分为Sb2O3、As2O3,含Pb、Ag、 Cu的氧化物)制取焦锑酸钠[NaSb(OH)6]和砷酸钠晶体(Na3AsO4 ·12H2O),不仅治理了砷害污染,还可综合回收其他有价金属。其工艺流程如图所示:
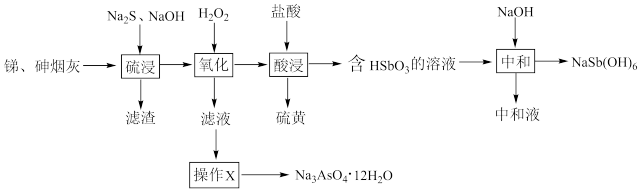
已知:①Pb、Ag、Cu的氧化物不溶于Na2S溶液。
②硫浸后,锑、砷以Na3SbS3、Na3AsS3的形式存在。
③NaSb(OH)6易溶于热水,难溶于冷水,不溶于乙醇。
回答下列问题:
(1)As的核外电子排布式是_______ , 在元素周期表中,Cu处于_______ 区。
(2)“硫浸”时,Sb2O3溶解的离子方程式为_______ 。“氧化”时氧化产物除了锑的含氧酸盐外,还有_______ (填化学式)。
(3)“操作”X为_______ 、过滤、洗涤、干燥。“中和”时生成NaSb( OH)6的化学方程式是_______ 。
(4)研究发现,电解硫浸液中的Na3SbS3-NaOH溶液,可得到单质Sb,则阴极的电极反应式为_______ 。
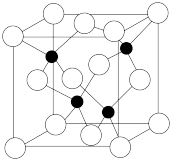
(5)砷的化合物砷化镓是一种重要的半导体材料,已知镓(Ga)是铝的同族元素,砷化镓的晶胞结构如图所示。该晶胞中黑球代表_______ ( 填元素符号),砷化镓的化学式为_______ ,该晶体中含有的化学键为_______ (填“共价键”“配位键”“离子键”),属于_______ 晶体。

已知:①Pb、Ag、Cu的氧化物不溶于Na2S溶液。
②硫浸后,锑、砷以Na3SbS3、Na3AsS3的形式存在。
③NaSb(OH)6易溶于热水,难溶于冷水,不溶于乙醇。
回答下列问题:
(1)As的核外电子排布式是
(2)“硫浸”时,Sb2O3溶解的离子方程式为
(3)“操作”X为
(4)研究发现,电解硫浸液中的Na3SbS3-NaOH溶液,可得到单质Sb,则阴极的电极反应式为
(5)砷的化合物砷化镓是一种重要的半导体材料,已知镓(Ga)是铝的同族元素,砷化镓的晶胞结构如图所示。该晶胞中黑球代表

您最近一年使用:0次



