名校
1 . 首例有机小分子催化剂催化的不对称Aldol反应如下:
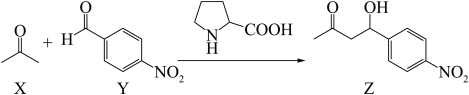
下列说法错误的是

下列说法错误的是
| A.X分子中σ键和π键数目之比为3: 1 |
| B.Y分子中所有原子可能在同一平面内 |
| C.Z能发生氧化、取代、消去反应 |
| D.第一电离能:N>O>C |
您最近一年使用:0次
2023-04-24更新
|
403次组卷
|
2卷引用:云南省昆明市云南民族大学附属高级中学2023-2024学年高三上学期第一次月考理综化学试题
2 . KH2PO4晶体具有优异的非线性光学性能,关于该物质涉及的元素,下列说法正确的是
| A.电负性:P>O>H |
| B.离子半径大小:K+>P3->O2- |
| C.基态K原子有19种不同运动状态的电子 |
D.基态P原子的价层电子轨道表示式: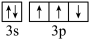 |
您最近一年使用:0次
2023-04-24更新
|
282次组卷
|
10卷引用:云南省昆明市五华区2023届高三教学质量摸底检测化学试题
云南省昆明市五华区2023届高三教学质量摸底检测化学试题云南省大理白族自治州民族中学2023-2024学年高三上学期见面考理科综合化学试题河北省邢台市2021-2022学年高二下学期期末考试化学试题广东省云浮市2021-2022学年高二下学期期末教学质量检测化学试题湖北省恩施州高中教育联盟2021-2022学年高二下学期期末考试化学试题湖南省衡阳市祁东县2021-2022学年高二下学期期末考试化学试题福建省漳州市第三中学2022-2023学年高二下学期3月质量检测化学试题湖北省宜城市第一中学、枣阳一中等六校2022-2023学年高二下学期期中考试化学试题广东省顺德市(李兆基中学、郑裕彤中学、华侨中学)等2022-2023学年高二下学期4月期中考试化学试题广东省汕尾市华大实验学校2022-2023学年高二下学期5月月考化学试题
解题方法
3 . X、Y、Z、W是原子序数依次增大的前四周期元素,X元素的简单氢化物能与其最高价氧化物对应水化物反应生成盐; Y元素原子的核外电子只有8种运动状态;Z为短周期金属元素,其简单离子的半径在同周期中最小;基态W原子的未成对电子数为6。下列说法错误的是
| A.第一电离能: X>Y> Z |
B.键角 > > |
| C.W为第四周期d区元素 |
| D.X和Y的最简单气态氢化物中,前者更易液化 |
您最近一年使用:0次
名校
解题方法
4 . 氢键对生命活动具有重要意义。DNA中四种碱基间的配对方式如下图(~代表糖苷键)。下列说法错误的是
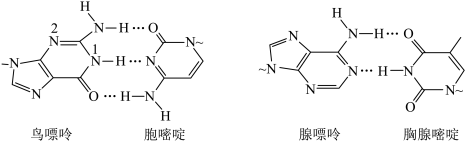

| A.基态氧原子核外的电子有5种不同的空间运动状态 |
| B.鸟嘌呤分子中2号N原子的杂化类型为sp2 |
| C.所涉及的四种元素电负性大小关系: H<C<O<N |
| D.氢键的强度较小,在DNA解旋和复制时容易断裂和形成 |
您最近一年使用:0次
2023-04-15更新
|
457次组卷
|
3卷引用:云南省昆明市云南民族大学附属高级中学2023-2024学年高三上学期期中考试理综化学试题
5 . 配合物XY(ZW)5的结构如图所示,Y位于第四周期且基态原子中含5个单电子,Z与W位于第二周期的p区,ZW结构与N2相似,Z的电负性小于W。下列说法错误的是
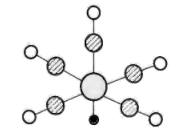

| A.第一电离能: W>Z |
| B.XY(ZW)5中Y的配位数是5 |
| C.W3的熔点低于YW2 |
| D.Z的某种同素异形体具有良好导电性,其中Z原子的杂化方式均为sp2 |
您最近一年使用:0次
解题方法
6 . 氮及其化合物在工农业生产和生命活动中起着重要的作用。同时,氮氧化物(NOx)是常见的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。因此,研究氮氧化物(NOx)的无害化处理对治理大气污染、建设生态文明具有重要意义。请按要求回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬在现代工业中发挥着重要的作用。基态铬、氮原子的未成对电子数之比为__________ 。
(2)联氨(又称肼,N2H4,无色液体)也是氮的一种重要的化合物,是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨的第一步电离方程式为___________ 。
(3)研究氮氧化物(NOx)的无害化处理
I.CO还原NO2的反应原理如下:
已知:①NO2(g)+CO(g) CO2(g)+NO(g) ΔH1= -234kJ·mol-1
CO2(g)+NO(g) ΔH1= -234kJ·mol-1
②N2(g)+O2(g) 2NO(g) ΔH2= +179.5 kJ·mol-1
2NO(g) ΔH2= +179.5 kJ·mol-1
③2NO(g)+O2(g) 2NO2(g) ΔH3=-112.3 kJ·mol-1
2NO2(g) ΔH3=-112.3 kJ·mol-1
NO2与CO反应生成无污染气体的热化学方程式为__________________________ 。
II.用H2还原NO的反应为2H2(g) + 2NO(g) N2(g) + 2H2O(g) ΔH =-752 kJ·mol-1。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:
N2(g) + 2H2O(g) ΔH =-752 kJ·mol-1。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:
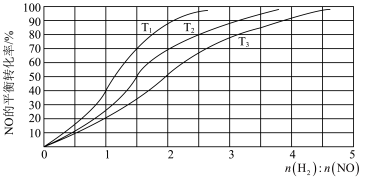
①反应温度T1、T2、T3从高到低的关系为______________________ ;
②T1温度下,充入H2、NO分别为3mol、3mol, 容器内的压强为w Pa,反应进行到10min时达平衡,0~ 10min内N2的平均反应速率为_____________ mol·L-1·s-1,该反应的平衡常数Kp=___________ (写出计算表达式,以分压表示的平衡常数为Kp,某气体分压=总压 ×某气体物质的量分数);
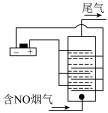
III.以铂为电极,饱和食盐水作电解液,对含有NO的烟气进行脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为 ,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的原理为
,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的原理为___________________________ (用电极反应和离子方程式表示)
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬在现代工业中发挥着重要的作用。基态铬、氮原子的未成对电子数之比为
(2)联氨(又称肼,N2H4,无色液体)也是氮的一种重要的化合物,是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨的第一步电离方程式为
(3)研究氮氧化物(NOx)的无害化处理
I.CO还原NO2的反应原理如下:
已知:①NO2(g)+CO(g)
 CO2(g)+NO(g) ΔH1= -234kJ·mol-1
CO2(g)+NO(g) ΔH1= -234kJ·mol-1②N2(g)+O2(g)
 2NO(g) ΔH2= +179.5 kJ·mol-1
2NO(g) ΔH2= +179.5 kJ·mol-1③2NO(g)+O2(g)
 2NO2(g) ΔH3=-112.3 kJ·mol-1
2NO2(g) ΔH3=-112.3 kJ·mol-1NO2与CO反应生成无污染气体的热化学方程式为
II.用H2还原NO的反应为2H2(g) + 2NO(g)
 N2(g) + 2H2O(g) ΔH =-752 kJ·mol-1。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图:
N2(g) + 2H2O(g) ΔH =-752 kJ·mol-1。为研究H2和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为aL的刚性密闭容器中加入一定量H2和NO发生反应,实验结果如图: 
①反应温度T1、T2、T3从高到低的关系为
②T1温度下,充入H2、NO分别为3mol、3mol, 容器内的压强为w Pa,反应进行到10min时达平衡,0~ 10min内N2的平均反应速率为
III.以铂为电极,饱和食盐水作电解液,对含有NO的烟气进行脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为
 ,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的原理为
,尾气经NaOH溶液吸收后排入空气。NO被阳极产生的氧化性气体氧化的原理为
您最近一年使用:0次
7 . X、Y、Z、W是同周期主族元素,四种元素均是短周期元素,W元素形成的某种单质具有强氧化性,可用于杀菌消毒。四种元素与锂组成的盐是一种新型锂离子电池的电解质,结构如图所示,下列说法正确的是
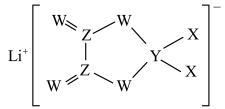

| A.组成这种新型电解质的所有元素均处于元素周期表p区 |
| B.Z元素的含氧酸不可能使酸性高锰酸钾溶液褪色 |
| C.最简单氢化物的沸点: X>W |
| D.同周期中第一电离能比W元素小的有4种元素 |
您最近一年使用:0次
8 . 短周期元素W、X、Y、Z在元素周期表中的相对位置如图4所示,其中W的简单气态氢化物与其最高价氧化物对应的水化物能相互反应,下列说法错误的是
| W | X | |
| Y | Z |
A.基态X原子的轨道表示式为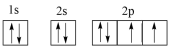 |
| B.第一电离能:W>X |
| C.简单氢化物的稳定性:X>Y |
| D.Z的氧化物对应的水化物为强酸 |
您最近一年使用:0次
名校
解题方法
9 . 阴离子 和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
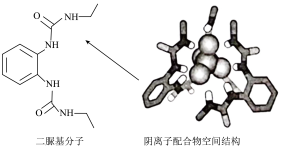
 和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
| A.其中基态原子中未成对电子数最多的元素只有一种 |
B.二脲基分子中 的H和 的H和 离子的O形成氢键 离子的O形成氢键 |
| C.所含元素原子的杂化轨道类型只有一种 |
| D.其中基态原子的第一电离能最大的元素为O |
您最近一年使用:0次
2023-02-24更新
|
2369次组卷
|
10卷引用:2023四省联考化学学科试卷分析
(已下线)2023四省联考化学学科试卷分析安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试理科综合化学试题(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(选择题11-13)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试举一反三(选择题11-13)湖南省长沙市麓山国际实验学校2022-2023学年高三下学期3月月考化学试题(已下线)专题卷20 《物质结构与性质》选择题分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)湖南省长沙市雅礼中学2023届高三模拟考试(一)化学试题(已下线)T9-物质结构(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)河南省商丘市第一高级中学2022-2023学年高二下学期3月份考试化学试题
名校
解题方法
10 . 重铬酸钾( )在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为
)在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为 ,还含杂质
,还含杂质 )为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
)为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
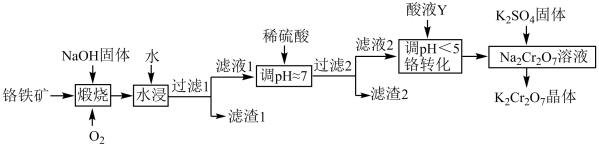
回答下列问题:
(1)基态Cr原子的未成对电子数为_______ 。二氧化硅比二氧化碳熔点高得多的最主要原因是_______ 。
(2)煅烧铬铁矿后生成 和
和 等,已知
等,已知 遇水强烈水解,生成红褐色沉淀,
遇水强烈水解,生成红褐色沉淀, 水解的离子方程式为
水解的离子方程式为_______ ;滤液1中的阴离子主要有 、
、_______ 。
(3)流程中若省去 这一操作,产品中可能含有的杂质是
这一操作,产品中可能含有的杂质是_______ 。
(4)结合离子方程式,从化学平衡移动的角度分析加入酸液Y的作用:_______ 。
(5)由于 是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含
是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含 酸性废水需要进行处理,可用焦亚硫酸钠(
酸性废水需要进行处理,可用焦亚硫酸钠( )将
)将 转化为毒性较低的
转化为毒性较低的 ,室温下再调节溶液的pH,生成
,室温下再调节溶液的pH,生成 沉淀,分离出污泥,保证废水中
沉淀,分离出污泥,保证废水中 的质量浓度小于
的质量浓度小于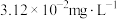 。已知室温下,
。已知室温下,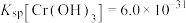 。
。
① 参加反应的离子方程式为
参加反应的离子方程式为_______ 。
②溶液的pH至少要大于_______ 。
 )在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为
)在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为 ,还含杂质
,还含杂质 )为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
)为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
回答下列问题:
(1)基态Cr原子的未成对电子数为
(2)煅烧铬铁矿后生成
 和
和 等,已知
等,已知 遇水强烈水解,生成红褐色沉淀,
遇水强烈水解,生成红褐色沉淀, 水解的离子方程式为
水解的离子方程式为 、
、(3)流程中若省去
 这一操作,产品中可能含有的杂质是
这一操作,产品中可能含有的杂质是(4)结合离子方程式,从化学平衡移动的角度分析加入酸液Y的作用:
(5)由于
 是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含
是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含 酸性废水需要进行处理,可用焦亚硫酸钠(
酸性废水需要进行处理,可用焦亚硫酸钠( )将
)将 转化为毒性较低的
转化为毒性较低的 ,室温下再调节溶液的pH,生成
,室温下再调节溶液的pH,生成 沉淀,分离出污泥,保证废水中
沉淀,分离出污泥,保证废水中 的质量浓度小于
的质量浓度小于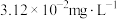 。已知室温下,
。已知室温下,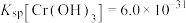 。
。①
 参加反应的离子方程式为
参加反应的离子方程式为②溶液的pH至少要大于
您最近一年使用:0次
2023-02-17更新
|
356次组卷
|
4卷引用:云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题
(已下线)云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题湖南省名校联盟2022-2023学年高三下学期2月联考化学试题湖南省岳阳市第一中学2023届高三下学期第七次月考化学试题



