名校
解题方法
1 . 氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为__________ 。氧元素与氟元素能形成OF2分子,该分子的空间构型为__________ 。
(2)根据等电子体原理,在 中氮原子轨道杂化类型是
中氮原子轨道杂化类型是__________ ;1 mol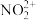 中含有的π键数目为
中含有的π键数目为__________ 个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为__________ 。
(4)下列物质的分子与O3分子的结构最相似的是__________ 。
A.H2O B.CO2 C.SO2 D.BeCl2
(5)O3分子是否为极性分子?__________ 。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为
(2)根据等电子体原理,在
 中氮原子轨道杂化类型是
中氮原子轨道杂化类型是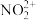 中含有的π键数目为
中含有的π键数目为(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为
(4)下列物质的分子与O3分子的结构最相似的是
A.H2O B.CO2 C.SO2 D.BeCl2
(5)O3分子是否为极性分子?
您最近一年使用:0次
2018-02-12更新
|
236次组卷
|
4卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第二章 综合检测2
河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第二章 综合检测2(已下线)模块同步卷07 第二章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷山西省平遥中学校2018-2019学年高二下学期第二次月考化学试题
名校
2 . 下列说法中正确的是( )
| A.s电子绕核旋转,其轨道为一圆圈,而p电子是∞字形 |
| B.能层为1时,有自旋相反的两个轨道 |
| C.能层为3时,有3s、3p、3d、4f四个轨道 |
| D.s电子云是球形对称的,其疏密程度表示电子在该处出现的概率大小 |
您最近一年使用:0次
2017-04-12更新
|
547次组卷
|
9卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1
河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1河北省石家庄市第一中学2019-2020学年高二下学期第一次月考化学试题2016-2017学年甘肃省武威市第十八中学高二下学期第一次月考化学试卷湖北省襄阳市第四中学2017-2018学年高二12月月考化学试题贵州省安顺市普定县第一中学2018-2019学年高二上学期12月考试化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高二下学期第一次月考化学试题云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题四川省乐山沫若中学2020-2021学年高二上学期第一次月考化学试题(已下线)模块同步卷02 原子结构与元素的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)
名校
3 . 有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是
| A.元素Y和Q可形成化合物Y2Q3 |
| B.X与T的最高价氧化物对应的水化物,前者的酸性比后者强,是因为前者的非羟基氧原子数目大于后者 |
| C.X和Q结合生成的化合物为离子化合物 |
| D.ZQ2是极性键构成的非极性分子 |
您最近一年使用:0次
2017-02-23更新
|
1102次组卷
|
5卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第二章 综合检测2
河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第二章 综合检测22016-2017学年河北省衡水中学高二上学期五调考试化学试卷河北省石家庄市启明中学2019-2020学年高二四月月考化学试题(已下线)模块同步卷07 第二章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)四川省达川第四中学2021-2022学年高二上学期第一次月考化学试题
名校
4 . 原子最外层电子排布式为ns2的元素有很多种,下列对该元素的推测不正确的是
| A.该元素可能与IA族某种元素性质相似 |
| B.该元素的单质、氧化物、氢氧化物可能都与NaOH溶液反应 |
| C.该元素原子中可能有未成对电子 |
| D.该元素原子的得电子能力可能很强 |
您最近一年使用:0次
2017-02-23更新
|
604次组卷
|
4卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1
河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测12016-2017学年河北省衡水中学高二上学期五调考试化学试卷河北省石家庄市启明中学2019-2020学年高二四月月考化学试题(已下线)专题11.1 原子结构与性质(练)-《2020年高考一轮复习讲练测》
11-12高二下·山西临汾·阶段练习
名校
解题方法
5 . 下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
| X | |||
| W | Y | R | |
| Z | |||
| A.W元素的第一电离能小于Y元素的第一电离能 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.X元素是电负性最大的元素 |
| D.p轨道未成对电子最多的是Z元素 |
您最近一年使用:0次
2016-12-09更新
|
722次组卷
|
39卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1
河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1河北省蠡县中学2016-2017学年高二6月月考化学试题河北省廊坊市第一中学2016-2017学年高二下学期6月月考化学试题人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质1河北省深州市长江中学2019-2020学年高二下学期第一次月考化学试题(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)(已下线)模块同步卷03 第一章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)河北沧州泊头一中2020-2021学年高二下学期第二次月考化学试题(已下线)2011-2012学年山西省临汾一中高二第二学期3月月考化学试卷(已下线)2012-2013学年陕西省宝鸡中学高二下学期期中考试化学试卷内蒙古巴彦淖尔第一中学2015-2016学年高二普通班上期末化学卷2015-2016学年吉林省汪清六中高二3月月考化学试卷2015-2016学年湖北省黄石市有色一中高二下学期期中考试化学试卷2015-2016学年福建省福州市五校高二下学期期中联考化学试卷2014-2015学年陕西西北大学附中高二下期末化学试卷2015-2016学年辽宁省营口市大石桥二中高二下4月月考化学试卷2016-2017学年四川省阆中中学高二上教学质检化学试卷安徽省阜阳市临泉县第一中学2016-2017学年高一下学期学科竞赛化学试题安徽省蚌埠市第二中学2017-2018学年高二上学期期中考试化学试题甘肃省兰州第一中学2017-2018学年高二下学期第一次月考化学试题黑龙江省齐齐哈尔市第八中学2017-2018学年高二3月月考化学试题山西省实验中学2017-2018学年高二下学期第一次月考化学试题山西省平遥中学校2018-2019学年高二下学期第二次月考化学试题新疆阿勒泰地区第二高级中学2018-2019学年高二下学期期末(A卷)化学试题海南省三亚华侨学校2019-2020学年高二上学期期中考试化学试题山东省烟台第二中学2019-2020学年高二上学期12月月考化学试题河南省林州市林虑中学2019-2020学年高二3月线上考试化学试题吉林省白山市第七中学2019-2020学年高二下学期3月份月考化学试题宁夏回族自治区银川市宁夏大学附属中学2020-2021学年高二上学期第一次月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 综合检测卷(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 章末综合检测卷鲁科版2019选择性必修2第1章综合检测卷高二选择性必修2(人教版2019)第一章 原子结构与性质 第二节 原子结构与元素的性质 课时2 元素周期律吉林省长春外国语学校2020-2021学年高一下学期第一次月考化学(理科)试题陕西省宝鸡市金台区2020-2021学年高二下学期期中考试化学试题河南省南阳市六校2021-2022学年高二下学期第一次联考化学试题(B)新疆疏勒县实验学校2021-2022学年高二下学期期末考试化学试题云南省大理州实验中学2021-2022学年高二下学期化学期中考试题甘肃省庆阳市第二中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
6 . 钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为_______ ,其价层电子排布图为____________ 。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为____ 、_____ 。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__ 对,分子的立体构型为___ ;SO3气态为单分子,该分子中S原子的杂化轨道类型为____ ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为___ ;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__ (填图2中字母),该分子中含有___ 个σ键。

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___ ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______ 。
(1)钒在元素周期表中的位置为
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为
您最近一年使用:0次
2016-12-09更新
|
411次组卷
|
6卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第三章 综合检测3
7 . 下列说法正确的是
| A.氢原子光谱是元素的所有光谱中最复杂的光谱之一 |
| B.“量子化”就是不连续的意思,微观粒子运动均有此特点 |
| C.玻尔理论不但成功解释了氢原子光谱,而且还推广到其他原子光谱 |
| D.原子中电子在具有确定半径的圆周轨道上像火车一样高速运转着 |
您最近一年使用:0次
2016-12-09更新
|
470次组卷
|
5卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1
8 . 以下对核外电子运动状况的描述正确的是( )
| A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转 |
| B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动 |
| C.能层序数越大,s原子轨道的半径越大 |
| D.在同一能级上运动的电子,其运动状态肯定不同 |
您最近一年使用:0次
2016-12-09更新
|
842次组卷
|
5卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1
河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1(已下线)2012年人教版高中化学选修3 1.1原子结构练习卷2016-2017学年甘肃省武威市第十八中学高二下学期第一次月考化学试卷(人教版2019)选择性必修2 第一章 原子结构与性质 第一节 原子结构(已下线)题型73 电子云和电子运动状态
11-12高二上·福建厦门·期中
名校
9 . A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大。下列有关叙述错误的是
| A.四种元素A、B、C、D分别为O、Ca、Na、Ar |
| B.元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等 |
| C.元素A、C简单离子的半径大小关系为A<C |
| D.元素B、C电负性大小关系为B>C |
您最近一年使用:0次
2016-12-09更新
|
520次组卷
|
12卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1
河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2013-2014学年福建省厦门一中高二上学期期中考试化学试卷2016-2017学年宁夏银川市第二中学高二下学期第一次月考化学试卷云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题(已下线)专题11.1 原子结构与性质(练)-《2020年高考一轮复习讲练测》云南省凤庆县第一中学2019-2020学年高二12月月考化学试题(已下线)第35讲 原子结构与性质(精练)-2021年高考化学一轮复习讲练测甘肃省静宁县第一中学2020-2021学年高二上学期期末考试化学(实验班)试题(已下线)模块同步卷02 原子结构与元素的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)吉林省长春市实验中学2020-2021学年度高二下学期阶段考试化学试题云南省玉溪市易门县一中2021-2022学年高二下学期3月月考化学试题



