名校
解题方法
1 . 自然界中,纯粹的典型晶体是不多的,大多数晶体是分子晶体、共价晶体、金属晶体和离子晶体之间的过渡晶体。以下列出了第三周期几种氧化物晶体中离子键的百分数。
提示:离子键的百分数是通过电负性的差值计算出来的,电负性的差值越大,离子键的百分数越大。
(1)从原子结构角度解释,为什么一般认为氧化镁属于离子晶体,而二氧化硅属于共价晶体:___________ 。
(2)硅元素位于元素周期表的___________ 区。基态硅原子的价层电子排布式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,已知该晶体中晶胞各边长度分别为apm、apm和cpm,两条底边夹角为120°,距离最近的两个B原子之间距离为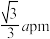 。
。
①该物质化学式为___________ ;
②距离每个B原子最近的Mg原子有___________ 个;
③该晶体密度为___________  。
。 含量。
含量。
(ⅰ)称取m克硅酸钠样品加热溶解后,配置为250mL待测液。
(ⅱ)移取50mL待测液至250mL锥形瓶中,加入10滴甲基红指示剂【HIn(红色) (黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为
(黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为 ,体系中有沉淀。
,体系中有沉淀。
(ⅲ)加入3.0g氟化钠固体,充分反应。
(ⅳ)用0.5000mol/L HCl标准溶液滴定至溶液为玫瑰红色并继续加入至过量,共加入 。
。
(ⅴ)用0.5000mol/L NaOH标准溶液滴定至溶液变为亮黄色,消耗NaOH溶液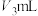 。
。
已知: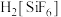 为强电解质,回答问题:
为强电解质,回答问题:
①步骤(ⅲ)中加入NaF后发生化学反应的离子方程式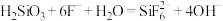 ,则加入NaF后的实验现象为
,则加入NaF后的实验现象为___________ 。
②样品中硅酸钠的纯度为___________ (用质量分数表示)。
| 氧化物 |  | MgO |  |  |
| 离子键百分数 | 62 | 50 | 41 | 33 |
(1)从原子结构角度解释,为什么一般认为氧化镁属于离子晶体,而二氧化硅属于共价晶体:
(2)硅元素位于元素周期表的
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,已知该晶体中晶胞各边长度分别为apm、apm和cpm,两条底边夹角为120°,距离最近的两个B原子之间距离为
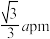 。
。①该物质化学式为
②距离每个B原子最近的Mg原子有
③该晶体密度为
 。
。
 含量。
含量。(ⅰ)称取m克硅酸钠样品加热溶解后,配置为250mL待测液。
(ⅱ)移取50mL待测液至250mL锥形瓶中,加入10滴甲基红指示剂【HIn(红色)
 (黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为
(黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为 ,体系中有沉淀。
,体系中有沉淀。(ⅲ)加入3.0g氟化钠固体,充分反应。
(ⅳ)用0.5000mol/L HCl标准溶液滴定至溶液为玫瑰红色并继续加入至过量,共加入
 。
。(ⅴ)用0.5000mol/L NaOH标准溶液滴定至溶液变为亮黄色,消耗NaOH溶液
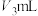 。
。已知:
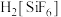 为强电解质,回答问题:
为强电解质,回答问题:①步骤(ⅲ)中加入NaF后发生化学反应的离子方程式
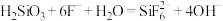 ,则加入NaF后的实验现象为
,则加入NaF后的实验现象为②样品中硅酸钠的纯度为
您最近一年使用:0次
名校
2 . 镍是一种常用催化剂。某工厂采用以下流程提取含镍废料(主要含Ni、NiO,以及少量CuO、FeO、 、MgO、ZnO、
、MgO、ZnO、 和
和 等)中的镍,实现资源再利用。
等)中的镍,实现资源再利用。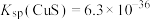 和
和
常温下,某些金属离子形成氢氧化物开始沉淀和完全沉淀的pH:
回答下列问题:
(1)NiO中 的核外电子排布式为
的核外电子排布式为___________ 。
(2)为提高酸浸率,可采取的措施有___________ (写出两项即可)。
(3)当 、
、 完全沉淀时,溶液中
完全沉淀时,溶液中 浓度至少应为
浓度至少应为___________ (常温下,当溶液中的离子浓度小于 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(4)沉淀池2中加入 的目的是
的目的是___________ (用离子方程式表示),为使相应离子完全沉淀,沉淀池2的pH范围应控制在___________ 。
(5)沉淀3的成分是___________ (填化学式)。
(6)用滴定法测定 产品中镍元素含量。取2.000g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入紫脲酸胺指示剂,用浓度为0.100mol/L的
产品中镍元素含量。取2.000g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入紫脲酸胺指示剂,用浓度为0.100mol/L的 标准液滴定,重复操作2~3次,消耗
标准液滴定,重复操作2~3次,消耗 标准液平均值为12.40mL。(已知:ⅰ.
标准液平均值为12.40mL。(已知:ⅰ. ;ⅱ.紫脲酸胺:紫色试剂,遇
;ⅱ.紫脲酸胺:紫色试剂,遇 显橙黄色。)
显橙黄色。)
①滴定至终点的现象是___________ 。
②样品中镍元素的质量分数为___________ (保留4位有效数字)。
 、MgO、ZnO、
、MgO、ZnO、 和
和 等)中的镍,实现资源再利用。
等)中的镍,实现资源再利用。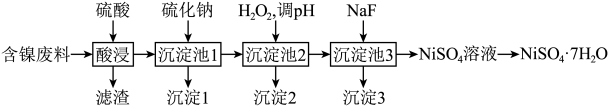
 和
和
常温下,某些金属离子形成氢氧化物开始沉淀和完全沉淀的pH:
| 金属离子 |  |  |  |  |  |
| 开始沉淀的pH | 2.3 | 6.8 | 3.5 | 8.6 | 7.1 |
| 完全沉淀的pH | 3.2 | 8.3 | 4.6 | 11.1 | 9.0 |
(1)NiO中
 的核外电子排布式为
的核外电子排布式为(2)为提高酸浸率,可采取的措施有
(3)当
 、
、 完全沉淀时,溶液中
完全沉淀时,溶液中 浓度至少应为
浓度至少应为 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(4)沉淀池2中加入
 的目的是
的目的是(5)沉淀3的成分是
(6)用滴定法测定
 产品中镍元素含量。取2.000g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入紫脲酸胺指示剂,用浓度为0.100mol/L的
产品中镍元素含量。取2.000g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入紫脲酸胺指示剂,用浓度为0.100mol/L的 标准液滴定,重复操作2~3次,消耗
标准液滴定,重复操作2~3次,消耗 标准液平均值为12.40mL。(已知:ⅰ.
标准液平均值为12.40mL。(已知:ⅰ. ;ⅱ.紫脲酸胺:紫色试剂,遇
;ⅱ.紫脲酸胺:紫色试剂,遇 显橙黄色。)
显橙黄色。)①滴定至终点的现象是
②样品中镍元素的质量分数为
您最近一年使用:0次
名校
3 . 铁铬废泥是FeCl3蚀刻废液经还原、碱沉淀后产生的固体废泥(铁质量分数约为15%,铬质量分数约为2%,不溶物含量为5%~10%,含水率为40%~50%),可用酸洗废液(所含酸主要是盐酸)酸溶后,再经过下列方式处理获得FeCl3和PbCrO4两种产品,变废为宝。
Ⅱ.几种金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)基态Cr原子的价层电子排布式为________ 。
(2)铁铬废泥中铁元素和铬元素的存在形式是________ (填化学式)。
(3)用酸洗废液酸溶时,反应温度为65℃,此时铁铬废泥的浸出效果较佳。但实际生产中,只需要将溶液预热到60℃左右即可,原因是________________ 。
(4)加入Ca(OH)2时,应调节的pH范围为________ 。
(5)试剂A的最佳选择是________ (填字母)。
a.酸性KMnO4溶液 b.HNO3 c.Cl2
(6)绿色溶液转化为黄色溶液过程的离子方程式是________________ 。
(7)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶;用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液;充分反应后,滴入淀粉指示剂并用cmol·L-1Na2S2O3溶液滴定用去VmL。样品中氯化铁的质量分数为________ (用字母m、c、V来表示)。已知:I2+2 =2I-+
=2I-+ 。
。
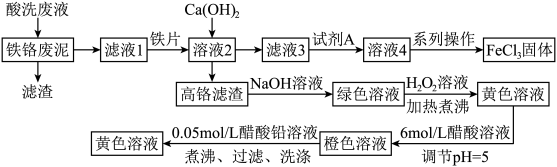
| 物质 | Cr(OH)3 |  |  |  | PbCrO4 |
| 颜色状态 | 绿色沉淀 | 绿色溶液 | 黄色溶液 | 橙色溶液 | 黄色沉淀 |
| 金属离子 | Fe3+ | Fe2+ | Cr3+ |
| 开始沉淀的pH | 2.3 | 7.6 | 4.5 |
| 完全沉淀的pH | 3.3 | 9.1 | 5.6 |
(1)基态Cr原子的价层电子排布式为
(2)铁铬废泥中铁元素和铬元素的存在形式是
(3)用酸洗废液酸溶时,反应温度为65℃,此时铁铬废泥的浸出效果较佳。但实际生产中,只需要将溶液预热到60℃左右即可,原因是
(4)加入Ca(OH)2时,应调节的pH范围为
(5)试剂A的最佳选择是
a.酸性KMnO4溶液 b.HNO3 c.Cl2
(6)绿色溶液转化为黄色溶液过程的离子方程式是
(7)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶;用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液;充分反应后,滴入淀粉指示剂并用cmol·L-1Na2S2O3溶液滴定用去VmL。样品中氯化铁的质量分数为
 =2I-+
=2I-+ 。
。
您最近一年使用:0次
名校
4 . 铁元素是一种常见的过渡金属,铁及其化合物在化工、医药、材料等领域有着广泛的应用。根据要求回答下列问题:
(1)基态 的核外电子排布式是
的核外电子排布式是______ 。
(2)补铁剂常用于防治缺铁性贫血。第一代口服补铁剂以硫酸亚铁为代表,检验 是否被氧化为
是否被氧化为 的方法之一是:取待测液,加入KSCN溶液,观察是否有红色的
的方法之一是:取待测液,加入KSCN溶液,观察是否有红色的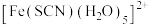 生成。
生成。
①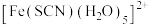 中
中 的杂化轨道类型为
的杂化轨道类型为______ (填字母)。
A. B.
B. C.
C. D.
D.
②解释配体 和
和 的键角大小
的键角大小______ 。
(3)某兴趣小组用酸性 溶液滴定
溶液滴定 ,通过测定
,通过测定 的含量来计算某补铁剂中
的含量来计算某补铁剂中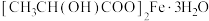 (乳酸亚铁)的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因可能是
(乳酸亚铁)的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因可能是______ 。
(4)补铁剂常用于防治缺铁性贫血。第一代口服补铁剂以硫酸亚铁为代表;第二代口服补铁剂以乳酸亚铁、富马酸亚铁等为代表,富马酸(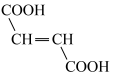 )和马来酸(
)和马来酸(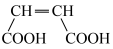 )为顺反异构体。
)为顺反异构体。
①富马酸分子中的 键和
键和 键个数比为
键个数比为______ 。
②富马酸熔点为300℃,马来酸熔点为140℃,解释熔点差异的原因______ 。
(5)金属元素铁能形成多种配合物, [三硝酸六尿素合铁(Ⅲ)]和
[三硝酸六尿素合铁(Ⅲ)]和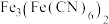 。
。
① 的空间结构是
的空间结构是______ 。
②尿素 中各元素的电负性由大到小的顺序是
中各元素的电负性由大到小的顺序是______ 。
③向 溶液中滴加
溶液中滴加 溶液后,经提纯、结晶后可得到蓝色晶体
溶液后,经提纯、结晶后可得到蓝色晶体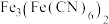 。可溶性氰化物(如KCN)有剧毒,但该蓝色晶体却无毒,请从结构角度解释其无毒的原因
。可溶性氰化物(如KCN)有剧毒,但该蓝色晶体却无毒,请从结构角度解释其无毒的原因______ 。
(1)基态
 的核外电子排布式是
的核外电子排布式是(2)补铁剂常用于防治缺铁性贫血。第一代口服补铁剂以硫酸亚铁为代表,检验
 是否被氧化为
是否被氧化为 的方法之一是:取待测液,加入KSCN溶液,观察是否有红色的
的方法之一是:取待测液,加入KSCN溶液,观察是否有红色的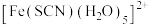 生成。
生成。①
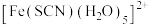 中
中 的杂化轨道类型为
的杂化轨道类型为A.
 B.
B. C.
C. D.
D.
②解释配体
 和
和 的键角大小
的键角大小(3)某兴趣小组用酸性
 溶液滴定
溶液滴定 ,通过测定
,通过测定 的含量来计算某补铁剂中
的含量来计算某补铁剂中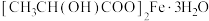 (乳酸亚铁)的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因可能是
(乳酸亚铁)的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因可能是(4)补铁剂常用于防治缺铁性贫血。第一代口服补铁剂以硫酸亚铁为代表;第二代口服补铁剂以乳酸亚铁、富马酸亚铁等为代表,富马酸(
 )和马来酸(
)和马来酸(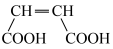 )为顺反异构体。
)为顺反异构体。①富马酸分子中的
 键和
键和 键个数比为
键个数比为②富马酸熔点为300℃,马来酸熔点为140℃,解释熔点差异的原因
(5)金属元素铁能形成多种配合物,
 [三硝酸六尿素合铁(Ⅲ)]和
[三硝酸六尿素合铁(Ⅲ)]和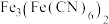 。
。①
 的空间结构是
的空间结构是②尿素
 中各元素的电负性由大到小的顺序是
中各元素的电负性由大到小的顺序是③向
 溶液中滴加
溶液中滴加 溶液后,经提纯、结晶后可得到蓝色晶体
溶液后,经提纯、结晶后可得到蓝色晶体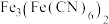 。可溶性氰化物(如KCN)有剧毒,但该蓝色晶体却无毒,请从结构角度解释其无毒的原因
。可溶性氰化物(如KCN)有剧毒,但该蓝色晶体却无毒,请从结构角度解释其无毒的原因
您最近一年使用:0次
名校
5 . 门捷列夫在研究周期表时预言了“类硅”元素锗和“类铝”元素镓等11种元素。锗及其化合物应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含 、
、 )的工艺如下:
)的工艺如下: 与碱反应生成
与碱反应生成 ;
;
ii. 极易水解,
极易水解, 的沸点为86.6℃。
的沸点为86.6℃。
(1)写出“类硅”元素锗的基态原子的价电子排布图:_______ 。
(2)从原子结构角度解释Ge和Si金属性递变的原因:_______ 。
(3)“氧化”过程是将 氧化为
氧化为 ,写出该转化过程的离子方程式:
,写出该转化过程的离子方程式:_______ 。
(4)加盐酸蒸馏生成 反应的化学方程式为
反应的化学方程式为_______ 。
(5)高纯二氧化锗的含量采用碘酸钾滴定法进行测定。称取ag高纯二氧化锗样品,加入氢氧化钠溶液在电炉中溶解,冷却至:20℃以下,然后用次磷酸与过量氢氧化钠溶液反应得到的次磷酸钠( )将其还原为
)将其还原为 ,以淀粉为指示剂,用bmol/L的碘酸钾标准溶液滴定,消耗碘酸钾溶液的体积为VmL。(20℃以下,次磷酸钠不会被碘酸钾和碘氧化)。
,以淀粉为指示剂,用bmol/L的碘酸钾标准溶液滴定,消耗碘酸钾溶液的体积为VmL。(20℃以下,次磷酸钠不会被碘酸钾和碘氧化)。
资料: ,
, 。
。
①次磷酸钠( )为
)为_______ (填“正盐”或“酸式盐”)。
②上述滴定终点的判断方法为_______ 。
③此样品中二氧化锗的质量分数是_______ (用表达式表示)。
 、
、 )的工艺如下:
)的工艺如下: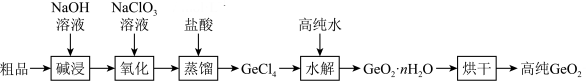
 与碱反应生成
与碱反应生成 ;
;ii.
 极易水解,
极易水解, 的沸点为86.6℃。
的沸点为86.6℃。(1)写出“类硅”元素锗的基态原子的价电子排布图:
(2)从原子结构角度解释Ge和Si金属性递变的原因:
(3)“氧化”过程是将
 氧化为
氧化为 ,写出该转化过程的离子方程式:
,写出该转化过程的离子方程式:(4)加盐酸蒸馏生成
 反应的化学方程式为
反应的化学方程式为(5)高纯二氧化锗的含量采用碘酸钾滴定法进行测定。称取ag高纯二氧化锗样品,加入氢氧化钠溶液在电炉中溶解,冷却至:20℃以下,然后用次磷酸与过量氢氧化钠溶液反应得到的次磷酸钠(
 )将其还原为
)将其还原为 ,以淀粉为指示剂,用bmol/L的碘酸钾标准溶液滴定,消耗碘酸钾溶液的体积为VmL。(20℃以下,次磷酸钠不会被碘酸钾和碘氧化)。
,以淀粉为指示剂,用bmol/L的碘酸钾标准溶液滴定,消耗碘酸钾溶液的体积为VmL。(20℃以下,次磷酸钠不会被碘酸钾和碘氧化)。资料:
 ,
, 。
。①次磷酸钠(
 )为
)为②上述滴定终点的判断方法为
③此样品中二氧化锗的质量分数是
您最近一年使用:0次
解题方法
6 . 轻质碳酸钙可用作橡胶的填料。以磷石膏(含 和少量
和少量 、
、 等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:

(1) 的价层电子排布式为:
的价层电子排布式为:___________ 。
(2)“转化”步骤中 转化为
转化为 的化学方程式
的化学方程式___________ 。
(3)“除杂”时通入 的目的是
的目的是___________ ,滤渣的成分是:___________ (填化学式)。
(4)通过下列方法测定产品中碳酸钙的含量:准确称取0.5000g产品用盐酸充分溶解,过滤,将滤液和洗涤液转移至250mL容量瓶中定容、摇匀,记为试液A,取25.00mL试液A,加入指示剂,调节 ,用
,用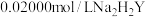 标准溶液滴定
标准溶液滴定 ,至终点时消耗
,至终点时消耗 溶液24.60mL.计算产品中碳酸钙的质量分数
溶液24.60mL.计算产品中碳酸钙的质量分数___________ 。(保留三位有效数字)
(5)铝铵矾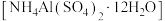 是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案,部分物质的溶解度随温度的变化如下图所示:
是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案,部分物质的溶解度随温度的变化如下图所示:
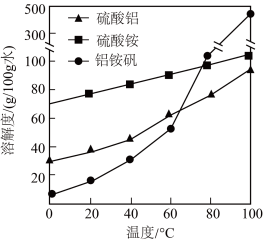
①在“转化”后的滤液中加入 的
的 溶液,边加边搅拌,到不再产生气体为止,将所得溶液蒸发浓缩至有大量晶体析出,过滤,用无水乙醇洗涤、干燥,得
溶液,边加边搅拌,到不再产生气体为止,将所得溶液蒸发浓缩至有大量晶体析出,过滤,用无水乙醇洗涤、干燥,得 固体。
固体。
②向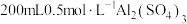 溶液中加入
溶液中加入___________  固体,边加边搅拌,当固体完全溶解后,将所得溶液蒸发浓缩至
固体,边加边搅拌,当固体完全溶解后,将所得溶液蒸发浓缩至_____________ (填现象),___________ (填操作),过滤,用无水乙醇洗涤,干燥,得到铝铵矾。
 和少量
和少量 、
、 等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
等)为原料制备轻质碳酸钙和铝铵矾的实验流程如图:
(1)
 的价层电子排布式为:
的价层电子排布式为:(2)“转化”步骤中
 转化为
转化为 的化学方程式
的化学方程式(3)“除杂”时通入
 的目的是
的目的是(4)通过下列方法测定产品中碳酸钙的含量:准确称取0.5000g产品用盐酸充分溶解,过滤,将滤液和洗涤液转移至250mL容量瓶中定容、摇匀,记为试液A,取25.00mL试液A,加入指示剂,调节
 ,用
,用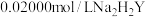 标准溶液滴定
标准溶液滴定 ,至终点时消耗
,至终点时消耗 溶液24.60mL.计算产品中碳酸钙的质量分数
溶液24.60mL.计算产品中碳酸钙的质量分数(5)铝铵矾
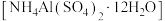 是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案,部分物质的溶解度随温度的变化如下图所示:
是一种水絮凝剂。请补充由“转化”后的滤液制取铝铵矾的实验方案,部分物质的溶解度随温度的变化如下图所示:
①在“转化”后的滤液中加入
 的
的 溶液,边加边搅拌,到不再产生气体为止,将所得溶液蒸发浓缩至有大量晶体析出,过滤,用无水乙醇洗涤、干燥,得
溶液,边加边搅拌,到不再产生气体为止,将所得溶液蒸发浓缩至有大量晶体析出,过滤,用无水乙醇洗涤、干燥,得 固体。
固体。②向
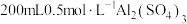 溶液中加入
溶液中加入 固体,边加边搅拌,当固体完全溶解后,将所得溶液蒸发浓缩至
固体,边加边搅拌,当固体完全溶解后,将所得溶液蒸发浓缩至
您最近一年使用:0次
名校
7 . X、Y、Z、W、Q是原子序数依次增大的前四周期元素且只有Q为金属元素,基态X原子核外电子占据3个能级且每个能级上的电子数相等,Z是地壳中含量(质量分数)最高的元素,基态W原子p轨道上的电子数比s轨道上的电子数多4,Q的原子序数为X、Y、W原子序数的总和.下列说法正确的是
A.Q位于元素周期表的 区 区 | B.第一电离能: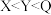 |
C.简单氢化物的沸点: | D.氧化物对应水化物的酸性: |
您最近一年使用:0次
2024-03-29更新
|
143次组卷
|
2卷引用:江西省部分高中学校2023-2024学年高三下学期3月联考化学试卷
8 . 用硫酸亚铁铵滴定法可以测定某铜铬合金中铬元素的含量。请回答下列问题:
(1)硫酸亚铁铵中含有Fe2+,基态Fe2+的核外电子排布式为___________ 。
(2)Cu可以形成很多化合物,Cu2O的熔点为1 235℃,Cu2S的熔点为1130℃,Cu2O熔点较高的原因是___________ 。
(3)配制500mL0.02mol/L的(NH4)2Fe(SO4)2溶液需要的玻璃仪器除500mL容量瓶、烧杯、量筒、玻璃棒外,还有___________ (填仪器名称)。
(4)青铜中铬元素含量的测定
ⅰ.称取1.00g青铜样品于250mL锥形瓶中,加入适量稀硝酸使其完全溶解,再加入适量过硫酸铵溶液,加热煮沸,使样品中的铬元素完全被氧化为H2CrO4,加蒸馏水至250mL,摇匀,冷却至室温。
ⅱ.取25mL上述溶液置于锥形瓶中,滴入4滴N-苯代邻氨基苯甲酸指示剂,用0.02mol/L(NH4)2Fe(SO4)2溶液滴定(加入硫酸酸化),当H2CrO4(弱酸)转化为Cr3+时,溶液由紫红色变为黄绿色,达到滴定终点。
①过程ⅱ中发生反应的离子方程式为___________ 。
②滴定时将(NH4)2Fe(SO4)2溶液加入___________ (填“酸式”或“碱式”)滴定管中。实验中消耗(NH4)2Fe(SO4)2溶液20.00mL,样品中所含铬元素的质量分数为___________ (结果保留两位有效数字)。上述实验过程中,若有部分(NH4)2Fe(SO4)2溶液被空气氧化,则测定结果将___________ (填“偏高”“偏低”或“不变”)。
(1)硫酸亚铁铵中含有Fe2+,基态Fe2+的核外电子排布式为
(2)Cu可以形成很多化合物,Cu2O的熔点为1 235℃,Cu2S的熔点为1130℃,Cu2O熔点较高的原因是
(3)配制500mL0.02mol/L的(NH4)2Fe(SO4)2溶液需要的玻璃仪器除500mL容量瓶、烧杯、量筒、玻璃棒外,还有
(4)青铜中铬元素含量的测定
ⅰ.称取1.00g青铜样品于250mL锥形瓶中,加入适量稀硝酸使其完全溶解,再加入适量过硫酸铵溶液,加热煮沸,使样品中的铬元素完全被氧化为H2CrO4,加蒸馏水至250mL,摇匀,冷却至室温。
ⅱ.取25mL上述溶液置于锥形瓶中,滴入4滴N-苯代邻氨基苯甲酸指示剂,用0.02mol/L(NH4)2Fe(SO4)2溶液滴定(加入硫酸酸化),当H2CrO4(弱酸)转化为Cr3+时,溶液由紫红色变为黄绿色,达到滴定终点。
①过程ⅱ中发生反应的离子方程式为
②滴定时将(NH4)2Fe(SO4)2溶液加入
您最近一年使用:0次
9 . 如图是人体含量较多元素的质量分数图,下列有关这些元素的说法不正确的是
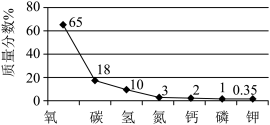
| A.原子半径:N<P |
| B.第一电离能:K>Ca |
C.基态O原子的价层电子轨道表示式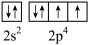 |
| D.图中的七种元素中有2种元素位于周期表第4周期 |
您最近一年使用:0次
2023-03-30更新
|
497次组卷
|
4卷引用:天津市河东区2022-2023学年下学期高中学业水平等级性第—次模拟考试化学试题
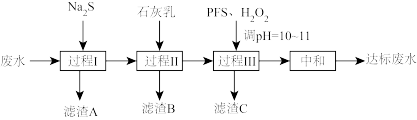
解题方法
10 . 处理含 的废水(
的废水(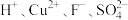 含量均超标)的流程如下:
含量均超标)的流程如下:
已知:① 时,
时,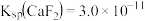 ,
,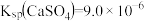 。
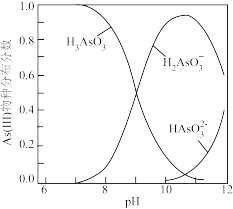
。
②室温下,溶液中 (III)物种分布分数与
(III)物种分布分数与 的关系如图所示。
的关系如图所示。
(1)“过程I”除 及部分砷。
及部分砷。
①基态As的核外电子排布式为_______ 。
②用离子方程式表示 溶液呈碱性的原因
溶液呈碱性的原因_______ 。
(2)“过程II”除 和
和 。测得滤液中
。测得滤液中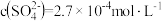 ,此时
,此时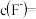
_______  。
。
(3)“过程III”进一步除砷。 (聚合硫酸铁)溶于水形成的
(聚合硫酸铁)溶于水形成的 胶体和加入的
胶体和加入的 可将砷转化为难溶的
可将砷转化为难溶的 除去。
除去。
①生成 的离子方程式为
的离子方程式为_______ 。
②测定“滤渣C”中 含量。称取
含量。称取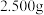 样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取
样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取 溶液于锥形瓶中,依次加入足量的
溶液于锥形瓶中,依次加入足量的 溶液和
溶液和 溶液。充分反应后,用
溶液。充分反应后,用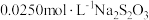 标准溶液滴定至终点,平行滴定3次,平均消耗
标准溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液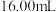 。
。
(已知: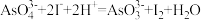 ,
,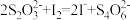 ;
; 与
与 反应生成
反应生成 ,氧化性
,氧化性 。)
。)
i.加入足量的 溶液的作用为
溶液的作用为_______ 。
ii.计算样品中 的质量分数
的质量分数_______ (写出计算过程)。
 的废水(
的废水(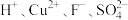 含量均超标)的流程如下:
含量均超标)的流程如下:
已知:①
 时,
时,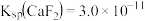 ,
,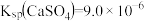 。
。②室温下,溶液中
 (III)物种分布分数与
(III)物种分布分数与 的关系如图所示。
的关系如图所示。
(1)“过程I”除
 及部分砷。
及部分砷。①基态As的核外电子排布式为
②用离子方程式表示
 溶液呈碱性的原因
溶液呈碱性的原因(2)“过程II”除
 和
和 。测得滤液中
。测得滤液中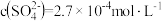 ,此时
,此时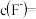
 。
。(3)“过程III”进一步除砷。
 (聚合硫酸铁)溶于水形成的
(聚合硫酸铁)溶于水形成的 胶体和加入的
胶体和加入的 可将砷转化为难溶的
可将砷转化为难溶的 除去。
除去。①生成
 的离子方程式为
的离子方程式为②测定“滤渣C”中
 含量。称取
含量。称取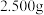 样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取
样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取 溶液于锥形瓶中,依次加入足量的
溶液于锥形瓶中,依次加入足量的 溶液和
溶液和 溶液。充分反应后,用
溶液。充分反应后,用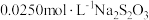 标准溶液滴定至终点,平行滴定3次,平均消耗
标准溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液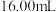 。
。(已知:
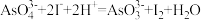 ,
,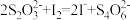 ;
; 与
与 反应生成
反应生成 ,氧化性
,氧化性 。)
。) i.加入足量的
 溶液的作用为
溶液的作用为ii.计算样品中
 的质量分数
的质量分数
您最近一年使用:0次



