名校
1 . 以下元素及物质与人类的生产生活紧密相关。完成下列填空:
(1)氯元素的原子结构示意图_______ ;氯与钠元素组成的化合物的电子式_______ 。
(2)钠、铝、铁三种元素中,_______ 元素是地壳中含量最高的金属元素,其在元素周期表中位于第_______ 周期_______ 族。
(3)以下不是铝、铁的共性的是_______
(4)浓硫酸具有强氧化性,它能与铜反应的化学方程式为_______ 。
(5)列举一个可以说明氯和硫非金属性强弱的事实_______ 。
(1)氯元素的原子结构示意图
(2)钠、铝、铁三种元素中,
(3)以下不是铝、铁的共性的是_______
| A.导电性 | B.导热性 | C.延展性 | D.能与碱溶液反应 |
(5)列举一个可以说明氯和硫非金属性强弱的事实
您最近一年使用:0次
名校
解题方法
2 . 如表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
(1)地壳中含量最多的元素是____ 。
(2)氯元素位于元素周期表第____ 周期VIIA族。
(3)单质的化学性质最不活泼的是____ 。
(4)HF和HCl中,热稳定性较强的是____ 。
(5)元素最高价氧化物对应的水化物中,碱性最强的是____ (填化学式)。
(6)碳元素的最高价氧化物中碳元素与氧元素的质量比m(C):m(O)=____ 。
| 周期 族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
(2)氯元素位于元素周期表第
(3)单质的化学性质最不活泼的是
(4)HF和HCl中,热稳定性较强的是
(5)元素最高价氧化物对应的水化物中,碱性最强的是
(6)碳元素的最高价氧化物中碳元素与氧元素的质量比m(C):m(O)=
您最近一年使用:0次
3 . 面对新冠肺炎病毒可以采用的消毒剂常见的有“84”消毒液,医用酒精它们的有效成分分别是NaClO、 ,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
(1)以上涉及元素包含
(2) 是
是 分子中的氢原子的类型有
分子中的氢原子的类型有
(3)NaClO的电子式
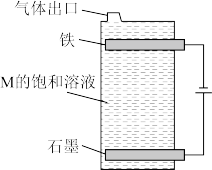
(4)①M的化学式
您最近一年使用:0次
名校
4 . 下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为_______ 。
(2)地壳中含量最多的金属元素是____ ,写出元素⑥的简单气态氢化物的化学式______ 。
(3)这些元素中的最高价氧化物对应的水化物中,碱性最强的是______ ,呈两性的氢氧化物是_______ 。
(4)写出②、③、⑤对应离子的离子半径由大到小的顺序是______ ,
(5)写出②、⑦、⑩对应阴离子还原性由强到弱的顺序是______ 。
(6)元素⑦与元素⑩相比,非金属性较强的是____ ,能证明这一事实的依据是_____ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ⑥ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑪ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)地壳中含量最多的金属元素是
(3)这些元素中的最高价氧化物对应的水化物中,碱性最强的是
(4)写出②、③、⑤对应离子的离子半径由大到小的顺序是
(5)写出②、⑦、⑩对应阴离子还原性由强到弱的顺序是
(6)元素⑦与元素⑩相比,非金属性较强的是
您最近一年使用:0次
名校
5 . 锶元素的粒子结构示意图和在元素周期表中显示的信息如图所示:
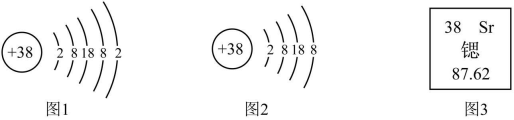
(1)锶属于___________ 元素(填“金属”或“非金属”)。
(2)锶元素的原子序数为___________ ,相对原子质量为___________ 。
(3)图2所表示的粒子的化学符号是___________ 。
(4)它与地壳中含量第一位的元素组成物质的化学式是___________ 。

(1)锶属于
(2)锶元素的原子序数为
(3)图2所表示的粒子的化学符号是
(4)它与地壳中含量第一位的元素组成物质的化学式是
您最近一年使用:0次
名校
解题方法
6 . 如图是元素周期表的一部分,按要求回答问题:
(1)元素④在周期表中位置是_______ 。元素③的最高价氧化物的化学式为________ 。
(2)元素①⑤组成化合物电子式为___________ 。
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为___ 。
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为_____ 。
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为_____ (用离子符号表示)。
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。
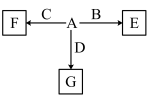
①A和F的化学式分别为_______ 、_______ 。
②B与G反应的化学方程式为____________________ 。
③C与NaOH溶液反应的离子方程式为______________ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)元素④在周期表中位置是
(2)元素①⑤组成化合物电子式为
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。

①A和F的化学式分别为
②B与G反应的化学方程式为
③C与NaOH溶液反应的离子方程式为
您最近一年使用:0次
2020-04-03更新
|
1034次组卷
|
5卷引用:山东省威海市文登区2019届高三上学期期中考试化学试题(A卷)
山东省威海市文登区2019届高三上学期期中考试化学试题(A卷)鲁科版(新)必修第二册第一章检测题湖北省应城市第一高级中学2019-2020学年高一下学期复学摸底测试化学试题山东省泰安市东平县高级中学2021届高三上学期第二次质量检测化学试题(已下线)第15练 第四章章末质量检测-2022年【寒假分层作业】高一化学(人教版2019)
7 . 如表是元素周期表的一部分,根据表中给出的10种元素,按要求使用化学用语填空作答:
(1)地壳中含量最高的元素是___ (填元素符号);金属性最强的元素是___ (填元素符号);单质的化学性质最不活泼的元素是___ (填元素符号)。
(2)最高价氧化物对应水化物酸性最强的是___ (填化合物化学式);最高价氧化物不溶于水,但既溶于稀硫酸又溶于氢氧化钠溶液的是___ (填化合物化学式)。
(3)烧焦羽毛味气体A和臭鸡蛋味气体B相遇可发生反应生成一种单质和水,该反应化学方程式为____ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | H | |||||||
| 2 | C | N | O | Ne | ||||
| 3 | Na | Al | P | S | Cl |
(2)最高价氧化物对应水化物酸性最强的是
(3)烧焦羽毛味气体A和臭鸡蛋味气体B相遇可发生反应生成一种单质和水,该反应化学方程式为
您最近一年使用:0次
2021-01-31更新
|
213次组卷
|
2卷引用:福建省福州市2020-2021学年高一上学期期末考试化学试题
2021高三·全国·专题练习
8 . (NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)是一种重要的化工原料,用途广泛。完成下列填空:
(1)铁在元素周期表的第ⅦB和第ⅠB之间。铁位于第___ 周期___ 族。
(2)写出Fe与水反应的化学方程式:___ 。
(3)将(NH4)2Fe(SO4)2中非金属元素的简单阴离子按半径由小到大的顺序排列:___ 。
(4)同温度同浓度的FeSO4和(NH4)2Fe(SO4)2溶液中,c(Fe2+)是否相等___ ?为什么?___ 。
(5)设计实验,证明(NH4)2Fe(SO4)2·6H2O晶体中含有Fe2+___ 。
(6)已知:(NH4)2Fe(SO4)2·6H2O在200℃失去全部结晶水。将一定质量的粉末状该晶体置于坩埚中,保持200℃受热,经冷却、恒重等正确操作,计算得到的1mol晶体中结晶水含量总是偏低,偏低的可能原因是___ (写一条即可)。
(1)铁在元素周期表的第ⅦB和第ⅠB之间。铁位于第
(2)写出Fe与水反应的化学方程式:
(3)将(NH4)2Fe(SO4)2中非金属元素的简单阴离子按半径由小到大的顺序排列:
(4)同温度同浓度的FeSO4和(NH4)2Fe(SO4)2溶液中,c(Fe2+)是否相等
(5)设计实验,证明(NH4)2Fe(SO4)2·6H2O晶体中含有Fe2+
(6)已知:(NH4)2Fe(SO4)2·6H2O在200℃失去全部结晶水。将一定质量的粉末状该晶体置于坩埚中,保持200℃受热,经冷却、恒重等正确操作,计算得到的1mol晶体中结晶水含量总是偏低,偏低的可能原因是
您最近一年使用:0次
20-21高一下·浙江·阶段练习
解题方法
9 . 按要求回答下列问题:
(1)异丁烷的结构简式为___________ 。
(2)地壳中含量最高的金属元素在元素周期表中的位置___________ 。
(3)NaOH的电子式为___________ 。
(4)二氧化氮溶于水时生成硝酸和一氧化氮,工业上利用这一原理生成硝酸。写出该反应的化学方程式___________ 。
(1)异丁烷的结构简式为
(2)地壳中含量最高的金属元素在元素周期表中的位置
(3)NaOH的电子式为
(4)二氧化氮溶于水时生成硝酸和一氧化氮,工业上利用这一原理生成硝酸。写出该反应的化学方程式
您最近一年使用:0次
名校
解题方法
10 . 表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
(1)单质化学性质最不活泼的是___ ;地壳中含量最多的元素是___ (填名称);
(2)单质常用作半导体材料的是___ ;Mg原子结构示意图为___ ;
(3)O和S中,原子半径较大的是;CH4和NH3中,热稳定性较强的是___ (填名称);
(4)新制氯水有漂白作用___ ,是因为其中含有___ (填“HCl”或“HClO”);
(5)元素最高价氧化物对应水化物中,碱性最强的是___ (填化学式),两性氢氧化物是___ ;
(6)某烃分子中含有6个碳原子,结构简式为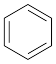 ,常用作有机溶剂。该有机物分子式为
,常用作有机溶剂。该有机物分子式为___ ,其中碳元素与氢元素的质量比m(C)∶m(H)=___ (相对原子质量:H-1 C-12)
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)单质常用作半导体材料的是
(3)O和S中,原子半径较大的是;CH4和NH3中,热稳定性较强的是
(4)新制氯水有漂白作用
(5)元素最高价氧化物对应水化物中,碱性最强的是
(6)某烃分子中含有6个碳原子,结构简式为
 ,常用作有机溶剂。该有机物分子式为
,常用作有机溶剂。该有机物分子式为
您最近一年使用:0次
2020-10-23更新
|
115次组卷
|
3卷引用:福建省莆田市仙游县枫亭中学2019-2020学年高二上学期期中考试化学试题



