名校
解题方法
1 . 表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
(1)单质化学性质最不活泼的是___ ;地壳中含量最多的元素是___ (填名称);
(2)单质常用作半导体材料的是___ ;Mg原子结构示意图为___ ;
(3)O和S中,原子半径较大的是;CH4和NH3中,热稳定性较强的是___ (填名称);
(4)新制氯水有漂白作用___ ,是因为其中含有___ (填“HCl”或“HClO”);
(5)元素最高价氧化物对应水化物中,碱性最强的是___ (填化学式),两性氢氧化物是___ ;
(6)某烃分子中含有6个碳原子,结构简式为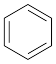 ,常用作有机溶剂。该有机物分子式为
,常用作有机溶剂。该有机物分子式为___ ,其中碳元素与氢元素的质量比m(C)∶m(H)=___ (相对原子质量:H-1 C-12)
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)单质常用作半导体材料的是
(3)O和S中,原子半径较大的是;CH4和NH3中,热稳定性较强的是
(4)新制氯水有漂白作用
(5)元素最高价氧化物对应水化物中,碱性最强的是
(6)某烃分子中含有6个碳原子,结构简式为
 ,常用作有机溶剂。该有机物分子式为
,常用作有机溶剂。该有机物分子式为
您最近一年使用:0次
2020-10-23更新
|
115次组卷
|
3卷引用:福建省莆田市仙游县枫亭中学2019-2020学年高二上学期期中考试化学试题
2 . 元素周期表在指导科学研究和生产实践方面具有十分重要的意义,请将下表中A、B两栏描述的内容对应起来。
| A | B | A | B |
| ①制半导体的元素 | (a)ⅣB至ⅥB的过渡元素 | ① | |
| ②制催化剂的元素 | (b)F、Cl、Br、N、S“三角地带” | ② | |
| ③制耐高温材料的元素 | (c)金属与非金属元素分界线附近 | ③ | |
| ④制制冷剂的元素 | (d)相对原子质量较小的元素 | ④ | |
| ⑤地壳中含量较多的元素 | (e)过渡元素 | ⑤ |
您最近一年使用:0次
名校
解题方法
3 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语 回答下列问题:
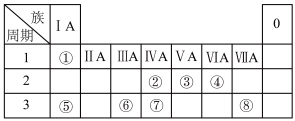
(1)④、⑤、⑥的离子半径由大到小 的顺序为_________ (用对应的离子符号表示)。
(2)②、③、⑦的最高价氧化物对应水化物 的酸性由强到弱 的顺序是______________ 。
(3)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,写出符合要求的化合物的电子式:______________ 。
(4)写出表中①~⑧元素中最高价氧化物对应水化物碱性最强的物质和自然界中含量最高的金属元素反应的离子方程式 :______________ 。

(1)④、⑤、⑥的
(2)②、③、⑦的
(3)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,写出符合要求的化合物的电子式:
(4)写出表中①~⑧元素中最高价氧化物对应水化物碱性最强的物质和自然界中含量最高的金属元素反应的
您最近一年使用:0次
名校
解题方法
4 . 在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
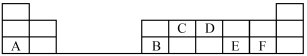
(1)金属性最强的元素是_______ ;
(2)画出D的原子结构示意图_______ ;
(3)地壳中含量最多的元素是_______ ;
(4)Ne原子的最外层电子数是_______ ;
(5)E和F分别形成的气态氢化物中最稳定的是_______ (填写氢化物的化学式)
(6)Mg(OH)2与Al(OH)3能与强碱反应的是_______ ;
(7)用于制造光导纤维的物质是_______ (填“Si”或“SiO2”);
(8)肼(N2H4)中氮元素和氢元素的质量比m(N):m(H)=_______ ;(相对原子质量:N-14,H-1)
(9)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为_______ ,HClO不稳定,易分解生成HCl和O2,写出其在光照条件下分解的化学方程式:_______ 。

(1)金属性最强的元素是
(2)画出D的原子结构示意图
(3)地壳中含量最多的元素是
(4)Ne原子的最外层电子数是
(5)E和F分别形成的气态氢化物中最稳定的是
(6)Mg(OH)2与Al(OH)3能与强碱反应的是
(7)用于制造光导纤维的物质是
(8)肼(N2H4)中氮元素和氢元素的质量比m(N):m(H)=
(9)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为
您最近一年使用:0次
名校
5 . 针对下面11种元素,完成以下各小题。
(1)地壳中含量最多的元素是________ (填元素符号)
(2)化学性质最不活泼的元素是___________ (填名称)
(3)Cl的离子结构示意图为_____________
(4)C与N相比,原子半径较小的是_______ (填元素名称)
(5)最高价氧化物对应的水化物碱性最强的是___________ (填化学式)
(6)MgO和 中,属于两性氧化物的是
中,属于两性氧化物的是_________________
(7)P、S、Cl的最高价氧化物对应水化物酸性最强的是___________ (填物质名称)
(8)可用来制造计算机芯片的物质是______ ,晶体硅的主要用途是___________ (写出一种)。
(9)在S与Cl的单质中,化学性质较活泼的单质是______________ (填化学式)可用什么化学反应说明该事实(写出反应的化学方程式):______________ 。
| 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | P | S | Cl |
(1)地壳中含量最多的元素是
(2)化学性质最不活泼的元素是
(3)Cl的离子结构示意图为
(4)C与N相比,原子半径较小的是
(5)最高价氧化物对应的水化物碱性最强的是
(6)MgO和
 中,属于两性氧化物的是
中,属于两性氧化物的是(7)P、S、Cl的最高价氧化物对应水化物酸性最强的是
(8)可用来制造计算机芯片的物质是
(9)在S与Cl的单质中,化学性质较活泼的单质是
您最近一年使用:0次
6 . 以氮化镓(GaN)、碳化硅、金刚石等为代表的第三代半导体材料具有高发光效率、抗腐蚀、化学稳定性好、高强度等特性,是目前最先进的半导体材料。完成下列填空:
(1)组成上述三种半导体材料的各种元素中,原子半径最小的元素在周期表中的位置是_______ 。原子序数最小的元素原子的核外电子排布式是___________ 。
(2)镓元素的相对原子质量为69.72,自然界中的镓共有两种稳定的同位素,其中69Ga的原子个数百分含量为60.1%,则另一种镓的同位素可表示为______ 。
(3)镓、铝为同族元素,性质相似。下表是两种两性氢氧化物的电离常数。
①写出氢氧化镓的电离方程式:______________ 。
②将一块镓铝合金完全溶于烧碱溶液,再往反应后的溶液中缓缓通入CO2,最先析出的氢氧化物是___________ 。
(4)碳化硅单晶是目前技术最成熟的第三代半导体材料。下列能说明碳的非金属性强于硅的反应(或反应组)是_____ (选填编号)
a.SiO32- + 2CO2 + 2H2O → H2SiO3 + 2HCO3—
b.SiO2 + 2C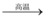 Si + 2CO↑
Si + 2CO↑
c.SiH4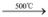 Si + 2H2;CH4
Si + 2H2;CH4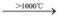 C + 2H2
C + 2H2
d.Si + O2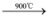 SiO2;C + O2
SiO2;C + O2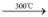 CO2
CO2
(1)组成上述三种半导体材料的各种元素中,原子半径最小的元素在周期表中的位置是
(2)镓元素的相对原子质量为69.72,自然界中的镓共有两种稳定的同位素,其中69Ga的原子个数百分含量为60.1%,则另一种镓的同位素可表示为
(3)镓、铝为同族元素,性质相似。下表是两种两性氢氧化物的电离常数。
| 两性氢氧化物 | Al(OH)3 | Ga(OH)3 |
| 酸式电离常数Kia | 2×10-11 | 1×10-7 |
| 碱式电离常数Kib | 1.3×10-33 | 1.4×10-34 |
①写出氢氧化镓的电离方程式:
②将一块镓铝合金完全溶于烧碱溶液,再往反应后的溶液中缓缓通入CO2,最先析出的氢氧化物是
(4)碳化硅单晶是目前技术最成熟的第三代半导体材料。下列能说明碳的非金属性强于硅的反应(或反应组)是
a.SiO32- + 2CO2 + 2H2O → H2SiO3 + 2HCO3—
b.SiO2 + 2C
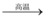 Si + 2CO↑
Si + 2CO↑c.SiH4
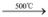 Si + 2H2;CH4
Si + 2H2;CH4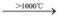 C + 2H2
C + 2H2d.Si + O2
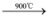 SiO2;C + O2
SiO2;C + O2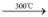 CO2
CO2
您最近一年使用:0次
名校
解题方法
7 . 铝是地壳中含量最多的金属元素,铝及其化合物在日常生活、工业上有广泛的应用。
(1)铝原子核外有_________ 种不同运动状态的电子,有_________ 种能量不同的电子,写出铝在元素周期表中的位置:________
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是________ 晶体,试比较组成该物质的两微粒半径大小:_______
(3)可用铝和氧化钡反应可制备金属钡:4BaO+2Al BaO·Al2O3+3Ba↑的主要原因是
BaO·Al2O3+3Ba↑的主要原因是_______ (选填编号)。
a.Al活泼性大于Ba b.Ba沸点比Al的低 c.BaO·Al2O3比Al2O3稳定
(4)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是_________ (选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(5)描述工业上不用电解氯化铝而是用电解氧化铝的方法获得铝单质的原因:_______
(1)铝原子核外有
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是
(3)可用铝和氧化钡反应可制备金属钡:4BaO+2Al
 BaO·Al2O3+3Ba↑的主要原因是
BaO·Al2O3+3Ba↑的主要原因是a.Al活泼性大于Ba b.Ba沸点比Al的低 c.BaO·Al2O3比Al2O3稳定
(4)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(5)描述工业上不用电解氯化铝而是用电解氧化铝的方法获得铝单质的原因:
您最近一年使用:0次
名校
8 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
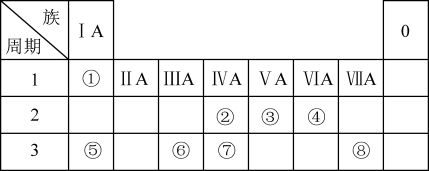
(1)地壳中含量居于第二位的元素在周期表中的位置是________________ 。
除稀有气体外,原子半径最大的元素是______ ,它的原子结构示意图是________ 。
(2)②的最高价氧化物的分子式为________ ;
⑦的最高价氧化物对应水化物的分子式为________ ;
最高价氧化物对应的水化物中酸性最强的是________ 。
(3)①④⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:________________________________ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是________ 。
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b与a所有可能的关系式为________________ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
除稀有气体外,原子半径最大的元素是
(2)②的最高价氧化物的分子式为
⑦的最高价氧化物对应水化物的分子式为
最高价氧化物对应的水化物中酸性最强的是
(3)①④⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
9 . 碳及其化合物在生产、生活中有广泛的用途。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为____________ ,R的电子式为______________ ;
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为_____________ ,除去粗产品中少量钠的试剂为______________ ;
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为____________________ ,硅酸盐的物质的量浓度为____________ 。
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:
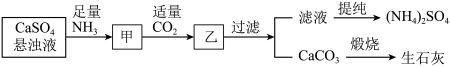
(1)向甲中通入过量CO2__________ (填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_________________ 。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是____________ (填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为___________________________ ;
②请分析CaSO4转化为CaCO3的原理:___________________________ 。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:

(1)向甲中通入过量CO2
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为
②请分析CaSO4转化为CaCO3的原理:
您最近一年使用:0次
名校
10 . 据南方日报报道,广东省珠江第二大水系北江流域因当地矿业的开发,造成附近河底沉积物中铊含量严重超标,致使当地人“靠江不饮北江水”。铊(Tl)是某超导体材料的组成元素之一,Tl3+与Ag在酸性介质中发生反应Tl3++2Ag=Tl++2Ag+。
(1)铊(Tl)的原子序数为81,铊在元素周期表中位于第____ 周期第______ 族。
(2)铊与下列某种元素位于同一主族,该元素是________ 。
A. 硼 B. 氮 C. 碳 D. 氟
(3)下列推断正确的是______ (填序号)。
A. 单质的还原性:Tl>Al B. 原子半径:Al>Tl C. 碱性:Al(OH)3>Tl(OH)3
D. 氧化性:Tl3+>Ag+E. Tl+最外层只有1个电子 F. Tl能形成+3价和+1价的化合物
(4)X元素是与铝属于对角线关系的第二周期元素,二者的单质化学性质相似。X单质与浓NaOH溶液反应的化学方程式是________ 。
(1)铊(Tl)的原子序数为81,铊在元素周期表中位于第
(2)铊与下列某种元素位于同一主族,该元素是
A. 硼 B. 氮 C. 碳 D. 氟
(3)下列推断正确的是
A. 单质的还原性:Tl>Al B. 原子半径:Al>Tl C. 碱性:Al(OH)3>Tl(OH)3
D. 氧化性:Tl3+>Ag+E. Tl+最外层只有1个电子 F. Tl能形成+3价和+1价的化合物
(4)X元素是与铝属于对角线关系的第二周期元素,二者的单质化学性质相似。X单质与浓NaOH溶液反应的化学方程式是
您最近一年使用:0次



