1 . 结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界______ 。

(2)表中所列元素,属于短周期元素的有______ ,属于主族元素的有______ ;g元素位于第______ 周期______ 族;i元素位于第______ 周期______ 族。
(3)元素f是第______ 周期______ 族元素,请在下边方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量______ 。

(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界

(2)表中所列元素,属于短周期元素的有
(3)元素f是第

您最近一年使用:0次
2021-02-20更新
|
725次组卷
|
4卷引用:专题4.1.2 元素周期表(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)
(已下线)专题4.1.2 元素周期表(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(鲁科版2019)必修第二册 第1章 原子结构 元素周期律 第2节 元素周期律和元素周期表 第2课时 元素周期表云南省玉溪市峨山彝族自治县第一中学2021-2022学年高一下学期3月月考化学试题云南省澄江市第一中学2021-2022学年高一下学期开学考试化学试题
名校
2 . 下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
(1)11种元素中,化学性质最不活泼的是__________ ,原子半径最小的是_________ 。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是___________ 。
(3)②③④中形成的简单离子半径由大到小的顺序是_________________ 。
(4)元素⑦的氢化物电子式为_______ ,该氢化物常温下和元素②的单质反应的离子方程式是________________ 。
(5)①和⑨的最高价氧化物对应的水化物化学式为__________ 和__________ 。①和⑨两元素形成化合物中化学键的类型为____________ ,该化合物灼烧时焰色为_________ ,该化合物的溶液与元素⑧的单质反应的离子方程式为__________________ 。
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为___________ 。
(7)⑧⑨⑪三种元素形成的气态氢化物最稳定的是_______ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)11种元素中,化学性质最不活泼的是
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是
(3)②③④中形成的简单离子半径由大到小的顺序是
(4)元素⑦的氢化物电子式为
(5)①和⑨的最高价氧化物对应的水化物化学式为
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为
(7)⑧⑨⑪三种元素形成的气态氢化物最稳定的是
您最近一年使用:0次
2021-01-20更新
|
1811次组卷
|
6卷引用:专题07 物质结构与元素周期律-备战2021届高考化学二轮复习题型专练
(已下线)专题07 物质结构与元素周期律-备战2021届高考化学二轮复习题型专练(已下线)专题17 化学键(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练新疆哈密市第八中学2019-2020学年高一下学期期中考试化学试题河南省新蔡县第一高级中学2020-2021学年高一下学期5月月考化学试题甘肃省金昌市第一中学2020-2021学年高一下学期期中考试化学(理)试题福建省政和县第二中学2022-2023学年高一下学期第一次月考化学试题
2020高三·全国·专题练习
解题方法
3 . (1)N的基态原子核外电子排布式为__________ ;Cu的基态原子最外层有____ 个电子。
(2)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。基态Ni原子的电子排布式为___________ ,该元素位于元素周期表中的第____ 族。
(3)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____ 形象化描述。在基态14C原子中,核外存在____ 对自旋相反的电子。
(4)钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。钒在元素周期表中的位置为____ ,其价层电子排布图为____ 。
(5)基态硼原子的电子排布式为____________ 。
(2)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。基态Ni原子的电子排布式为
(3)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(4)钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。钒在元素周期表中的位置为
(5)基态硼原子的电子排布式为
您最近一年使用:0次
解题方法
4 . 下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
(1)金属性最强的元素是____________  填元素符号
填元素符号 。
。
(2)最不活泼元素的原子结构示意图为___________ 。
(3)第3周期元素中,其最高价氧化物对应的水化物具有两性的元素是__________  填元素名称
填元素名称 。
。
(4)Na、Mg两种元素中,原子半径较大的是__________ 。
(5)第3周期元素中,其元素的一种氧化物是形成酸雨的主要物质,该氧化物的化学式为___________ 。
(6)Na极易与水反应,该反应的化学方程式为____________ 。
(7)HF与HCl热稳定性较强的是_________ 。
(8)由碳与氢元素形成的最简单有机物的化学式为________ ,该物质中碳元素与氢元素的质量比为____________ ,其分子空间构型为____________ 。
(9)重氢( )和超重氢(
)和超重氢(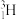 )两种核素都可用作制造氢弹的原料,它们所含中子数之比为
)两种核素都可用作制造氢弹的原料,它们所含中子数之比为___________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | H | |||||||
2 | C | N | F | Ne | ||||
3 | Na | Mg | Al | S | Cl |
(1)金属性最强的元素是
 填元素符号
填元素符号 。
。 (2)最不活泼元素的原子结构示意图为
(3)第3周期元素中,其最高价氧化物对应的水化物具有两性的元素是
 填元素名称
填元素名称 。
。 (4)Na、Mg两种元素中,原子半径较大的是
(5)第3周期元素中,其元素的一种氧化物是形成酸雨的主要物质,该氧化物的化学式为
(6)Na极易与水反应,该反应的化学方程式为
(7)HF与HCl热稳定性较强的是
(8)由碳与氢元素形成的最简单有机物的化学式为
(9)重氢(
 )和超重氢(
)和超重氢(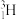 )两种核素都可用作制造氢弹的原料,它们所含中子数之比为
)两种核素都可用作制造氢弹的原料,它们所含中子数之比为
您最近一年使用:0次
名校
解题方法
5 . 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取硒。
(1)硒在元素周期表中的位置如图所示:
Se
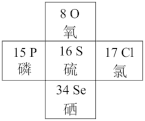
①Se在元素周期表中位置表示为________ ,H2Se的电子式为________________
②从原子结构角度解释硫与硒元素性质相似与不同的原因:同一主族______________ 。
(2)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
ⅰ.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ⅱ.用水吸收ⅰ中混合气体,可得Se固体
①请写出C与浓H2SO4反应的化学方程式________________ 。
②焙烧过程产生的烟气中含有少量SeO2的,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为________________ 。
③ 写出步骤ⅱ中的化学方程式________________ 。
(3)下列说法合理的是________________ 。
a.SeO2既有氧化性又有还原性 b.原子半径由大到小顺序:Se>Br>Cl
c.热稳定性:H2Se<HCl<H2S d.酸性:HeSeO4<HbrO4<HClO4
(1)硒在元素周期表中的位置如图所示:
Se
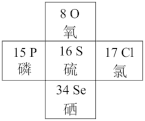
①Se在元素周期表中位置表示为
②从原子结构角度解释硫与硒元素性质相似与不同的原因:同一主族
(2)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
ⅰ.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ⅱ.用水吸收ⅰ中混合气体,可得Se固体
①请写出C与浓H2SO4反应的化学方程式
②焙烧过程产生的烟气中含有少量SeO2的,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为
③ 写出步骤ⅱ中的化学方程式
(3)下列说法合理的是
a.SeO2既有氧化性又有还原性 b.原子半径由大到小顺序:Se>Br>Cl
c.热稳定性:H2Se<HCl<H2S d.酸性:HeSeO4<HbrO4<HClO4
您最近一年使用:0次
2020-10-12更新
|
369次组卷
|
3卷引用:第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷
(已下线)第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷北京市人大附中2021届高三10月月考化学试题北京市第一七一中学2021届高三上学期10月月考化学试题
13-14高一·全国·课时练习
名校
解题方法
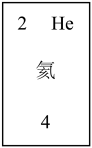
6 . 结合元素周期表回答下列问题:
(1)下图中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界___________ 。

(2)周期表中所列元素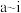 ,属于短周期元素的有
,属于短周期元素的有__________ 种,属于主族元素的有__________ 种;g元素位于第__________ 周期第__________ 族;i元素位于第__________ 周期第__________ 族。
(3)f元素位于第__________ 周期第__________ 族,原子结构示意图为__________ 请在下图方框中按氦元素的式样写出该元素的原子序数,元素符号、元素名称、相对原子质量__________ 。

(1)下图中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界

(2)周期表中所列元素
 ,属于短周期元素的有
,属于短周期元素的有(3)f元素位于第


您最近一年使用:0次
2020-10-02更新
|
581次组卷
|
13卷引用:第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷
(已下线)第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)2014学年高一化学人教版必修2 1.1.1元素周期表练习卷山东峨山一中2018年3月高一月考(化学试卷)峨山县第一中学2017-2018学年第二学期3月份月考卷(高二化学)2017-2018学年鲁科版高一化学必修二第一章第二节基础题2019—2020学年人教版必修2第一章 第一节《元素周期表》第1课时 《元素周期表》(跟踪训练)苏教版高一化学必修2专题一第一单元第三课时《元素周期表》课时训练(夯实基础)河北深州市长江中学2019-2020学年高一下学期第一次月考化学试题(已下线)4.1.1 原子结构 元素周期表 核素练习(2)——《高中新教材同步备课》(人教版 必修第一册)人教版(2019)高一必修第一册 第四章 物质结构 元素周期律 第一节 原子结构与元素周期表 教材帮广东省东莞市光明中学2020-2021学年高二上学期期初考试化学试题(已下线)4.1.2 元素周期表(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)4.1.2 元素周期表-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)
名校
解题方法
7 . I.2019 年是元素周期表发表 150 周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等 9 种元素相对原子质量的新值,被采用为国际新标准。
(1)In在周期表中的位置是_____________________ 。
(2)In的最高价氧化物的水化物的碱性______________ Ba(OH)2的碱性(填“>”或“<”)。
(3)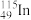 的中子数与电子数的差值为
的中子数与电子数的差值为_________________ 。
II.A+、B2-、C-、D、E、F3+分别表示含 10 个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式:_________________ 。
(5)A+、B2-、F3+离子半径由大到小的顺序为____________ (用离子符号表示)。
(6)电子式表示 A2B 的形成过程_______________________ 。
(7)含 F3+的溶液中通入过量D,反应的离子方程式是_______________ 。
(8)A 单质与 E 反应的离子方程式为_______________ ,生成的化合物中化学键的类型是____________________ 。
(1)In在周期表中的位置是
(2)In的最高价氧化物的水化物的碱性
(3)
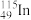 的中子数与电子数的差值为
的中子数与电子数的差值为II.A+、B2-、C-、D、E、F3+分别表示含 10 个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式:
(5)A+、B2-、F3+离子半径由大到小的顺序为
(6)电子式表示 A2B 的形成过程
(7)含 F3+的溶液中通入过量D,反应的离子方程式是
(8)A 单质与 E 反应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
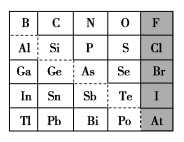
(1)元素 在元素周期表中的位置为第
在元素周期表中的位置为第______ 周期第______ 族。
(2) 的最高化合价为
的最高化合价为______ , 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为______ , 的最高价氧化物为
的最高价氧化物为______ 。
(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是______ 元素(填元素符号)。
②酸性:
______ (填“>”“<”或“=”,下同) 。
。
③氢化物的还原性:
______  。
。
④原子半径:
______  。
。
(4)可在图中分界线(虚线)附近寻找______ (填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较 、
、 的非金属性强弱:
的非金属性强弱:______ 。(可供选择的药品有 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)

(1)元素
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)
 的最高化合价为
的最高化合价为 的最高价氧化物对应的水化物的化学式为
的最高价氧化物对应的水化物的化学式为 的最高价氧化物为
的最高价氧化物为(3)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是
②酸性:

 。
。③氢化物的还原性:

 。
。④原子半径:

 。
。(4)可在图中分界线(虚线)附近寻找
A.优良的催化剂 B.半导体材料 C.合金材料
(5)从下列试剂中选择最佳试剂组合,比较
 、
、 的非金属性强弱:
的非金属性强弱: 固体、稀硫酸、盐酸、饱和
固体、稀硫酸、盐酸、饱和 溶液、饱和
溶液、饱和 溶液、硅酸钠溶液)
溶液、硅酸钠溶液)
您最近一年使用:0次
2020-09-08更新
|
1584次组卷
|
6卷引用:人教版(2019)高一必修第一册 全书综合训练(一)
名校
解题方法
9 . 下表是元素周期表前三周期,针对表中的①~⑧元素,回答下列问题:
(1)元素④在周期表中的位置是________ 。
(2)在这些元素原子中,得电子能力最强的是______ (填元素符号)。
(3)单质化学性质最不活泼的元素是______ (填元素符号),元素②原子结构示意图为______ 。
(4)元素⑥、⑦形成的氢化物中,沸点高的是______ (填化学式)。
(5)元素①的最高价氧化物对应的水化物所含化学键的类型是_______ 。
(6)元素⑤最简单的氢化物和最高价氧化物对应的水化物相互反应的产物是_______ 。
(7)写出元素③的单质与稀盐酸反应的离子方程式_______ 。
⑤ | ⑥ | ||||||||||||||||
① | ② | ③ | ④ | ⑦ | ⑧ | ||||||||||||
(2)在这些元素原子中,得电子能力最强的是
(3)单质化学性质最不活泼的元素是
(4)元素⑥、⑦形成的氢化物中,沸点高的是
(5)元素①的最高价氧化物对应的水化物所含化学键的类型是
(6)元素⑤最简单的氢化物和最高价氧化物对应的水化物相互反应的产物是
(7)写出元素③的单质与稀盐酸反应的离子方程式
您最近一年使用:0次
2020-08-12更新
|
175次组卷
|
2卷引用:2024届高考化学考点剖析精创专题卷——专题七 物质结构 元素周期律
名校
10 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
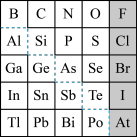
(1)根据元素周期律,推断:
①H3AsO4、H2SeO4的酸性强弱:H3AsO4___ H2SeO4(填“>”、“<”或“=”)。
②氢化物的还原性:H2O___ H2S(填“>”、“<”或“=”)。
(2)可在图中分界线(虚线部分)附近寻找___ (填序号)。
A.优良的催化剂B.半导体材料C.合金材料D.农药
(3)①Se2Cl2常用作分析试剂,其电子式为___ 。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___ (填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(4)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。

(1)根据元素周期律,推断:
①H3AsO4、H2SeO4的酸性强弱:H3AsO4
②氢化物的还原性:H2O
(2)可在图中分界线(虚线部分)附近寻找
A.优良的催化剂B.半导体材料C.合金材料D.农药
(3)①Se2Cl2常用作分析试剂,其电子式为
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(4)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
| 实验步骤 | 实验现象与结论 |
| 在试管中加入 | 现象: |
您最近一年使用:0次



