解题方法
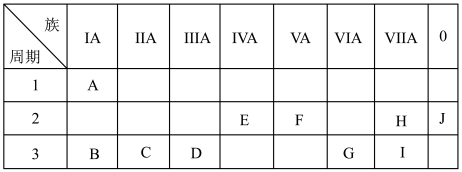
1 . 如图是元素周期表中的一部分。
(1)化学性质最不活泼的元素是_________ ,氧化性最强的单质是__________ 。
(2)最高价氧化物对应的水化物中,碱性最强的是_________ ,呈两性的是_________ 。
(3)在B、C、D、G、I中,原子半径最大的是_________ ,它们的离子半径最大是_________ (填离子符号)。
(4)B的最高价氧化物的水化物与G的最高价氧化物的水化物反应的化学方程式为___________________ 。
(1)化学性质最不活泼的元素是
(2)最高价氧化物对应的水化物中,碱性最强的是
(3)在B、C、D、G、I中,原子半径最大的是
(4)B的最高价氧化物的水化物与G的最高价氧化物的水化物反应的化学方程式为
您最近一年使用:0次
解题方法
2 . 已知A、B、C、D、E、F为短周期元素,其中C的原子序数最小,它们的最高正价与原子半径关系如图所示。
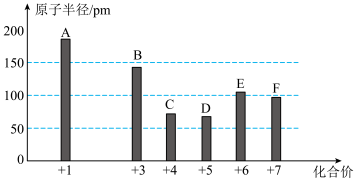
请回答下列问题:
(1)B元素在周期表中的位置为__________ ;D元素能与氢元素组成18电子分子,该分子含有的共价键类型为__________ (填“极性键”或“非极性键”)。
(2)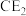 属于严禁携带的易燃易爆液体,其电子式为
属于严禁携带的易燃易爆液体,其电子式为__________ ;A、E、F三种元素形成的简单离子,半径由大到小的顺序是__________ (用离子符号表示)。
(3)写出元素A、B的最高价氧化物的水化物相互反应的离子方程式__________ 。
(4)用C元素的最简单氢化物和 在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的
在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的__________ 极,若线路中转移2mol电子,则消耗的 在标准状况下的体积为
在标准状况下的体积为__________ 。
(5)化合物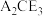 在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向
在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向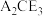 溶液中滴加酸性
溶液中滴加酸性 溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式
溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式__________ 。

请回答下列问题:
(1)B元素在周期表中的位置为
(2)
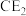 属于严禁携带的易燃易爆液体,其电子式为
属于严禁携带的易燃易爆液体,其电子式为(3)写出元素A、B的最高价氧化物的水化物相互反应的离子方程式
(4)用C元素的最简单氢化物和
 在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的
在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的 在标准状况下的体积为
在标准状况下的体积为(5)化合物
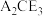 在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向
在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向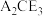 溶液中滴加酸性
溶液中滴加酸性 溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式
溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式
您最近一年使用:0次
名校
3 . 如图是元素周期表的一部分,请回答下列问题:

(1)元素④、⑤、⑥的原子半径由大到小的顺序为___________ (用元素符号表示)。
(2)元素②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________ (用化学式表示)。
(3)元素①、④、⑤三种元素可形成既含离子键又含极性共价键的化合物,该化合物的电子式为:___________ 。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为___________ 。由N产生⑥的单质的化学反应方程式为 ___________ 。

(1)元素④、⑤、⑥的原子半径由大到小的顺序为
(2)元素②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)元素①、④、⑤三种元素可形成既含离子键又含极性共价键的化合物,该化合物的电子式为:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
您最近一年使用:0次
名校
4 . 电气石是一种具有保健作用的天然石材,其中含有的主要元素为 等元素。
等元素。
(1)上述元素中,原子半径最小的是_______ (用元素符号表示),与硫同周期的元素中简单离子半径最小的是_______ (用离子符号表示);
(2)用轨道表示式表示氧元素原子核外电子的运动状态_______ ;氧元素原子核外有_______ 种不同能量的电子;
(3) 分子中
分子中 为
为_______ 杂化,键角等于_______ ,可以判断出 分子为
分子为_______ 分子(选填“极性”或“非极性”); 晶体的熔点比
晶体的熔点比 晶体
晶体_______ (选填“高”、“低”),原因为_______ 。
 等元素。
等元素。(1)上述元素中,原子半径最小的是
(2)用轨道表示式表示氧元素原子核外电子的运动状态
(3)
 分子中
分子中 为
为 分子为
分子为 晶体的熔点比
晶体的熔点比 晶体
晶体
您最近一年使用:0次
名校
5 . 下表为元素周期表的一部分,请根据所学知识回答下列问题:

(1)写出J在周期表中的位置___________ 。
(2)B、D、E的简单离子半径由大到小的顺序是___________ (填离子符号)。
(3)上述元素的原子中,写出未成对电子数最多的元素基态原子的核外电子排布式:___________ 。
(4)上述7种元素中金属性最强的元素与B可形成原子个数比为1:1的化合物甲,则甲的电子式为___________ 。
(5)判断B和D的非金属性强弱,并从结构角度说明原因:___________ 。

(1)写出J在周期表中的位置
(2)B、D、E的简单离子半径由大到小的顺序是
(3)上述元素的原子中,写出未成对电子数最多的元素基态原子的核外电子排布式:
(4)上述7种元素中金属性最强的元素与B可形成原子个数比为1:1的化合物甲,则甲的电子式为
(5)判断B和D的非金属性强弱,并从结构角度说明原因:
您最近一年使用:0次
2023高三·全国·专题练习
6 . 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是_______ 。根据对角线规则,B的一些化学性质与元素_______ 的相似。
(2)NH3BH3分子中,N—B化学键称为_______ 键,其电子对由_______ 提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH +B3O
+B3O +9H2。B3O
+9H2。B3O 的结构为
的结构为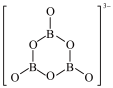 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由_______ 变为_______ 。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是_______ 。
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
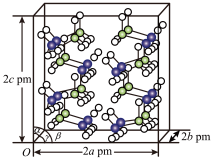
氨硼烷晶体的密度ρ=_______ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)H、B、N中,原子半径最大的是
(2)NH3BH3分子中,N—B化学键称为
 +B3O
+B3O +9H2。B3O
+9H2。B3O 的结构为
的结构为 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。

氨硼烷晶体的密度ρ=
您最近一年使用:0次
7 . 如表是部分短周期元素的性质或原子结构特点。
请回答下列问题:
(1)基态T原子的价电子排布式为_______
(2)比较Y元素,W元素的离子半径_______ (用离子符号表示)
(3)元素Z在元素周期表中的位置是_______ ,元素Z与元素T相比,非金属性较强的是_______ (用元素符号表示)。下列表述中能证明这一事实的是_______ (填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z元素的简单气态氢化物比T元素的稳定
c.Z的最高价氧化物对应水化物的酸性比T的强
(4)T、X、Y、Z四种元素的最高价氧化物对应水化物中性质明显不同于其他三种的是_______ (填化学式)
(5)W的最高价氧化物对应水化物与NaOH溶液反应的离子方程式为_______ 。
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其最高价氧化物对应水化物既能跟酸反应,又能跟强碱反应 |
(1)基态T原子的价电子排布式为
(2)比较Y元素,W元素的离子半径
(3)元素Z在元素周期表中的位置是
a.常温下Z的单质和T的单质状态不同
b.Z元素的简单气态氢化物比T元素的稳定
c.Z的最高价氧化物对应水化物的酸性比T的强
(4)T、X、Y、Z四种元素的最高价氧化物对应水化物中性质明显不同于其他三种的是
(5)W的最高价氧化物对应水化物与NaOH溶液反应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,其中W原子的质子数是其M层电子数的三倍。回答下列问题:
(1)Y元素在元素周期表中的位置为_______ 。X、Y、W三种元素原子半径由大到小的顺序为_______ (用元素符号表示)。
(2)X、Q可形成一种化合物,该化合物中两元素最外层均满足8电子稳定结构,写出该化合物的电子式:_______ 。
(3)X、W、Q的最高价氧化物对应水化物的酸性由强到弱的顺序为_______ (用化学式表示)。
(4)写出工业制取Z的化学方程式:_______ 。
(5)W、Q形成的一种化合物可以发生水解反应,并且水解生成一种最高价含氧酸和一种无氧酸,写出该水解反应的化学方程式:_______ 。
| X | Y | |||
| Z | W | Q |
(2)X、Q可形成一种化合物,该化合物中两元素最外层均满足8电子稳定结构,写出该化合物的电子式:
(3)X、W、Q的最高价氧化物对应水化物的酸性由强到弱的顺序为
(4)写出工业制取Z的化学方程式:
(5)W、Q形成的一种化合物可以发生水解反应,并且水解生成一种最高价含氧酸和一种无氧酸,写出该水解反应的化学方程式:
您最近一年使用:0次
2022-10-28更新
|
97次组卷
|
2卷引用:河南省安阳市2022-2023学年高三上学期第一次联考(二)全国卷化学试题
9 . 下表列出了A—H八种元素在元素周期表中的相对位置:
(1)请写出下列元素符号:E___________ ,G___________ ;在这八种元素中,化学性质最不活泼的是___________ 。(填写元素符号)
(2)A、B、C三种元素按原子半径由大到小的顺序排列为___________ 。(填写元素符号)
(3)F元素氢化物的化学式是___________ ,该氢化物在常温下跟B发生反应的化学方程式是___________ ,所得溶液的PH___________ 7.
(4)G元素跟A元素形成化合物为___________ ,高温下灼烧该化合物时,火焰呈___________ 色。
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | F | ||||||
| 3 | A | C | D | G | H | |||
| 4 | B |
(2)A、B、C三种元素按原子半径由大到小的顺序排列为
(3)F元素氢化物的化学式是
(4)G元素跟A元素形成化合物为
您最近一年使用:0次
名校
10 . 元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列,得到如图所示的“蜗牛元素周期表”,图中每个圆圈代表一种元素,其中①代表氢元素。请回答下列问题:

(1)⑨在元素周期表中的位置为_______ 。
(2)④⑤⑦的离子半径由大到小的顺序为_______ 。
(3)③⑨⑩的最高价氧化物对应水化物的酸性由强到弱的顺序是_______ (填化学式)。
(4)用电子式表示由⑦和①组成的化合物的形成过程:_______ 。
(5)实验室制取④的简单氢化物的化学方程式为_______ 。
(6)可以验证⑦、⑧两元素金属性强弱的实验是_______(填字母)。

(1)⑨在元素周期表中的位置为
(2)④⑤⑦的离子半径由大到小的顺序为
(3)③⑨⑩的最高价氧化物对应水化物的酸性由强到弱的顺序是
(4)用电子式表示由⑦和①组成的化合物的形成过程:
(5)实验室制取④的简单氢化物的化学方程式为
(6)可以验证⑦、⑧两元素金属性强弱的实验是_______(填字母)。
| A.比较⑦、⑧两种元素的单质的硬度及熔点 |
| B.将除去氧化物薄膜的⑦、⑧的单质分别和热水作用,并滴入酚酞溶液 |
| C.将除去氧化物薄膜的⑦、⑧的单质分别和2mL1 mol∙L−1的盐酸反应 |
| D.比较⑦、⑧两种元素的最高价氧化物对应水化物的溶解性 |
您最近一年使用:0次



