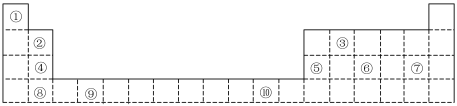
1 . 元素周期表是学习和研究化学科学的主要工具。下表是元素周期表的一部分,按要求作答。
(1)元素a位于周期表中第___________ 周期___________ 族。
(2)元素b属于___________ (填“金属”或“非金属”)元素,它的最高化合价是___________ 。
(3)碳的原子结构示意图为___________ 。
(4)地壳中含量最多的元素是___________ 。
(5)O与S中,原子半径较大的是___________ 。
(6) 与
与 中,热稳定性较弱的是
中,热稳定性较弱的是___________ 。
(7) 与
与 中,酸性较弱的是
中,酸性较弱的是___________ 。
(8)LiOH、 和KOH中,碱性最强的是
和KOH中,碱性最强的是___________ ,呈两性的是___________ 。
(9)元素Ca和Cl形成化合物的化学式是___________ ,化学键类型是___________ 。
(10)元素硒(Se)与硫位于同一主族,预测硒及其化合物具有的性质___________(填标号)。
族 周期 |  A A |  A A |  A A |  A A | 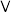 A A |  A A | 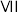 A A |
| 2 | Li | C | O | a | |||
| 3 | b | Al | Si | P | S | Cl | |
| 4 | K | Ca |
(2)元素b属于
(3)碳的原子结构示意图为
(4)地壳中含量最多的元素是
(5)O与S中,原子半径较大的是
(6)
 与
与 中,热稳定性较弱的是
中,热稳定性较弱的是(7)
 与
与 中,酸性较弱的是
中,酸性较弱的是(8)LiOH、
 和KOH中,碱性最强的是
和KOH中,碱性最强的是(9)元素Ca和Cl形成化合物的化学式是
(10)元素硒(Se)与硫位于同一主族,预测硒及其化合物具有的性质___________(填标号)。
A. 只具有氧化性 只具有氧化性 | B.Se的非金属性比S强 |
| C.其单质在常温下呈气态 | D.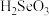 能与NaOH溶液发生反应 能与NaOH溶液发生反应 |
您最近一年使用:0次
解题方法
2 . 下表为元素周期表的一部分,其中的编号对应的元素。
(1)表中有___________ 种金属元素,其中属于ds区元素的是___________ (填元素符号)。
(2)表中元素⑥原子的最外电子层上未成对电子数为___________ 个。
(3)元素④的第一电离能___________ 元素⑤的第一电离能(填“>”“=”或“<”,下同);元素⑥的电负性___________ 元素⑦的电负性;元素⑦的简单离子的半径___________ 元素⑧的简单离子的半径。
(4)⑨号元素在周期表种的位置___________ ,位于___________ 区。元素周期表写出元素⑨的价层电子排布式___________ 。
(5)根据对角线规则,②与⑤的氧化物、氢氧化物的性质相似。写出少量②的最高价氧化物与氢氧化钠的水溶液反应所生成的盐的化学式___________ 。
(1)表中有
(2)表中元素⑥原子的最外电子层上未成对电子数为
(3)元素④的第一电离能
(4)⑨号元素在周期表种的位置
(5)根据对角线规则,②与⑤的氧化物、氢氧化物的性质相似。写出少量②的最高价氧化物与氢氧化钠的水溶液反应所生成的盐的化学式
您最近一年使用:0次
名校
解题方法
3 . X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,根据下表相关信息完成以下问题:
(1)X的简单气态氢化物分子的空间结构名称为___________ 。
(2)X、Y对应的简单气态氢化物稳定性由大到小的顺序___________ (用物质化学式表示)。
(3)X、Y、Z、M四种元素的简单离子半径由大到小的顺序是___________ (用离子符号表示)。试从原子结构的角度解释,X的第一电离能比Y大的原因___________ 。
(4)请写出Q元素基态原子的价电子排布图___________ 。
(5)R元素可形成R2+和R3+离子,其中较稳定的是R3+,原因是___________ 。
(6)实验发现M的氯化物处于熔融状态时常以二聚态(M2Cl6)形式存在。其球棍模型如图。___________ 杂化。M的氟化物的熔点为1090℃,远高于M氯化物的熔点192℃,请解释原因___________ 。
| 元素 | 相关信息 |
| X | 原子核外有7种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 位于第三周期,原子半径在同周期元素中最大 |
| M | 逐级电离能(kJ·mol-1)依次为578、1817、2745、11575、14830、18376 |
| Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子核外有4个未成对电子 |
(2)X、Y对应的简单气态氢化物稳定性由大到小的顺序
(3)X、Y、Z、M四种元素的简单离子半径由大到小的顺序是
(4)请写出Q元素基态原子的价电子排布图
(5)R元素可形成R2+和R3+离子,其中较稳定的是R3+,原因是
(6)实验发现M的氯化物处于熔融状态时常以二聚态(M2Cl6)形式存在。其球棍模型如图。

您最近一年使用:0次
名校
解题方法
4 . Ⅰ.硅材料在生活中古有重要地位。请回答:
(1) 分子的空间结构(以Si为中心)为
分子的空间结构(以Si为中心)为______ ,分子中氮原子的杂化轨道类型是______ 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①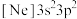 、②
、②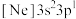 、③
、③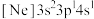 ,有关这些微粒的叙述,正确的是______。
,有关这些微粒的叙述,正确的是______。
(3)Si与P形成的某化合物晶体的晶胞如图。该化合物的化学式为______ 。 和硫铁矿(
和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。
(4) 结构示意图如图1。
结构示意图如图1。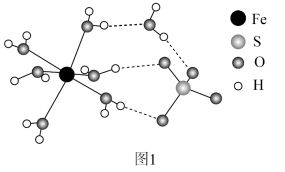
① 的价层电子排布式为
的价层电子排布式为______ 。
② 中O和
中O和 中S均为
中S均为 杂化,比较
杂化,比较 中
中 键角和
键角和 中
中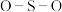 键角的大小并解释原因
键角的大小并解释原因______ 。
③ 中
中 与
与 、
、 与
与 的作用力类型分别是
的作用力类型分别是______ 。
(5) 晶体的晶胞形状为立方体,边长为a nm,结构如图2。
晶体的晶胞形状为立方体,边长为a nm,结构如图2。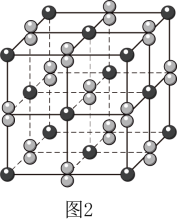
 的摩尔质量为
的摩尔质量为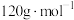 ,阿伏加德罗常数为
,阿伏加德罗常数为 。该晶体的密度为
。该晶体的密度为______  。(
。(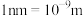 )
)
(1)
 分子的空间结构(以Si为中心)为
分子的空间结构(以Si为中心)为(2)由硅原子核形成的三种微粒,电子排布式分别为:①
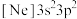 、②
、②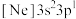 、③
、③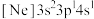 ,有关这些微粒的叙述,正确的是______。
,有关这些微粒的叙述,正确的是______。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |
(3)Si与P形成的某化合物晶体的晶胞如图。该化合物的化学式为

 和硫铁矿(
和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。(4)
 结构示意图如图1。
结构示意图如图1。
①
 的价层电子排布式为
的价层电子排布式为②
 中O和
中O和 中S均为
中S均为 杂化,比较
杂化,比较 中
中 键角和
键角和 中
中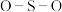 键角的大小并解释原因
键角的大小并解释原因③
 中
中 与
与 、
、 与
与 的作用力类型分别是
的作用力类型分别是(5)
 晶体的晶胞形状为立方体,边长为a nm,结构如图2。
晶体的晶胞形状为立方体,边长为a nm,结构如图2。
 的摩尔质量为
的摩尔质量为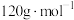 ,阿伏加德罗常数为
,阿伏加德罗常数为 。该晶体的密度为
。该晶体的密度为 。(
。( )
)
您最近一年使用:0次
名校
解题方法
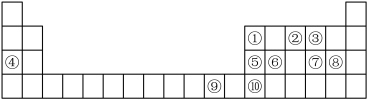
5 . 如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:___________ ,其最高能层的电子占据的原子轨道电子云轮廓为___________ 形。若将其最高价氧化物的水化物溶于氨水中可得到一种透明的深蓝色溶液,写出反应的化学方程式为:___________ 。
(2)第二周期所有元素中第一电离能介于①②之间的有___________ 种。由②③④形成的简单离子半径由小到大顺序是___________ (填化学用语)。
(3)元素⑦⑧可形成原子个数比为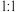 的共价化合物,分子中各原子最外层均达到8电子的稳定结构,该分子为
的共价化合物,分子中各原子最外层均达到8电子的稳定结构,该分子为___________ (填“极性分子”或“非极性分子”)。
(4)元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,写出其化学式___________ ,它的熔点高,硬度大,电绝缘性好,化学性质稳定,它的晶体类型是___________ 。
(5)下列有关性质的比较正确且能用元素周期律解释的是___________(填标号)
(6)⑩可形成的卤化物的熔点如下表:
⑩的氟化物熔点比氯化物熔点高很多的原因是___________ 。
(2)第二周期所有元素中第一电离能介于①②之间的有
(3)元素⑦⑧可形成原子个数比为
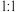 的共价化合物,分子中各原子最外层均达到8电子的稳定结构,该分子为
的共价化合物,分子中各原子最外层均达到8电子的稳定结构,该分子为(4)元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,写出其化学式
(5)下列有关性质的比较正确且能用元素周期律解释的是___________(填标号)
| A.电负性:②>③ | B.氢化物的稳定性:③>⑦ |
| C.最高价氧化物对应的水化物的碱性:④>⑤ | D.氢化物的沸点:③>⑦ |
(6)⑩可形成的卤化物的熔点如下表:
| 卤化物 | 氟化物 | 氯化物 | 溴化物 |
| 熔点℃ | >1000 | 77.75 | 122.3 |
您最近一年使用:0次
解题方法
6 . 短周期元素X、Y、Z、W、M、P、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,P简单离子在同周期离子中半径最小,Q与Z同主族。冰晶石的主要成分是由W、M、P三种元素组成的。
(1)元素X在周期表中的位置为___________ ,其位于___________ 区。
(2)Z元素原子的轨道表示式为___________ 。
(3)P元素基态电子排布式为___________ 。
(4)Q元素基态原子核外电子占据的最高能级为___________ ,该能级能容纳的最多电子数为___________ 。
(5)X、Y、Z、W第一电离由大到小的顺序为___________ (用元素符号表示,下同),Z、W、Q电负性由大到小的顺序为___________ ,X、Y、Z、M、P原子半径由大到小的顺序为___________ 。
(6)原子序数为29和51的元素基态原子价电子排布式分别为___________ 。
(1)元素X在周期表中的位置为
(2)Z元素原子的轨道表示式为
(3)P元素基态电子排布式为
(4)Q元素基态原子核外电子占据的最高能级为
(5)X、Y、Z、W第一电离由大到小的顺序为
(6)原子序数为29和51的元素基态原子价电子排布式分别为
您最近一年使用:0次
名校
解题方法
7 . 前四周期元素A、B、C、D、E原子序数依次增大,其相关性质如表所示:
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有_______ 种能量不同的电子,其价电子排布式为__________ 。
(2)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式_______ 。
(3)B、C、D三种元素的简单离子的半径由大到小的顺序为_______ (用离子符号表示)。
(4)A的简单氢化物与最高价氧化物对应的水化物可以发生反应,则生成物中阳离子的结构式为_______ 。
(5)检测元素C的常见方法是____________ 。
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布式为nsn-1npn+1 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
(1)E元素基态原子核外有
(2)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式
(3)B、C、D三种元素的简单离子的半径由大到小的顺序为
(4)A的简单氢化物与最高价氧化物对应的水化物可以发生反应,则生成物中阳离子的结构式为
(5)检测元素C的常见方法是
您最近一年使用:0次
解题方法
8 . 短周期主族元素X、Y、Z、G、T、W的原子序数依次增大,X基态原子S能级上的电子数是P能级上电子数的2倍,Y的基态原子有两个未成对的电子,Z在同周期主族元素中原子半径最大,T的原子序数是Y的两倍,G的基态原子有7种空间运动状态不同的电子。回答下列问题:
(1)W元素在周期表中的位置是______ ,属于______ 区。
(2)Y、Z、G的简单离子半径由大到小的顺序是______ (填离子符号)。
(3)X的一种氢化物相对分子质量为26,请写出实验室制备它的化学方程式______ 。
(4) 分子是
分子是______ (填“极性”或“非极性”)分子。 分子中T的杂化形式为
分子中T的杂化形式为______ 。
(5)Y和Z能形成既含离子键,又含共价键的化合物,其电子式为______ 。
(6)V是由Y、Z、T组成的常见化合物,V的水溶液呈中性。则V的阴离子的空间构型为______ 。
(7)T的单质有多种同素异形体,其中一种的结构如图所示, ,这种单质易溶于X与W形成的一种常见溶剂
,这种单质易溶于X与W形成的一种常见溶剂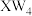 中,其原因是
中,其原因是______ 。
(1)W元素在周期表中的位置是
(2)Y、Z、G的简单离子半径由大到小的顺序是
(3)X的一种氢化物相对分子质量为26,请写出实验室制备它的化学方程式
(4)
 分子是
分子是 分子中T的杂化形式为
分子中T的杂化形式为(5)Y和Z能形成既含离子键,又含共价键的化合物,其电子式为
(6)V是由Y、Z、T组成的常见化合物,V的水溶液呈中性。则V的阴离子的空间构型为
(7)T的单质有多种同素异形体,其中一种的结构如图所示,
 ,这种单质易溶于X与W形成的一种常见溶剂
,这种单质易溶于X与W形成的一种常见溶剂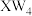 中,其原因是
中,其原因是
您最近一年使用:0次
9 . 部分中学化学常见元素原子的结构及性质如表所示:
(1)A元素在周期表中的位置为___________ ,离子半径:B2+___________ (填“>”“<”或“=”,下同)C3-。
(2)简单气态氢化物的热稳定性:D___________ E。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X和Y的实验方法是___________ 。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M为___________ ,N为___________ 。
(4)用化学方程式表示C和E两种元素的非金属性强弱:___________ 。
| 元素 | 结构及性质 |
| A | A是一种常见的金属元素,它的一种氧化物是具有磁性的黑色晶体 |
| B | B是一种常见的金属元素,原子核外有三个电子层且最外层电子数为偶数 |
| C | C的气态氢化物易液化,常用作制冷剂 |
| D | D的单质为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料 |
| E | E的原子最外层电子数是内层电子总数的3倍 |
| F | F在周期表中排在第IA族,也有人提出可以排在第ⅦA族 |
(2)简单气态氢化物的热稳定性:D
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X和Y的实验方法是
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M为
(4)用化学方程式表示C和E两种元素的非金属性强弱:
您最近一年使用:0次
10 . 依据原子结构知识回答下列问题。
(1)基态硅原子的电子排布式是_______ ;基态硫原子的价电子排布式是________ 。
(2)基态铁原子有____ 个未成对电子,基态 的价电子排布图为
的价电子排布图为______ 。
(3) 、K、O、F四种元素中第一电离能最小的是
、K、O、F四种元素中第一电离能最小的是______ ,电负性最大的是______ 。
(4)下列说法错误的是_______。
(5)过氧化氢( )是一种医用消毒杀菌剂。已知
)是一种医用消毒杀菌剂。已知 的结构如图所示。
的结构如图所示。 不是直线形的,两个氢原子犹如在半展开的书的两面纸上,书面角为93°52′,而两个
不是直线形的,两个氢原子犹如在半展开的书的两面纸上,书面角为93°52′,而两个 与
与 的夹角均为96°52′。
的夹角均为96°52′。 的电子式为
的电子式为______ ,结构式为_______ 。
② 中存在
中存在_____ 键和______ 键,为_____ (填“极性”或“非极性”)分子。
(1)基态硅原子的电子排布式是
(2)基态铁原子有
 的价电子排布图为
的价电子排布图为(3)
 、K、O、F四种元素中第一电离能最小的是
、K、O、F四种元素中第一电离能最小的是(4)下列说法错误的是_______。
A.元素的电负性: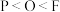 | B.元素的第一电离能: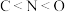 |
C.离子半径: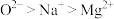 | D.原子的未成对电子数: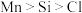 |
(5)过氧化氢(
 )是一种医用消毒杀菌剂。已知
)是一种医用消毒杀菌剂。已知 的结构如图所示。
的结构如图所示。 不是直线形的,两个氢原子犹如在半展开的书的两面纸上,书面角为93°52′,而两个
不是直线形的,两个氢原子犹如在半展开的书的两面纸上,书面角为93°52′,而两个 与
与 的夹角均为96°52′。
的夹角均为96°52′。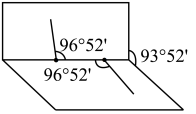
 的电子式为
的电子式为②
 中存在
中存在
您最近一年使用:0次



