解题方法
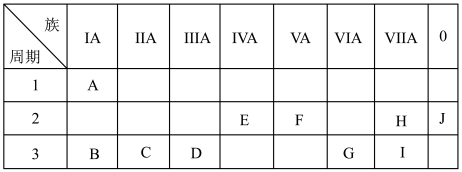
1 . 如图是元素周期表中的一部分。
(1)化学性质最不活泼的元素是_________ ,氧化性最强的单质是__________ 。
(2)最高价氧化物对应的水化物中,碱性最强的是_________ ,呈两性的是_________ 。
(3)在B、C、D、G、I中,原子半径最大的是_________ ,它们的离子半径最大是_________ (填离子符号)。
(4)B的最高价氧化物的水化物与G的最高价氧化物的水化物反应的化学方程式为___________________ 。
(1)化学性质最不活泼的元素是
(2)最高价氧化物对应的水化物中,碱性最强的是
(3)在B、C、D、G、I中,原子半径最大的是
(4)B的最高价氧化物的水化物与G的最高价氧化物的水化物反应的化学方程式为
您最近一年使用:0次
名校
2 . 硫酸亚铁铵[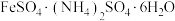 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为___________ 。
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为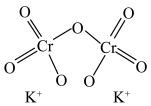 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。
(3)圆底烧瓶中生成 的离子方程式为
的离子方程式为___________ 。
(4)第二步中需要称量剩余铁屑质量的原因为___________ ,写出制备硫酸亚铁铵晶体的化学方程式:___________ 。
(5)试剂N是___________ 。
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。
①重铬酸钾在酸性条件下的还原产物为 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:___________ 。
②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为___________ (写出含M的表达式)。
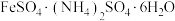 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL
 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。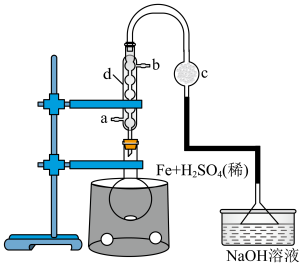
 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为
 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。A. | B. | C.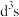 | D.sp |
(3)圆底烧瓶中生成
 的离子方程式为
的离子方程式为(4)第二步中需要称量剩余铁屑质量的原因为
(5)试剂N是
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL
 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。①重铬酸钾在酸性条件下的还原产物为
 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为
您最近一年使用:0次
2024-05-26更新
|
112次组卷
|
2卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题
解题方法
3 . 下表为元素周期表的一部分。请回答下列问题:
(1)写出X元素的元素符号:______ 。
(2)C、N两种元素中,原子半径较小的是______ (填元素符号)。
(3)元素Y在元素周期表中的位置为______ 。
(4)写出Z的气态氢化物的电子式:______ 。
碳 | 氮 | Y | |
X | 硫 | Z |
(2)C、N两种元素中,原子半径较小的是
(3)元素Y在元素周期表中的位置为
(4)写出Z的气态氢化物的电子式:
您最近一年使用:0次
解题方法
4 . 已知A、B、C、D、E、F为短周期元素,其中C的原子序数最小,它们的最高正价与原子半径关系如图所示。
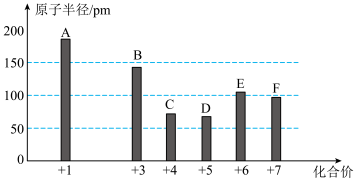
请回答下列问题:
(1)B元素在周期表中的位置为__________ ;D元素能与氢元素组成18电子分子,该分子含有的共价键类型为__________ (填“极性键”或“非极性键”)。
(2) 属于严禁携带的易燃易爆液体,其电子式为
属于严禁携带的易燃易爆液体,其电子式为__________ ;A、E、F三种元素形成的简单离子,半径由大到小的顺序是__________ (用离子符号表示)。
(3)写出元素A、B的最高价氧化物的水化物相互反应的离子方程式__________ 。
(4)用C元素的最简单氢化物和 在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的
在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的__________ 极,若线路中转移2mol电子,则消耗的 在标准状况下的体积为
在标准状况下的体积为__________ 。
(5)化合物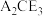 在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向
在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向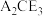 溶液中滴加酸性
溶液中滴加酸性 溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式
溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式__________ 。

请回答下列问题:
(1)B元素在周期表中的位置为
(2)
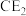 属于严禁携带的易燃易爆液体,其电子式为
属于严禁携带的易燃易爆液体,其电子式为(3)写出元素A、B的最高价氧化物的水化物相互反应的离子方程式
(4)用C元素的最简单氢化物和
 在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的
在碱性条件下可以组成燃料电池,电极材料为多孔惰性金属电极;则通入C元素最简单氢化物的一极是该电池的 在标准状况下的体积为
在标准状况下的体积为(5)化合物
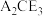 在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向
在农业上可用作杀虫剂,以及在工业上可用于处理废水中的重金属离子。向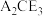 溶液中滴加酸性
溶液中滴加酸性 溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式
溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式
您最近一年使用:0次
真题
解题方法
5 . 氮和氧是构建化合物的常见元素。
(1)某化合物的晶胞如图,其化学式是_______ ,晶体类型是_______ 。
(2)下列说法正确的是_______。
(3)① ,其中
,其中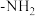 的N原子杂化方式为
的N原子杂化方式为_______ ;比较键角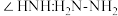 中的
中的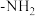
_______  中的
中的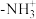 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由_______ 。
②将 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是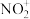 。比较氧化性强弱:
。比较氧化性强弱: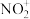
_______  (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式_______ 。
已知: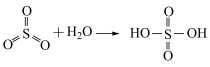
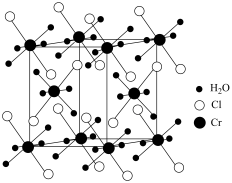
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是_______。
A.电负性: | B.离子半径: |
C.第一电离能: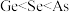 | D.基态 2+的简化电子排布式: 2+的简化电子排布式: |
(3)①
 ,其中
,其中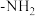 的N原子杂化方式为
的N原子杂化方式为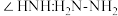 中的
中的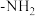
 中的
中的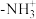 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是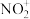 。比较氧化性强弱:
。比较氧化性强弱: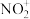
 (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式
您最近一年使用:0次
6 . 硫、氮的化合物及其相互转化在促进社会进步、资源利用和环境保护中具有重要价值。
(1)下列与氮氧化物无关的环境问题是______。
(2)工业上先用NaOH溶液吸收SO2,再用CaO使NaOH再生:NaOH溶液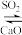 Na2SO3,使NaOH再生的原理是
Na2SO3,使NaOH再生的原理是___________ 。(用化学方程式表示)
(3)土壤中的硝酸盐会被细菌分解。有一种细菌是利用土壤中的硫化物来分解硝酸盐,其主要化学反应原理是:K2S + KNO3 +H2O =N2 +K2SO4 + KOH。
①K、S、N、O元素的原子半径从大到小的顺序是___________ 。
②上述反应中的各物质属于共价化合物是______ ;氧化剂是_______ 。
③配平上述反应方程式,并标出电子转移的方向和数目______ 。
④上述反应改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:________ 。
(4)氨水、NH4Cl、NH4HCO3、NH4HSO4是常见的氮肥。常温下等物质的量浓度的上述4种溶液中c( )最大的是______。
)最大的是______。
(5)某科研小组将微电池技术用于去除天然气中的H2S,装置如图所示,总反应是:2Fe+2H2S+O2=2FeS+2H2O。

①写出负极的电极反应式___________ 。
②一段时间后,单位时间内H2S的去除率降低,其可能的原因是________ 。
(1)下列与氮氧化物无关的环境问题是______。
| A.酸雨 | B.白色污染 | C.光化学烟雾 | D.温室效应 |
(2)工业上先用NaOH溶液吸收SO2,再用CaO使NaOH再生:NaOH溶液
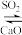 Na2SO3,使NaOH再生的原理是
Na2SO3,使NaOH再生的原理是(3)土壤中的硝酸盐会被细菌分解。有一种细菌是利用土壤中的硫化物来分解硝酸盐,其主要化学反应原理是:K2S + KNO3 +H2O =N2 +K2SO4 + KOH。
①K、S、N、O元素的原子半径从大到小的顺序是
②上述反应中的各物质属于共价化合物是
③配平上述反应方程式,并标出电子转移的方向和数目
④上述反应改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:
(4)氨水、NH4Cl、NH4HCO3、NH4HSO4是常见的氮肥。常温下等物质的量浓度的上述4种溶液中c(
 )最大的是______。
)最大的是______。| A.氨水 | B.NH4Cl | C.NH4HCO3 | D.NH4HSO4 |
(5)某科研小组将微电池技术用于去除天然气中的H2S,装置如图所示,总反应是:2Fe+2H2S+O2=2FeS+2H2O。

①写出负极的电极反应式
②一段时间后,单位时间内H2S的去除率降低,其可能的原因是
您最近一年使用:0次
名校
7 . 如表是元素周期表主族元素的一部分,请参照元素①~⑥在表中的位置,回答下列问题:

(1)②在周期表中的位置______ 。
(2)①的简单氢化物的电子式______ 。
(3)③④⑤形成的简单离子半径由大到小的排序是______ (用离子符号表示)。
(4)用电子式表示③和⑥形成的化合物的过程______ 。
(5)写出⑤单质与③的最高价氧化物对应水化物反应的离子方程式______ 。
(6)③和④中金属性强的是______ (填“元素符号”),以下说法能证明该结论的是______ 。
a.③容易失去1个e-,而④容易失去2个e-
b.③与冷水剧烈反应,而④与冷水反应缓慢
c.③和④的最高价氧化物对应水化物的碱性:③>④
(7)硒(Se)位于第四周期,与②同主族。下列推断不正确 的是______ 。
a.Se最低价为-2价
b.Se单质常温下也呈气态,只有氧化性
c.沸点:H2Se<H2O

(1)②在周期表中的位置
(2)①的简单氢化物的电子式
(3)③④⑤形成的简单离子半径由大到小的排序是
(4)用电子式表示③和⑥形成的化合物的过程
(5)写出⑤单质与③的最高价氧化物对应水化物反应的离子方程式
(6)③和④中金属性强的是
a.③容易失去1个e-,而④容易失去2个e-
b.③与冷水剧烈反应,而④与冷水反应缓慢
c.③和④的最高价氧化物对应水化物的碱性:③>④
(7)硒(Se)位于第四周期,与②同主族。下列推断
a.Se最低价为-2价
b.Se单质常温下也呈气态,只有氧化性
c.沸点:H2Se<H2O
您最近一年使用:0次
2023-04-23更新
|
169次组卷
|
2卷引用:新疆乌鲁木齐市第二十三中学2023-2024学年高三上学期1月月考化学试题
名校
解题方法
8 . 我国嫦娥五号探测器带回1.731kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素A、B、C、D,原子序数依次增大,最外层电子数之和为15。B、C、D为同周期相邻元素,A为地壳中含量最多的元素。回答下列问题:
(1)元素D在周期表中的位置为___ ,A、C的简单离子半径大小顺序为___ (填离子符号)。
(2)化合物BA的电子式为___ (填元素符号)。A和D形成的化合物中的化学键类型为___________ 。
(3)B和C两元素相比较,金属性较强是___ (填元素符号),可以证明该结论的实验___ 。
A.比较两种元素的单质与冷的浓硫酸反应的速率
B.比较两种元素最高价氧化物对应的水化物的碱性
C.将相同大小的两种元素单质分别放入沸水中,观察反应现象
D.比较相同物质的量的两种元素的单质与足量稀盐酸反应产生 的多少
的多少
(1)元素D在周期表中的位置为
(2)化合物BA的电子式为
(3)B和C两元素相比较,金属性较强是
A.比较两种元素的单质与冷的浓硫酸反应的速率
B.比较两种元素最高价氧化物对应的水化物的碱性
C.将相同大小的两种元素单质分别放入沸水中,观察反应现象
D.比较相同物质的量的两种元素的单质与足量稀盐酸反应产生
 的多少
的多少
您最近一年使用:0次
2022-07-05更新
|
324次组卷
|
3卷引用:甘肃省张掖市某校2023-2024学年高三下学期模拟考试化学试题
甘肃省张掖市某校2023-2024学年高三下学期模拟考试化学试题广西柳州市2023届新高三摸底考试化学试题(已下线)第16讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(全国通用)
名校
解题方法
9 . A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个;F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)F的三种核素表示符号为_______ ,E的名称为_______ ,D的最高价氧化物的水化物的电子式:_______ 。
(2)在B、C、D、E、F原子形成的单核离子中离子半径最小的是_______ ,离子半径最大的是_______ 。(填离子符号)
(3)A、B、C的氢化物稳定性顺序为_______ (用分子式表示);B的氢化物和B的最高价氧化物的水化物反应生成Z,反应中断裂化学键是_______ ,形成的化学键是_______ 。(填“离子键”、“极性键”、“非极性键”、“氢键”)
(4)F2C和F2E中,沸点较高的是_______ (填化学式),其主要原因是_______ 。
(5)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为_______ 。
(1)F的三种核素表示符号为
(2)在B、C、D、E、F原子形成的单核离子中离子半径最小的是
(3)A、B、C的氢化物稳定性顺序为
(4)F2C和F2E中,沸点较高的是
(5)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为
您最近一年使用:0次
2017-04-15更新
|
173次组卷
|
2卷引用:新疆乌鲁木齐市高级中学2023-2024学年高三上学期1月月考化学试题
名校
解题方法
10 . A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示。
回答下列问题
(1)元素B的元素符号是:____________ 化合物丙的电子式为________________ 。化合物丁存在的化学键类型是_________ 。
(2)化合物甲的沸点比戊____________ (填“高”或“低”),B、C、D原子半径从大到小依次为_______________ (用元素符号)
(3)向含有0.2 mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为_________ NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将_____________ ;放电一段时间KOH的物质的量_________ (填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程:__________________________________ 。
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
(1)元素B的元素符号是:
(2)化合物甲的沸点比戊
(3)向含有0.2 mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将
(5)用电子式表示己的形成过程:
您最近一年使用:0次
2016-12-09更新
|
449次组卷
|
2卷引用:新疆乌鲁木齐市第十二中学2023-2024学年高三上学期1月月考化学试题



