名校
解题方法
1 . X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,根据下表相关信息完成以下问题:
(1)请写出Q元素基态原子的价电子排布图:_______ 。
(2)X、Y、Z、M四种元素的原子半径由小到大的顺序是_______ (用元素符号表示)。
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是_______ 。
(4)X、Y、Q三种元素简单气态氢化物稳定性由大到小_______ (用物质符号表示)。
(5)Z的氯化物比M的氯化物熔点高原因是_______ 。
(6)实验发现M的氯化物处于熔融状态时常以二聚态(M2Cl6)形式存在。其球棍模型如图。

①该分子中M原子采取_______ 杂化。
②M2Cl6与过量NaOH溶液反应生成Na[M(OH)4],[M(OH)4]-中存在的化学键类型有_______ (填标号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期元素中最大 |
| M | 逐级电离能(kJ·mol-1)依次为578、1817、2745、11575、14830、18376 |
| Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子核外有4个未成对电子 |
(2)X、Y、Z、M四种元素的原子半径由小到大的顺序是
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是
(4)X、Y、Q三种元素简单气态氢化物稳定性由大到小
(5)Z的氯化物比M的氯化物熔点高原因是
(6)实验发现M的氯化物处于熔融状态时常以二聚态(M2Cl6)形式存在。其球棍模型如图。

①该分子中M原子采取
②M2Cl6与过量NaOH溶液反应生成Na[M(OH)4],[M(OH)4]-中存在的化学键类型有
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
您最近一年使用:0次
2023-08-26更新
|
246次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高三上学期10月月考化学试题
2 . 如表是部分短周期元素的性质或原子结构特点。
请回答下列问题:
(1)基态T原子的价电子排布式为_______
(2)比较Y元素,W元素的离子半径_______ (用离子符号表示)
(3)元素Z在元素周期表中的位置是_______ ,元素Z与元素T相比,非金属性较强的是_______ (用元素符号表示)。下列表述中能证明这一事实的是_______ (填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z元素的简单气态氢化物比T元素的稳定
c.Z的最高价氧化物对应水化物的酸性比T的强
(4)T、X、Y、Z四种元素的最高价氧化物对应水化物中性质明显不同于其他三种的是_______ (填化学式)
(5)W的最高价氧化物对应水化物与NaOH溶液反应的离子方程式为_______ 。
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其最高价氧化物对应水化物既能跟酸反应,又能跟强碱反应 |
(1)基态T原子的价电子排布式为
(2)比较Y元素,W元素的离子半径
(3)元素Z在元素周期表中的位置是
a.常温下Z的单质和T的单质状态不同
b.Z元素的简单气态氢化物比T元素的稳定
c.Z的最高价氧化物对应水化物的酸性比T的强
(4)T、X、Y、Z四种元素的最高价氧化物对应水化物中性质明显不同于其他三种的是
(5)W的最高价氧化物对应水化物与NaOH溶液反应的离子方程式为
您最近一年使用:0次
3 . 硬铝(主要成分为Al、Cu、Mg、M、Si)主要用于生产各种构件和铆钉,在造船和建筑等行业也有广泛的应用。回答下列问题。
(1)处于基态的Al原子和Mg原子,下列参数中Al原子较大的是______ (填标号)。
A.未成对电子数 B.第一电离能 C.原子半径
(2)硅元素很难形成含多重键的化合物,最近我国科学家在合成的二硅炔镁盐中探测到有“Si=Si”键的存在。硅元素难以形成“Si=Si”键的原因是______ 。
(3)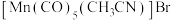 是一种重要的配合物,
是一种重要的配合物,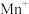 的配位数为
的配位数为______ , 提供孤电子对的原子为
提供孤电子对的原子为______ ,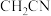 分子中碳原子的杂化类型为
分子中碳原子的杂化类型为______ , 中三种元素的电负性由大到小的顺序为
中三种元素的电负性由大到小的顺序为______ 。
(4)氧化镁晶胞属于立方形晶胞,其晶胞参数为anm。晶胞中每个 周围紧邻且距离相等的
周围紧邻且距离相等的 共有
共有______ 个,其最近距离为______ nm。设阿伏加德罗常数的值为 ,则氧化镁晶体的密度为
,则氧化镁晶体的密度为______  (列出计算表达式)。
(列出计算表达式)。

(1)处于基态的Al原子和Mg原子,下列参数中Al原子较大的是
A.未成对电子数 B.第一电离能 C.原子半径
(2)硅元素很难形成含多重键的化合物,最近我国科学家在合成的二硅炔镁盐中探测到有“Si=Si”键的存在。硅元素难以形成“Si=Si”键的原因是
(3)
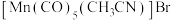 是一种重要的配合物,
是一种重要的配合物,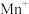 的配位数为
的配位数为 提供孤电子对的原子为
提供孤电子对的原子为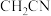 分子中碳原子的杂化类型为
分子中碳原子的杂化类型为 中三种元素的电负性由大到小的顺序为
中三种元素的电负性由大到小的顺序为(4)氧化镁晶胞属于立方形晶胞,其晶胞参数为anm。晶胞中每个
 周围紧邻且距离相等的
周围紧邻且距离相等的 共有
共有 ,则氧化镁晶体的密度为
,则氧化镁晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
解题方法
4 . 近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______ ,其沸点比NH3的_______ (填“高”或“低”),其判断理由是_______ 。
(2)Fe成为阳离子时首先失去_______ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为_______ 。
(3)比较离子半径:F-______ O2-(填“大于”“等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
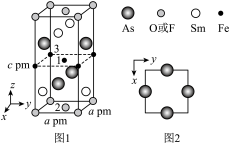
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ,
, ,
, ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为_______ 、_______ 。
(1)元素As与N同族。预测As的氢化物分子的立体结构为
(2)Fe成为阳离子时首先失去
(3)比较离子半径:F-
(4)一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
 ,
, ,
, ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为
您最近一年使用:0次
5 . 已知A、B、C、D、E是五种短周期主族元素,C与E同主族,其原子半径与原子序数的关系如图,且A、B、C、D可形成化合物X。回答下列问题:
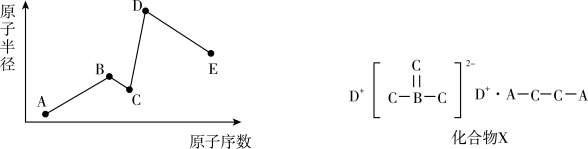
(1)元素E在周期表的位置为第_______ 周期_______ 族,A、B、C、D、E五种元素原子的最外层电子数之和为_______ 。
(2)B、C、E分别形成的最简单氢化物的沸点由高到低的顺序为_______ ;能比较得出B、E的最高价氧化物的水化物酸性强弱的化学反应离子方程式为_______ 。
(3)A、B、C、D、E五种元素中能形成的简单离子中,半径最大的是_______ (填离子符号,下同),半径最小的是_______ 。
(4)C、D形成的一种离子化合物M能与水反应生成C的单质和产物N。M的电子式为_______ ,N中所含有的化学键类型为_______ 。
(5)下列关于化合物X的说法正确的是_______。

(1)元素E在周期表的位置为第
(2)B、C、E分别形成的最简单氢化物的沸点由高到低的顺序为
(3)A、B、C、D、E五种元素中能形成的简单离子中,半径最大的是
(4)C、D形成的一种离子化合物M能与水反应生成C的单质和产物N。M的电子式为
(5)下列关于化合物X的说法正确的是_______。
| A.具有强氧化性 | B.溶于水呈碱性,能促进油污水解 |
C.能使酸性 溶液褪色 溶液褪色 | D.能用于净水,原理与明矾净水相同 |
您最近一年使用:0次
名校
6 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是____ ,用电子式表示Y的最高价氧化物的形成过程:_____ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)_______ 。
(3)在 与
与 的混合液中通入足量
的混合液中通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
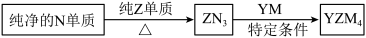
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品ag,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)
(3)在
 与
与 的混合液中通入足量
的混合液中通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品ag,若实验测得氢气的体积为
 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为
您最近一年使用:0次
名校
7 . 下列表格是元素周期表的一部分。请按要求填空(用化学用语填写)
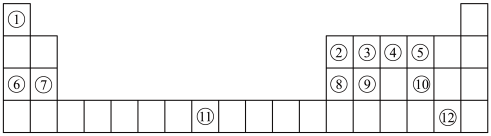
(1)元素①和⑥形成的化合物中存在的化学键类型为_______ 。
(2)用化学方程式表示④的简单氢化物的工业制法_______ 。
(3)写出由③④⑥形成的化合物的电子式_______ 。
(4)列举元素⑨形成的氧化物的一种用途_______ ,元素⑪在周期表中的位置_______ 。
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为_______ 。
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为_______ 。
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为_______ 。

(1)元素①和⑥形成的化合物中存在的化学键类型为
(2)用化学方程式表示④的简单氢化物的工业制法
(3)写出由③④⑥形成的化合物的电子式
(4)列举元素⑨形成的氧化物的一种用途
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol
 ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为
您最近一年使用:0次
2022-11-28更新
|
338次组卷
|
2卷引用:天津市南开中学2022-2023学年高三上学期第二次月考化学试题
8 . 以粉煤灰(主要成分:Al2O3、SiO2、少量Fe2O3)为原料,制取Al2O3的部分工艺流程如下:

完成下列填空:
(1)铝原子核外有_______ 种不同能量的电子,最外层电子的轨道式是_______ ,上述流程涉及第二周期元素的原子半径由小到大的顺序是_______ 。
(2)“除铁”是将Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为_______ ,检验溶液中Fe3+是否除尽的方法是_______ 。
(3)解释“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因。_______
(4)上述流程可循环的物质是_______ 。
(5)工业上是通过电解熔化状态下Al2O3,而不是电解熔化状态下AlCl3来获得铝,其原因是_______ 。

完成下列填空:
(1)铝原子核外有
(2)“除铁”是将Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为
(3)解释“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因。
(4)上述流程可循环的物质是
(5)工业上是通过电解熔化状态下Al2O3,而不是电解熔化状态下AlCl3来获得铝,其原因是
您最近一年使用:0次
名校
解题方法
9 . A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为___________ 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为___________ ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC l4 g完全燃烧放出热量b kJ,写出单质B和单质C反应生成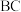 的热化学方程式:
的热化学方程式:___________ ;
(4)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为___________ 。
(5)C、D、E、F四种元素的离子半径由大到小的顺序___________ (用离子符号表示)
(6)过量B元素的最高价氧化物与D元素的最高价氧化物的水化物反应的离子方程式为___________ 。
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC l4 g完全燃烧放出热量b kJ,写出单质B和单质C反应生成
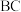 的热化学方程式:
的热化学方程式:(4)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为
(5)C、D、E、F四种元素的离子半径由大到小的顺序
(6)过量B元素的最高价氧化物与D元素的最高价氧化物的水化物反应的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . 下表是元素周期表的一部分,回答有关问题。
(1)写出元素符号:①_______ ,⑥_______ 。
(2)在这些元素中,最活泼的金属元素是____ (填元素符号),原子结构示意图为_____ 。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质是_______ (填化学式),碱性最强的物质是_______ (填化学式)。
(4)元素③、④、⑤的原子中,半径由大到小的顺序为_______ (填原子符号)。
(5)由元素②、③、⑧形成的一种常见的杀菌消毒剂,化学式是_______ 。
(6)元素⑦的电子式:_______ 。
(7)⑥、⑦和⑧三种元素的最低价简单气态氢化物的热稳定性,由弱到强的顺序是____ (填化学式)。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 一 | ||||||||
| 二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在这些元素中,最活泼的金属元素是
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质是
(4)元素③、④、⑤的原子中,半径由大到小的顺序为
(5)由元素②、③、⑧形成的一种常见的杀菌消毒剂,化学式是
(6)元素⑦的电子式:
(7)⑥、⑦和⑧三种元素的最低价简单气态氢化物的热稳定性,由弱到强的顺序是
您最近一年使用:0次



