1 . 有关反应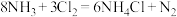 的说法正确的是
的说法正确的是
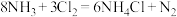 的说法正确的是
的说法正确的是A. 具有氧化性,与 具有氧化性,与 反应时得到电子 反应时得到电子 |
B. 具有还原性,在反应中氮元素全部被氧化 具有还原性,在反应中氮元素全部被氧化 |
C.若有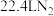 生成,则至少需 生成,则至少需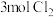 参与反应 参与反应 |
| D.该反应中只发生共价键的断裂与形成 |
您最近一年使用:0次
2 . 下列关于非金属元素和金属元素特征的叙述不正确的是
①非金属元素可能有还原性,也可能有氧化性
②非金属元素只能形成共价化合物
③金属阳离子被还原不一定得到金属单质
④金属元素不可能存在于阴离子中
⑤金属元素与非金属元素形成的化合物一定是离子化合物
①非金属元素可能有还原性,也可能有氧化性
②非金属元素只能形成共价化合物
③金属阳离子被还原不一定得到金属单质
④金属元素不可能存在于阴离子中
⑤金属元素与非金属元素形成的化合物一定是离子化合物
| A.①③ | B.②③ | C.③④⑤ | D.②④⑤ |
您最近一年使用:0次
解题方法
3 . 钠元素在自然界中分布很广,储量极为丰富,都以化合态存在,如氯化钠、碳酸钠、硫酸钠等。钠单质和钠的化合物在生产、生活中被广泛应用。请根据钠及其化合物性质按要求完成各题。
(1)钠原子在周期表中的位置为___________ ,钠离子的结构示意图___________ 。
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有___________ (填化学式,下同),既含有离子键又含有共价键的有___________ ,只含共价键的有___________ 。
(3)钠的化学性质活泼,暴露在空气中生成___________ 色Na2O,在空气中加热,生成___________ 色的Na2O2,Na2O2可用作呼吸面具、潜水艇的供氧剂,写出Na2O2和CO2反应的化学方程式:___________ 。
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
(5)下列有关物质的性质描述正确的是____。
(6)Na2CO3和NaHCO3是常见的钠盐,且两者之间可以相互转化,请回答下列问题:
①下列有关碳酸钠和碳酸氢钠的说法正确的是____ 。
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式___________ ;
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为___________ ;
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为____ 。
A.42% B.44% C.56% D.58%
(1)钠原子在周期表中的位置为
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有
(3)钠的化学性质活泼,暴露在空气中生成
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
| A.钠熔化成银白色小球 | B.钠在水面上迅速游动 |
| C.发出嘶嘶的声响 | D.溶液逐渐变红色 |
| A.钠与氧气反应时的产物主要取决于氧气的用量及纯度 |
| B.钠投入硫酸铜溶液中有气体和蓝色沉淀产生 |
| C.Na2O和Na2O2分别溶于水中,所得的产物相同 |
| D.FeCl3溶液用于铜质印刷线路制作,原因是两者发生置换反应 |
①下列有关碳酸钠和碳酸氢钠的说法正确的是
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为
A.42% B.44% C.56% D.58%
您最近一年使用:0次
4 . 在抗击新冠病毒中“84消毒液(有效成分是NaClO)”发挥了重要作用。工业上,制备“84消毒液”的原理为:NaCl+H2O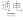 NaClO+H2↑。下列说法不正确的是
NaClO+H2↑。下列说法不正确的是
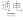 NaClO+H2↑。下列说法不正确的是
NaClO+H2↑。下列说法不正确的是| A.该反应每转移4mol电子生成149g的NaClO |
| B.NaClO的消毒原理利用了其强氧化性 |
C.NaCl的电子式为: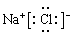 |
| D.上述制备消毒液的反应过程中只有离子键的断裂和形成 |
您最近一年使用:0次
名校
5 . 我国科学家分析月壤成分发现含有X、Y、Z、W、M五种主族元素,其原子序数依次增大且都不大于20,Y、Z、W同周期且Z、M同主族;X与W形成的化合物是光导纤维的基本原料,在潜水艇中Y2X2可以用作供氧剂。下列说法正确的是
| A.离子半径的大小顺序:Z>Y>X |
| B.最简单气态氢化物稳定性X>W |
| C.最高价氧化物对应水化物碱性Y>Z>M |
| D.化合物Y2X2中只有离子键 |
您最近一年使用:0次
2023-07-13更新
|
174次组卷
|
3卷引用:安徽省亳州市第二完全中学2022-2023学年高一下学期期末考试化学(B卷)试题
安徽省亳州市第二完全中学2022-2023学年高一下学期期末考试化学(B卷)试题四川省宜宾市叙州区第二中学校2023-2024学年高二上学期开学化学试题(已下线)巩固测试卷02-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)
名校
6 . 下列关于HCl与HBr的性质比较能用化学键的强弱解释的是
| A.热稳定性 | B.酸性 | C.沸点 | D.还原性 |
您最近一年使用:0次
2022-10-27更新
|
126次组卷
|
2卷引用:上海市建平中学2022-2023学年高三上学期10月月考化学试题
名校
7 . X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素原子的L层电子是K层的2倍,Y元素与Z、M元素相邻,且与M元素同主族;化合物 的电子总数为18个;化合物
的电子总数为18个;化合物 是工业上重要的有机溶剂。下列说法
是工业上重要的有机溶剂。下列说法不正确 的是
 的电子总数为18个;化合物
的电子总数为18个;化合物 是工业上重要的有机溶剂。下列说法
是工业上重要的有机溶剂。下列说法| A.原子半径:Z<Y<M |
| B.最高价氧化物对应水化物的酸性:Z>Y>M |
C. 易溶于水,其水溶液呈碱性 易溶于水,其水溶液呈碱性 |
| D.X、Z和Q三种元素形成的化合物一定是共价化合物 |
您最近一年使用:0次
名校
8 . A、B、C、D、E、F是原子序数依次增大的6种短周期主族元素。A元素是动植物生长不可缺少的元素,其单质在空气中含量最高;B元素的最外层电子数是其电子层数的3倍;短周期主族元素中C原子半径最大;C、D、E的最高价氧化物对应水化物两两之间都能反应,元素E最高正化合价与最低负化合价的代数和为4。回答下列问题:
(1)A元素组成单质的电子式_____________ 。E和F的最高价氧化物对应水化物酸性更强的是_____________ (填化学式)。
(2)B、C、D、E四种元素简单离子的离子半径由大到小 的顺序是(填具体的离子符号):______________________ ;
(3)C和B能形成C2B和C2B2两种化合物,用电子式请写出C2B2的形成过程:
_________________________________ 。
(4)已知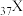 和
和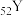 都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);
都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);
(5)下列物质的变化中未发生化学键破坏的是_____________ (填序号,下同),仅发生离子键破坏的是_____________ ,仅发生共价键破坏的是_____________ ,既发生离子键破坏,又发生共价键破坏的是________________________ .
①氯化钠溶于水、②氯化氢溶于水、③乙醇溶于水、④过氧化钠与水反应、⑤碘升华.
(6)A、B组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐和水。请写出该反应的离子方程式_____________ 。
(1)A元素组成单质的电子式
(2)B、C、D、E四种元素简单离子的离子半径
(3)C和B能形成C2B和C2B2两种化合物,用电子式请写出C2B2的形成过程:
(4)已知
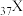 和
和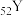 都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);
都位于第五周期,分别与C和E同一主族。下列有关说法正确的是_____________(填字母序号);| A.原子半径:X>Y | B.最高价氧化物对应水化物的碱性强弱:X>C |
| C.气态氢化物稳定性强弱:E>Y | D.B与C形成的化合物中不可能含有共价键 |
①氯化钠溶于水、②氯化氢溶于水、③乙醇溶于水、④过氧化钠与水反应、⑤碘升华.
(6)A、B组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐和水。请写出该反应的离子方程式
您最近一年使用:0次
9 . 下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
(1)画出①和③两种元素的原子1:2组成的化合物的电子式_______ 。
(2)元素①-⑩中化学性质最不活泼的元素是_______ (填元素符号)。
(3)⑧的离子结构示意图为_______ 。
(4)用电子式表示③与⑤形成的原子个数比为1 ∶2的化合物的形成过程_______ 。
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有_______ 。
(6)硒(Se)被誉为“生命元素”,科学补硒可以减少疾病的发生。周期表中元素Se的位置在⑧的下方,下列推断正确的是_______(填字母序号)
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素①-⑩中化学性质最不活泼的元素是
(3)⑧的离子结构示意图为
(4)用电子式表示③与⑤形成的原子个数比为1 ∶2的化合物的形成过程
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有
(6)硒(Se)被誉为“生命元素”,科学补硒可以减少疾病的发生。周期表中元素Se的位置在⑧的下方,下列推断正确的是_______(填字母序号)
| A.SeO2具有还原性 | B.H2Se的稳定性比H2S强 |
| C.H2SeO4的酸性强于H2SO4 | D.SeO2在一定条件下可与NaOH溶液反应 |
您最近一年使用:0次
解题方法
10 . 下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白(涉及表中元素一律用对应化学符号表示):
(1)在这些元素中,化学性质最不活泼的是:_____________ (填具体元素符号,下同),原子结构示意图为_____________ 。元素⑩名称为_____________ ,在周期表中的位置_________________ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是_________________ ,碱性最强的化合物的电子式是:_________________________ 。
(3)用电子式表示元素②的常见单质_____________ 其结构式为_________________ 。
(4)表示①与⑦的化合物的电子式为_________________ ,该化合物是由_____________ (填“极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的简单离子,离子半径由大到小的顺序是_________ 。
(6)元素③的简单氢化物的结构式为_____________________ ;该氢化物常温下和元素⑦的单质反应的化学方程式为 _____________________ 。
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
(3)用电子式表示元素②的常见单质
(4)表示①与⑦的化合物的电子式为
(5)③、⑥、⑦三种元素形成的简单离子,离子半径由大到小的顺序是
(6)元素③的简单氢化物的结构式为
您最近一年使用:0次



