1 . 回答下列问题:
(1)在基态多电子原子中,关于核外电子能量的叙述错误的是_______ 。
a.最易失去的电子能量最高
b.同一个电子层上的不同能级上的原子轨道,能量大小不同
c.p轨道电子能量一定高于s轨道电子能量
d.在离核最近区域内运动的电子能量最低
(2)比较下列多电子原子的原子轨道的能量高低。
①1s,3d:_______ ;②3s,3p,3d:_______ ;③2p,3p,4p:_______ ;④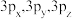 :
:_______ 。
(3)基态铝原子核外电子云有_______ 种不同的伸展方向,共有_______ 种不同能级的电子,有_______ 种不同运动状态的电子。
(1)在基态多电子原子中,关于核外电子能量的叙述错误的是
a.最易失去的电子能量最高
b.同一个电子层上的不同能级上的原子轨道,能量大小不同
c.p轨道电子能量一定高于s轨道电子能量
d.在离核最近区域内运动的电子能量最低
(2)比较下列多电子原子的原子轨道的能量高低。
①1s,3d:
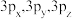 :
:(3)基态铝原子核外电子云有
您最近半年使用:0次
2021-02-07更新
|
904次组卷
|
3卷引用:鲁科版2019选择性必修2第1章 原子结构与元素性质 第1节 原子结构模型 第2课时 量子力学对原子核外电子运动状态的描述
鲁科版2019选择性必修2第1章 原子结构与元素性质 第1节 原子结构模型 第2课时 量子力学对原子核外电子运动状态的描述(已下线)本册综合检测(B)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)第一章 原子结构与性质(A卷·知识通关练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)
2 . 回答下列问题:
(1) 的能层有
的能层有______ 个能级,______ 种形状不同的电子云,有______ 个原子轨道最多容纳______ 个电子。
(2)用相应的符号描述 的所有的原子轨道:
的所有的原子轨道:______ 。
(3)处于一定空间状态的电子在原子核外出现的概率密度分布可用______ 形象地描述。在基态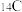 原子中核外存在
原子中核外存在______ 个不同运动状态的电子。
(4)基态 原子中,核外电子占据的最高能层符号为
原子中,核外电子占据的最高能层符号为______ ,占据该能层电子的电子云轮廓图的形状为______ 。
(1)
 的能层有
的能层有(2)用相应的符号描述
 的所有的原子轨道:
的所有的原子轨道:(3)处于一定空间状态的电子在原子核外出现的概率密度分布可用
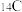 原子中核外存在
原子中核外存在(4)基态
 原子中,核外电子占据的最高能层符号为
原子中,核外电子占据的最高能层符号为
您最近半年使用:0次
2021-02-01更新
|
735次组卷
|
3卷引用:(人教版2019)选择性必修2第一章 原子结构与性质 第一节 原子结构 第3课时 电子云与原子轨道
3 . (1)s电子的原子轨道呈___________ 形,每个s能级有___________ 个原子轨道;p电子的原子轨道呈___________ 形,每个p能级有___________ 个原子轨道。
(2) 基态铝原子核外共有___________ 种不同能级的电子,有___________ 种不同运动状态的电子。
(2) 基态铝原子核外共有
您最近半年使用:0次
名校
解题方法
4 . 常温时,通过NaOH溶液或硫酸改变饱和氯水的pH,溶液中含氯微粒的物质的量分数与pH的关系如图所示。回答下列问题:
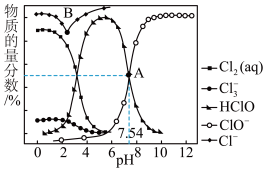
(1)Cl-的核外电子占有______ 个原子轨道, 中的化学键类型是
中的化学键类型是______ ,HClO的电子式是______ 。
(2)解释A点溶液pH=7.54的主要原因:______ 。
(3)结合图象,从平衡移动的角度解释B点向右Cl-物质的量分数增大的主要原因:
①______ ;
②______ 。
(4)估算图象中Cl-物质的量分数的上限______ 。

(1)Cl-的核外电子占有
 中的化学键类型是
中的化学键类型是(2)解释A点溶液pH=7.54的主要原因:
(3)结合图象,从平衡移动的角度解释B点向右Cl-物质的量分数增大的主要原因:
①
②
(4)估算图象中Cl-物质的量分数的上限
您最近半年使用:0次
2020高三·全国·专题练习
5 . (1)铁在元素周期表中的位置为_____ ,基态铁原子有个未成对电子_____ ,三价铁离子的电子排布式为_____ 。
(2)基态Si原子中,电子占据的最高能层符号_____ ,该能层具有的原子轨道数为_____ ;铝元素的原子核外共有_____ 种不同运动状态的电子、_____ 种不同能级的电子。
(3)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_____ 形象化描述。在基态14C原子中,核外存在_____ 对自旋相反的电子。
(2)基态Si原子中,电子占据的最高能层符号
(3)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
您最近半年使用:0次
6 . (1)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。基态Fe2+与Fe3+离子中未成对的电子数之比为______ 。
(2)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,基态Ti原子的核外电子排布式为____________ 。
(3)以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵((NH4)3Fe(C6H5O7)2)。Fe基态核外电子排布式为___________ ;
(4)钙和铜合金可用作电解制钙的阴极电极材料,基态铜原子的价电子排布式为________ 。
(5)基态Sn原子价层电子的空间运动状态有___ 种,基态氧原子的价层电子排布式不能表示为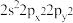 ,因为这违背了
,因为这违背了____ 原理(规则)。
(2)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,基态Ti原子的核外电子排布式为
(3)以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵((NH4)3Fe(C6H5O7)2)。Fe基态核外电子排布式为
(4)钙和铜合金可用作电解制钙的阴极电极材料,基态铜原子的价电子排布式为
(5)基态Sn原子价层电子的空间运动状态有
 ,因为这违背了
,因为这违背了
您最近半年使用:0次
名校
解题方法
7 . 按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A原子中只有一个能层且只含1个电子;B原子的2p轨道上得到2个电子后不能再容纳外来电子;C原子价电子排布式为nsn-1npn+1 ;D的一种核素的质量数为59,中子数为31。
(1)A的原子轨道形状为___________ 。
(2)画出B的原子结构示意图__________ 。
(3)C的基态原子核外电子空间运动状态有________ 种。
(4)D2+ 的核外电子排布式是____________ 。
A原子中只有一个能层且只含1个电子;B原子的2p轨道上得到2个电子后不能再容纳外来电子;C原子价电子排布式为nsn-1npn+1 ;D的一种核素的质量数为59,中子数为31。
(1)A的原子轨道形状为
(2)画出B的原子结构示意图
(3)C的基态原子核外电子空间运动状态有
(4)D2+ 的核外电子排布式是
您最近半年使用:0次
8 . 氮是生命物质的重要组成元素之一,含氮物质与人类的生活密切相关。氮原子最外层电子轨道表示式为:_____________ ;N4分子的空间结构如图: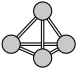 ,它是一种
,它是一种___________ 分子(填“极性”或“非极性”)。
 ,它是一种
,它是一种
您最近半年使用:0次
名校
9 . 铋(83Bi)为第V A族元素,常见化合价为+3和+5。化合物NaBiO3为黄色固体,常温下微溶于水,在空气中逐渐分解产生Bi2O3、NaOH等物质。
(1)铋元素最外层电子分布在_____ 种能级中,共有_____ 种运动状态。
(2)铋酸钠NaBiO3中属于短周期元素的离子半径大小关系为_________ 。
(3)元素Na、Bi、O的金属性依次减弱,非金属性依次增强,请列举判断依据:_______ 。
(4)铋酸钠NaBiO3在空气中分解所得到产物中,化学键类型是______ 。
A.金属键 B.离子键 C.极性键 D.非极性键
(5)将NaBiO3加入MnSO4和H2SO4的混合溶液里加热,发生如下反应:
[ ]NaBiO3+[ ]MnSO4+[ ]H2SO4→[ ]Na2SO4+[ ]Bi2(SO4)3+[ ]NaMnO4+[ ]H2O
①配平该化学方程式,将系数填写在对应位置上。
______ NaBiO3+______ MnSO4+______ H2SO4→______ Na2SO4+______ Bi2(SO4)3+______ NaMnO4+______ H2O
②若有2mol氧化剂在该反应中被还原,则生成的MnO 被还原为Mn2+时,能将
被还原为Mn2+时,能将____ mol HCl氧化成Cl2。
(6)写出NaBiO3固体溶于HCl时发生反应的离子方程式:_________ 。
(1)铋元素最外层电子分布在
(2)铋酸钠NaBiO3中属于短周期元素的离子半径大小关系为
(3)元素Na、Bi、O的金属性依次减弱,非金属性依次增强,请列举判断依据:
(4)铋酸钠NaBiO3在空气中分解所得到产物中,化学键类型是
A.金属键 B.离子键 C.极性键 D.非极性键
(5)将NaBiO3加入MnSO4和H2SO4的混合溶液里加热,发生如下反应:
[ ]NaBiO3+[ ]MnSO4+[ ]H2SO4→[ ]Na2SO4+[ ]Bi2(SO4)3+[ ]NaMnO4+[ ]H2O
①配平该化学方程式,将系数填写在对应位置上。
②若有2mol氧化剂在该反应中被还原,则生成的MnO
 被还原为Mn2+时,能将
被还原为Mn2+时,能将(6)写出NaBiO3固体溶于HCl时发生反应的离子方程式:
您最近半年使用:0次
解题方法
10 . 钾和碘的相关化合物在化工、医药、材料等领域有广泛的应用。回答下列问题:
(1)钾元素的焰色为紫色,该过程中其原子光谱属于______ 光谱(选填“吸收”或“发射”)。
(2)碘原子中,占据最高能级的电子的电子云轮廓图形状为______ 。
(3)请写出基态钾原子的核外电子排布式______ 。
(4)请比较KI与KCl晶体的熔点高低______ ,并说明理由:______ 。
(5)KIO3常用作食盐添加剂,其晶胞如图所示。

① 离子的立体构型为
离子的立体构型为______ 。
②已知KIO3晶胞的边长为apm,晶胞中K、I、O原子分别处于顶角、体心、面心位置。则每个K原子周围距离最短的O原子有______ 个。该晶胞的密度为______ g/cm3。
(1)钾元素的焰色为紫色,该过程中其原子光谱属于
(2)碘原子中,占据最高能级的电子的电子云轮廓图形状为
(3)请写出基态钾原子的核外电子排布式
(4)请比较KI与KCl晶体的熔点高低
(5)KIO3常用作食盐添加剂,其晶胞如图所示。

①
 离子的立体构型为
离子的立体构型为②已知KIO3晶胞的边长为apm,晶胞中K、I、O原子分别处于顶角、体心、面心位置。则每个K原子周围距离最短的O原子有
您最近半年使用:0次



