1 . 在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢.当它们混合时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出过氧化氢的电子式__________ .
(2)写出该反应的化学方程式:______________________________ .
(3)16g液态肼与足量液态过氧化氢反应生成氮气和水蒸气时,放出的热量为__________ kJ.
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是:________________________________________ .
(1)写出过氧化氢的电子式
(2)写出该反应的化学方程式:
(3)16g液态肼与足量液态过氧化氢反应生成氮气和水蒸气时,放出的热量为
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是:
您最近半年使用:0次
2 . 元素X的原子最外层电子排布式为nsnnpn+1。试解答下列各题:
(1)电子排布式中的n=________ ;原子中能量最高的是________ 电子,其电子云在空间有______________________ 方向,原子轨道呈现________ 形。
(2)元素X的名称是________ ;它的氢化物的电子式是________ 。
(1)电子排布式中的n=
(2)元素X的名称是
您最近半年使用:0次
名校
3 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
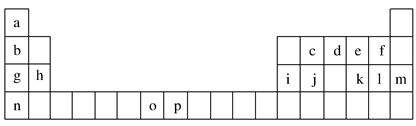
(1)元素p为26号元素,请写出其基态原子的电子排布式________________ 。
(2)d与a反应的产物的分子中,中心原子的杂化形式为________________ 。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:________________________________________________ 。
(4)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是____________________________________ 。
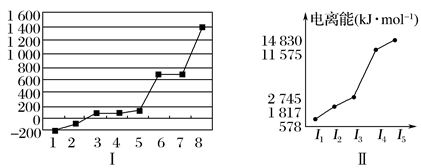
(5)第三周期8种元素按单质熔点高低的顺序如图Ⅰ所示,其中电负性最大的是________ (填图中的序号)。
(6)表中所列的某主族元素的电离能情况如图Ⅱ所示,则该元素是________ (填元素符号)。

(1)元素p为26号元素,请写出其基态原子的电子排布式
(2)d与a反应的产物的分子中,中心原子的杂化形式为
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
(4)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
| 电离能/ (kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
(5)第三周期8种元素按单质熔点高低的顺序如图Ⅰ所示,其中电负性最大的是
(6)表中所列的某主族元素的电离能情况如图Ⅱ所示,则该元素是

您最近半年使用:0次
2017-08-19更新
|
371次组卷
|
2卷引用:2018版化学(苏教版)高考总复习专题十一课时跟踪训练--原子结构与元素的性质
名校
4 . 物质的组成与结构决定了物质的性质与变化,回答下列问题:
(1)量子力学把电子在原子核外的一个空间运动状态称为一个____________ ,电子除空间运动状态外,还有一种运动状态叫做____________ 。
(2)硒常用作光敏材料,基态硒原子的价电子排布式为_______________ ;与硒同周期的p区元素中第一电离能大于硒的元素有_________ 种。
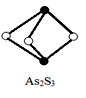
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下图,As原子的杂化方式为___________ ,雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式________________ 。SnCl4分子的空间构型为_______ 。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图。

①储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心则形成的储氢化合物的化学式为_________ 。
②测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为_______ 。(不必计算出结果,用NA表示阿伏伽德罗常数。)
(1)量子力学把电子在原子核外的一个空间运动状态称为一个
(2)硒常用作光敏材料,基态硒原子的价电子排布式为
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下图,As原子的杂化方式为

(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图。

①储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心则形成的储氢化合物的化学式为
②测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为
您最近半年使用:0次
填空题
|
适中(0.65)
|
5 . (1)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____ 晶体,SeO2中Se原子采取的杂化类型为_____________ 。
(2)卤素单质及其化合物在工农业生产和生活中都有重要的用途。
①同主族元素的电负性大小存在一定的规律,卤族元素(F、CI、Br、I)中,电负性最,小的是____ ,基态Br原子的价电子排布为___________________ 。
②硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3分子的分子构型为____ ,BF3-NH3中BF3与NH3之间通过结合____ (填“离子键”、“配位键”或“氢键”)。
(3)某金属是抗癌药物中的明星元素,其晶体中金属原子的堆积方式如右图所示。Mg/mol金属原子的配位数为___________ ;N已知金属的摩尔质量为Mg/mol,原子半径为rpm,阿伏伽德罗常数为NA,则该晶胞的密度为____ g/cm3。(用含M、NA、r的代数式表示,lpm=1.0×10—10cm)

(2)卤素单质及其化合物在工农业生产和生活中都有重要的用途。
①同主族元素的电负性大小存在一定的规律,卤族元素(F、CI、Br、I)中,电负性最,小的是
②硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3分子的分子构型为
(3)某金属是抗癌药物中的明星元素,其晶体中金属原子的堆积方式如右图所示。Mg/mol金属原子的配位数为

您最近半年使用:0次
名校
6 . 铁元素和碳元素形成的单质及化合物在生产、生活中有广泛的用途,
请回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为_________________ ;其最外层电子的电子云形状为___________ 。
(2)(NH4)2Fe(SO4)2 • 6H2O俗称摩尔盐。其阴离子的VSEPR模型名称为____________________ 。
写出一种与NH4+互为等电子体的分子的电子式:________________________________ 。
(3)Fe(CO)5可用作催化剂、汽油抗暴剂等.其分子中σ键和π键的数目之比为______________ 。CO的沸点高于N2的原因是_________________________ 。
(4)碳元素可形成多种单质。
①石墨烯是从石墨中剥离出来的由单层碳原子构成的平面结构新型碳材料。其中碳原子的杂化方式为______________________ 。
料,其中碳原子的杂化方式为 ,
②金刚石的晶胞如图所示。若晶胞参数为a pm,阿伏伽德罗常数的值为NA,则该晶胞中原子的体积占晶胞体积的百分率为________________ ;1cm3晶体的平均质量为___________ (列出计算式即可)。
请回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为
(2)(NH4)2Fe(SO4)2 • 6H2O俗称摩尔盐。其阴离子的VSEPR模型名称为
写出一种与NH4+互为等电子体的分子的电子式:
(3)Fe(CO)5可用作催化剂、汽油抗暴剂等.其分子中σ键和π键的数目之比为
(4)碳元素可形成多种单质。
①石墨烯是从石墨中剥离出来的由单层碳原子构成的平面结构新型碳材料。其中碳原子的杂化方式为
料,其中碳原子的杂化方式为 ,
②金刚石的晶胞如图所示。若晶胞参数为a pm,阿伏伽德罗常数的值为NA,则该晶胞中原子的体积占晶胞体积的百分率为
您最近半年使用:0次
7 . (1)某元素的原子最外层电子排布为3s23p2,它的次外层上电子云形状有_____ 种,原子中所有电子占有____ 个轨道,核外共有____________ 种运动状态。
(2)用镁粉、碱金属盐及碱土金属盐等可以做成烟火。燃放时,烟火发出五颜六色的光,请用原子结构的知识解释发光的原因:______________________________________ 。
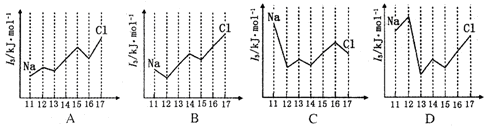
(3)下图中能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的是____ 。
(2)用镁粉、碱金属盐及碱土金属盐等可以做成烟火。燃放时,烟火发出五颜六色的光,请用原子结构的知识解释发光的原因:
(3)下图中能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的是
您最近半年使用:0次
8 . 氮及其化合物在工农业生产中具有重要作用。
完成下列填空:
(1)如图所示为元素周期表中氮元素部分信息,数据“14.01”表示的是____________ ;氮原子最外层电子有________ 种不同的能量,有_______ 种不同运动状态。
(2)NH3可以作制冷剂,是因为________________ NH4Cl溶液与NaOH溶液混合至中性,则c(Na+)_______ c(NH3•H2O)(填“<,>”或“=”)
(3)写出一个能比较氮、氧两种元素非金属性强弱的事实:________________
研究NO2、SO2、CO等大气污染物的处理具有重要意义。NO2可用下列反应来处理:

(4)写出上述反应的平衡常数表达式_______________ 增大该反应平衡常数的措施有__________ (填编号)
A. 增压 B. 增加NH3的浓度 C. 降温 D. 及时移走产物
(5)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是__________ 。(填编号)
A. c(NO2) : c(NH3)=3:4 B.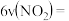
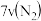
C. 容器内气体总压强不再变化 D. 容器内气体密度不再变化
(6)某温度下,在一个容积为2升的反应容器内,上述反应2分钟后达到平衡,测试NO2减少了0.75mol,则在2分钟内NH3的平均反应速率为: =
=_____________
完成下列填空:
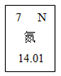
(1)如图所示为元素周期表中氮元素部分信息,数据“14.01”表示的是
(2)NH3可以作制冷剂,是因为
(3)写出一个能比较氮、氧两种元素非金属性强弱的事实:
研究NO2、SO2、CO等大气污染物的处理具有重要意义。NO2可用下列反应来处理:

(4)写出上述反应的平衡常数表达式
A. 增压 B. 增加NH3的浓度 C. 降温 D. 及时移走产物
(5)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是
A. c(NO2) : c(NH3)=3:4 B.
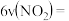
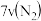
C. 容器内气体总压强不再变化 D. 容器内气体密度不再变化
(6)某温度下,在一个容积为2升的反应容器内,上述反应2分钟后达到平衡,测试NO2减少了0.75mol,则在2分钟内NH3的平均反应速率为:
 =
=
您最近半年使用:0次
9 . (1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
则该元素是_______ (填写元素符号)。
(2)基态C原子中,电子运动状态有_____ 种,电子占据的最高能级符号为_____ ,该能级含有的轨道数为________ 。
(3)关于化合物 ,下列叙述正确的有
,下列叙述正确的有______ 。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D. C原子的杂化方式是sp2和sp3
(4)已知苯酚( )具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子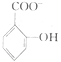 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_____ Ka(苯酚)(填“>”或“<”),其原因是____________ 。
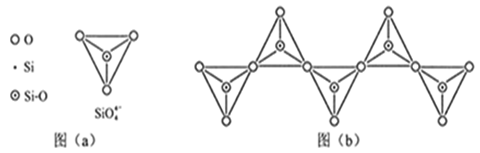
(5)在硅酸盐中,SiO44-四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根的一部分;Si与O的原子数之比为______ ,化学式为_______ 。
| 电离能 | I1 | I2 | I3 | I4 | …… |
| Ia(kJ/mol) | 578 | 1817 | 2745 | 11578 | …… |
则该元素是
(2)基态C原子中,电子运动状态有
(3)关于化合物
 ,下列叙述正确的有
,下列叙述正确的有A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D. C原子的杂化方式是sp2和sp3
(4)已知苯酚(
 )具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-l0;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)(5)在硅酸盐中,SiO44-四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根的一部分;Si与O的原子数之比为

您最近半年使用:0次
2013·上海浦东新·二模
10 . 化学的魅力之一来自于许许多多的“最”。例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇……。根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式_______ ,该分子属
于___________ (填“极性”或“非极性”)分子。
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
_____ (填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是______ 键。
(3)就物理性质而言,第二周期原子序数最小的元素的单质是_________ 最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式:______________________________ 。
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是___ 。
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式
于
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
(3)就物理性质而言,第二周期原子序数最小的元素的单质是
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
您最近半年使用:0次



